МОНОГРАФИЯ Диагностика и лечение деструктивного панкреатита. Лаптев В.В., Нестеренко Ю.А., Михайлусов С.В.. МОНОГРАФИЯ Диагностика и лечение деструктивного панкреатита. Диагностика и лечение деструктивного панкреатита
 Скачать 1.91 Mb. Скачать 1.91 Mb.
|
7.3. Инструментальные методы детоксикации7.3.1. Лапароскопический диализПоказанием к дренированию брюшной полости для проведения пе-ритонеальной инфузии B.C. Маят и соавт. (1977), В.М. Буянов и соавт. (1981), Л.И. Рабинков (1982), Ю.П. Атанов (1986), И.И. Затевахин (1991), Д.А. Смирнов (1991), J.A. Bradley et al.(1981), J.H. Ranson et al. (1990) считают наличие панкреатогенного асептического перитонита. Основная цель проточного диализа — механическое удаление из брюшной полости ферментов и токсических веществ, поступающих из пораженной некротическим процессом поджелудочной железы и парапанкреатической клетчатки. Под контролем лапароскопа устанавливают дренажи в обоих подре- берьях, в латеральные каналы, в подвздошных областях; дополнительный дренаж вводят в полость малого таза. Для инфузии, как правило, ис- пользуется раствор Рингера-Локка (от 4 до 12 л в сутки) с добавлением канамицина. Объем диализата определяется в зависимости от тяжести состояния больных, характера процесса в брюшной полости и его распространенности, наличия признаков печеночно-почечной недостаточности (Савельев B.C. и соавт., 1983). Необходимо контролировать баланс введенной и выведенной жидкости. Перитонеальная инфузия особенно эффективна при серозном выпоте (Navez В. et al., 1998). При обнаружении признаков желчной гипертензии (увеличенный желчный пузырь) может быть проведено чреспеченочное дренирование желчного пузыря (лапароскопическая микрохолецистостомия). Техника видеоскопического дренирования брюшной полости Перитонеальный диализ, точнее, промывание брюшной полости, может производиться несколькими способами. В настоящее время нет необходимости осуществлять лапаротомию для введения дренажей. После уточнения характера панкреатогенного перитонита дренажи, необходимые для осуществления диализа, вводятся под контролем лапароскопа при помощи дополнительного троакара. Этим троакаром пунктируют брюшную стенку ниже правой реберной дуги на 5—6 см по правой среднеключичной линии. Конец троакара направляют в левый нижний квадрант брюшной полости и через просвет в этом направлении вводят дренаж. По мере введения дренажа концом троакара постепенно описы-нают дугу по направлению к правой подвздошной области. При этом вводимый дренаж укладывают в виде дуги у входа в малый таз. Затем постепенно выводят троакар из брюшной полости по направлению к печени, одновременно продолжая вводить дренаж, который теперь укладывается и правом боковом канале брюшины. После удаления троакара дренаж фиксируют шелковыми швами к коже. Второй дренаж— приводящий — шюдят таким же образом через троакар для введения лапароскопа. Его у кладывают в верхнем отделе брюшной полости поверх сальника ниже большой кривизны желудка в направлении к правой доле печени, достигая верхней трети правого бокового канала. Дистальная часть дренажа также выводится наружу и фиксируется к коже. Наиболее удобны для перитонеального диализа при панкреатогенном перитоните полихлорвиниловые дренажи с множественными мелкими отверстиями, расположенными на расстоянии 20-25 мм друг от друга. Их конструкция позволяет ограничиться введением только двух дренажей, которые располагают в виде верхней и нижней дуг. Жидкость, вводимая по приводящему дренажу струйно, просачивается через отверстия в виде «душа» и омывает поверхность органов. Перитонеальный экссудат стекает вниз, в направлении нижнего дренажа, а затем выводится по нему наружу. Схема расположения дренажей для проведения лапароскопического диализа представлена на рисунке 31. Состав диализата может быть различным. Мы применяем следующий состав: 250 мл 0,25% новокаина, 250 мл 0,9% натрия хлорида и 0,25 г канамицина. Этот объем диализата вводится через приводящий дренаж 6 раз в сутки. Мы убедились, что нет необходимости добавлять в диализат ингибиторы ферментов поджелудочной железы, гипер- и гипотонические растворы. Это усложняет приготовление раствора, делает его экономически менее выгодным, не улучшая при этом результатов лечения. Средняя длительность перитонеаль-ного диализа в среднем 3—5 суток. В течение этого времени дренажи хорошо функционируют, по ним выделяется почти вся или 2/3 введенной жидкости. По нашим данным, диализ можно считать эффективным, если выводится до половины введенной жидкости. Если дренажи функционируют менее эффективно, их следует удалить. Изменение цвета и биохимического состава оттекающей жидкости, снижение активности панкреатических ферментов являются показанием для прекращения диализа. Перитонеальный диализ, осуществляемый по описанной методике, уже после первых 2-3 сеансов снимает болевые ощущения в животе, уменьшает интоксикацию, улучшает самочувствие больного. Процедура хорошо переносится больными. Патоморфологические исследования показали, что даже в условиях прогрессирующего панкреонекроза применение перитонеального диализа способствует ликвидации перитонита. В результате проведенного нами перитонеального диализа (465 случаев) серьезных гемодинамических расстройств, нарушений водно-электролитного баланса и белкового обмена не отмечено. На основании собственного опыта, мы считаем необходимым применять лапароскопический диализ во всех случаях панкреатогенного перитонита, сопровождающегося значительным выпотом в брюшной полости. Необходимо отметить несколько особенностей ведения больных с выпотом в брюшной полости при панкреонекрозе: 1. Лапароскопия проводится во всех случаях при выявлении в процессе ультразвукового исследования жидкости в брюшной полости. 2. При проведении эндоскопического исследования необходимо осушить брюшную полость. 3. При значительном количестве выпота во всех отделах брюшной полости устанавливается несколько дренажей для проведения перитонеального диализа. 4. Осуществляется контроль содержания амилазы в выпоте, посев отделяемого на чувствительность к антибиотикам. 5. Перитонеальный диализ проводится до нормализации уровня амилазы в выпоте брюшной полости (как правило, в течение 4—5 дней на фоне комплексной терапии). 6. Обязателен контроль за адекватностью оттока жидкости при проведении диализа. 7. При неадекватном оттоке жидкости из брюшной полости необходимо произвести релапароскопию для проверки расположения дренажей и эвакуации секвестрируемой жидкости. 8. Перед удалением дренажей из брюшной полости необходимо провести контрольное ультразвуковое исследование для подтверждения отсутствия скоплений жидкости в отлогих местах брюшной полости и в малом тазу. 9. При обнаружении жидкостного образования в брюшной полости показана видеоскопическая санационная релапароскопия. 7.3.2. Сорбционные методы детоксикации В последние годы в борьбе с интоксикацией при деструктивном панкреатите значительное внимание уделяется сорбционной детоксикации. К ней относятся гемосорбция (в зарубежной литературе известна как «ге-моперфузия») и плазмаферез. Гемосорбция заключается в экстракорпоральной очистке крови путем ее перфузии через сорбент и последующей реинфузией очищенной крови больному. При плазмаферезе производят жсфузию крови больного, центрифугирование ее с целью отделения плазмы и последующий возврат форменных элементов в кровеносное русло. Плазмопотерю возмещают переливанием донорской плазмы, что ограничивает широкое применение метода в практической медицине. 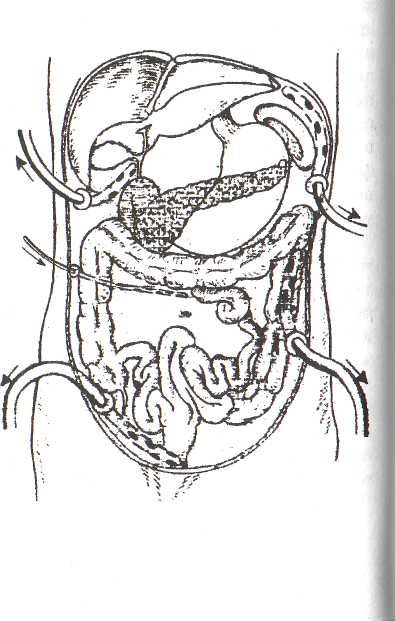 Впервые успешное применение метода детоксикационной гемосорбции в клинике осуществили Н. Vatzidis et. al. (1963) при острых отравлениях барбитуратами. В 1971 г. Ю.М. Лопухин и соавт. впервые в отечественной литературе сообщили о применении активированного угля для экстракорпоральной очистки крови при печеночной коме. М.В. Кузнецова и соавт. (1974) использовали активированные угли в качестве сорбентов с целью удаления из крови трипсина и других ферментов при экспериментальном остром панкреатите. Однако наблюдения показали, что при этом снижается уровень не только трипсина, но и его ингибитора. В течение сеанса гемосорбции прослеживалось также резкое падение комплекса трипсин-ингибитор трипсина, причем приблизительно с такой же скоростью, как и при нелеченном экспериментальном панкреатите. Впервые успешное применение метода детоксикационной гемосорбции в клинике осуществили Н. Vatzidis et. al. (1963) при острых отравлениях барбитуратами. В 1971 г. Ю.М. Лопухин и соавт. впервые в отечественной литературе сообщили о применении активированного угля для экстракорпоральной очистки крови при печеночной коме. М.В. Кузнецова и соавт. (1974) использовали активированные угли в качестве сорбентов с целью удаления из крови трипсина и других ферментов при экспериментальном остром панкреатите. Однако наблюдения показали, что при этом снижается уровень не только трипсина, но и его ингибитора. В течение сеанса гемосорбции прослеживалось также резкое падение комплекса трипсин-ингибитор трипсина, причем приблизительно с такой же скоростью, как и при нелеченном экспериментальном панкреатите.В ряде случаев авторы наблюдали опережающую сорбцию трипсина по сравнению с сорбцией ингибитора, что наталкивает на мысль о возможности подбора таких условий. А.Г. Журавлев и В.Г. Владимиров (1978) впервые в эксперименте на животных с острым панкреатитом проводили гемосорбцию в течение 20 минут на ионообменных смолах. Колонки подключали к артериовенозному шунту через АИК. В результате проведенного лечения было отмечено увеличение в 3 раза средней продолжительности жизни животных по сравнению с контрольной группой. В крови наблюдалось снижение уровня трипсина и его ингибитора. После сеанса гемосорбции нарастание уровня ингибитора трипсина шло более интенсивно, чем трипсина. Этот факт указывает на принципиальную возможность применения сорбционных методов для лечения острого панкреатита. Т. А. Черкасовой и соавт. (1981) при исследовании ряда сорбентов, синтезированных в Московском химико-технологическом институте им. Д.И. Менделеева, и некоторых сорбентов промышленных марок удалось выявить препараты, эффективно и селективно извлекающие протеазы из крови и не разрушающие ее форменных элементов: МХТИ-6К, МХТИ-8К, МХТИ-10К. Е.С. Моргалин и Н.Г. Москаленко (1980) проводили гемосорбцию 10 больным с тяжело протекающим острым панкреатитом. Выраженный эффект наблюдали у 8 больных. После каждой процедуры у них улучшалось самочувствие, снижался уровень билирубина, мочевины, креатини-на. Постепенно нормализовалась гемодинамика, отмечался регресс патологических симптомов со стороны брюшной полости. Особенно демонстративным было купирование интоксикационного делирия, как правило, после первой сорбции. По данным авторов, только раннее и настойчивое применение гемосорбции расширяет возможности консервативного лечения деструктивных форм острого панкреатита. Н.Т. Терехов и соавт. (1981) применили гемосорбцию в комплексе лечебных мероприятий у 21 больного с острым панкреатитом. В качестве ге-мосорбента использовали сферические гранулированные угли СУГС. Авторы наблюдали, что после сеанса гемосорбции в сочетании с комплексной трансфузионной терапией у всех больных на следующие сутки уменьшилась тахикардия, нормализовалась сердечная деятельность, снизились показатели гематокрита и вязкости крови, уменьшилась диспро-теинемия, содержание креатинина в крови и активность трансаминаз, уменьшилась токсичность крови. С.А. Шалимов и соавт. (1981) провели анализ результатов экспериментальных исследований и клинического применения гемосорбции в пред-и послеоперационном периоде у 50 больных с патологией печени, желчных путей и поджелудочной железы. При анализе экспериментальных данных выявлено снижение концентрации сывороточного билирубина на 25%, креатинина — на 70%, пировиноградной кислоты — на 28,3%. I [ри этом содержание общего белка и электролитов к концу гемосорбции существенно не изменялось. В 1982 г. эти же авторы сообщили о целесообразности широкого применения гемосорбции в комплексном лечении острого панкреатита и печеночной недостаточности. Метод имеет ряд преимуществ перед другими методами детоксикации: он технически менее сложен, управляем и безопасен в иммунологическом отношении. Б.Л. Лурье и соавт. (1981,1983) считали, что применение гемосорбции у больных с деструктивными формами острого панкреатита для удаления из кровотока эндогенных токсических веществ патогенетически обосновано. На примере 30 больных они пришли к выводу, что метод является эффективным средством детоксикации, кроме случаев тотального пан-креонекроза, и значительно сокращает сроки лечения. Удаление из крови трипсина способствует купированию патологического процесса, восстановлению структуры поджелудочной железы, а выведение из организма свободных фенолов обеспечивает прерывание интоксикационного психоза и восстановление деятельности центральной нервной системы. Б.К. Шуркалин и соавт. (1982, 1984) применяли экстракорпоральную детоксикацию у больных с деструктивными формами острого панкреатита при неэффективности обычных методов лечения, а также в случаях, когда лимфосорбция не давала детоксикационного эффекта. Авторы отметили быстрое детоксикационное действие гемосорбции с ликвидацией панкреатического шока и интоксикационного делирия, улучшением ге-модинамических и биохимических показателей крови. Н.Т. Терехов и соавт. (1982) определяли у больных с деструктивным панкреатитом и разлитым гнойным перитонитом количество эритроцитов, уровень гемоглобина в крови, степень насыщения эритроцитов гемо глобином, выраженность гемолиза в крови после прохождения ее через сорбент СКН, объем глобулярной массы крови и средний объем эритроцитов, осмотическую резистентность эритроцитов и содержание внутри-и внеклеточного калия и натрия. Результаты проведенных исследований свидетельствуют, что сорбент СКН не повреждает эритроциты. У больных, оперированных по поводу разлитого перитонита и деструктивного панкреатита, после гемосорбции отмечалось улучшение общего состояния, уменьшение перитонеальных симптомов, появление перистальтики кишечника. М.С. Морейно и соавт. (1982) при лечении деструктивных форм панкреатита в качестве сорбентов использовали активированные угли ИГИ и КАУ, а также иониты «Гемосорб А-12». Авторы указывают на целесообразность сочетанного использования неселективного угольного сорбента и ионитов, селективно выводящих протеазы и свободные фенолы, так как катионит «Гемосорб К-6» обладает опережающей сорбцией трипсина, а анионит «Гемосорб А-12» преимущественно сорбирует свободные фенолы. Ю.М. Лопухин и соавт. (1983, 1984,1985) применяли гемосорбцию на углеводных сорбентах: СНК, КАУ, СУГС в комплексной терапии у больных с панкреонекрозом. К гемосорбции приступали после проведения интенсивных противошоковых мероприятий, коррекции волемических нарушений, электролитного баланса и реологических свойств крови. Эффективность лечения оценивалась определением ферментной активности плазмы крови и ее токсичности методом «средних молекул». В результате проведенных исследований авторы пришли к выводу, что гемо-сорбция является методом выбора, обеспечивающим быструю детоксика-цию организма, но это только часть комплексного лечения панкреонекроза. Б.Л. Лурье и М.С. Морейно (1998) изучали влияние гемосорбции на состояние липидного обмена при деструктивном панкреатите. Нарушения липидного обмена в виде гиперлипидемии отмечены у большинства больных острым панкреатитом. Поджелудочная железа принимает непо- средственное участие в липидном обмене и в его регуляции, поэтому его состояние может служит показателем не только функциональной способности поджелудочной железы, но и эффективности лечения (Алимова Р.К., 1975). После гемосорбции, наряду с выраженным клиническим эффектом, наблюдалась нормализация всех параметров липидного обмена в течение 15 дней, за исключением случая тотального панкреонекроза. У обследованных больных контрольной группы изменения параметров липидного обмена в процессе лечения в те же сроки не выявлено. Вышеуказанные данные свидетельствуют о восстановлении функции печени и поджелудочной железы после гемосорбции. И.К. Дуденко и соавт. (1982) применяли гемосорбцию в комплексном мочении различных форм острого панкреатита. Авторы пришли к выводу, что гемосорбция не только сорбирует ферменты поджелудочной железы, но и подавляет функцию последней, что способствует быстрому обратному развитию патологического процесса. Наряду с удалением токсинов, сорбенты оказывают выраженное влияние и на биологически активные вещества: гормоны, медиаторы, ферменты, В частности, имеются данные, что в оттекающей из колонки крови уменьшается концентрация катехоламинов (Лужников Е.А. и соавт., 1979), соматотропного гормона, инсулина, АТФ (Scljirop T. et al., 1977), i иреоидных гормонов (Winchester J., 1977), альдостерона (Kokot F. et al., ll)79). Вместе с тем после гемосорбции отмечалось повышение в крови концентрации иммунореактивного инсулина, паратиреоидного гормона; кратковременное повышение во время гемосорбции активности ренина в плазме (Kokot F. et al., 1979). Г.И. Рябов и соавт. (1988) провели изучение содержания в артериальной крови кортизона, альдостерона, инсулина, соматотропного гормона, трийодтиронина, тироксина, тиреотропного гормона, тестостерона, дегидроэпиандростерона, а также рениновой активности плазмы до и после кмосорбции у больных с панкреонекрозом, реактивным перитонитом и гепаторенальным синдромом. Авторы пришли к заключению, что у больных с панкреонекрозом и гепаторенальным синдромом исходный трмональный статус свидетельствует о стрессовом характере реакции, нозникающей в ответ на патологический процесс. Гемосорбция является фактором, усиливающим защитную реакцию эндокринной системы, и главным образом, по-видимому, по принципу обратной связи. Это частично объясняет механизм лечебного эффекта гемосорбции при различных заболеваниях. Таким образом, все авторы отмечают высокую эффективность гемосорбции, проявляющуюся в ликвидации токсемии и снижении летальности. Однако как самостоятельный метод лечения острого панкреатита, пмосорбция многими авторами не принимается; ее чаще всего применяют в комбинации с другими терапевтическими методами. Опыт сочетанного применения гемосорбции с 5-фторурацилом в литературе не описаны. Анализ результатов сочетанного применения гемосорбции и 5-фу 155 больным с деструктивным панкреатитом показал эффективность лого метода. В качестве гемосорбента мы использовали активированные угли марки СКН-4М и СКН-1К. Важной особенностью данного сорбента пппяется хорошая его совместимость с кровью. Массообменным устрой-1'гном служили колонки вместимостью 400 мл, которые подключали и больному по артериовенозному шунту. Объемная скорость кровотока через колонку равнялась 80-100 мл/мин, продолжительность работы одной колонки составляла 60 минут. Эффективность терапии оценивали на основании общего состояния больного, содержания мочевины, билирубина, креатинина в крови. Кроме того, определяли уровень электролитов в плазме, активность органоспецифических ферментов крови (амилазы, трипсина, ингибитора трипсина, липазы и др.), токсичность плазмы. Исследования выполнены до и после гемосорбции на 1,2,3,5 и 10-е сутки заболевания. В течение гемосорбции контролировали общее состояние больных, показатели гемодинамики (ЭКГ, пульс, АД, ОЦК). Техника гемосорбции, показания, противопоказания Гемосорбцию проводили на стационарной перфузионной системе УЭГ-1. Принцип ее работы состоит в том, что кровь пациента проходит через слой сорбента и щели насадки, высота которых меньше диаметра гранул сорбента. Далее кровь попадает в цилиндр, а оттуда через выходной штуцер и отводящую часть перфузионной системы возвращается к больному. Все детали и узлы перфузионной системы, контактирующие с кровью, стерилизовали и хранили в тройном растворе. Перед началом гемосорбции проводили промывку аппарата стерильной дистиллированной водой, а затем физиологическим раствором (1000-1500 мл) путем рециркуляции по замкнутой системе в течение часа. Перед гемосорбцией с целью обеспечения седативного эффекта назначалась премедикация с использованием анальгетиков, антигистаминных и седативных препаратов (промедол 2% -— 1,0 мл, супрастин 2% или ди- медрол 1% — 2,0 мл, седуксен — 2,0 мл, метацин — 0,5 мл). После катетеризации подключичной вены производили гепариниза-цию крови больного из расчета 200-300 ЕД гепарина на 1 кг массы тела, что исключало тромбоз колонки во время гемосорбции. За 20 мин до гемосорбции гепарин вводили в массообменник из расчета 10 ЕД на 1 мл раствора. После этого осуществляли в течение 20 мин ре- * циркуляцию жидкости по замкнутой перфузионной системе со скоростью 200 мл/мин с целью равномерного распределения гепарина в массообмен-нике и контактирующих с кровью коммуникациях. Затем подключали перфузионное устройство к больному. Нейтрализацию гепарина после окончания гемосорбции осуществляли 1% раствором протамина сульфата в соотношении 1:1. При явлениях гипокоагуляции и признаках арро-зивного кровотечения протамина сульфат вводили повторно. После этого свертываемость крови восстанавливалась до нормальных величин или была близка к ней. Корригирующая доза протамина сульфата не превышала 1,5-2 мг на 1 мг введенного гепарина. При явлениях гиперкоагуляции крови и отсутствии признаков кровотечения в 58 случаях нейтрализацию гепарина не проводилась. Это было связано с тем, что при остром панкреатите циркулирующий в сосудистом русле гепарин улучшает интенсивность тканевого кровотока в поджелудочной железе, а также является неспецифическим ингибитором ферментов, тормозит рост бактерии, обладает антитоксическими свойствами, достаточно эффективен при гипоксии и воспалительных процессах (Попов В.А., 1975). В период гемосорбции контролировали общее состояние больных, показатели гемодинамики (ЭКГ, пульс, АД, ОЦК). Одновременно в процессе гемоперфузии внутривенно вводили лекарственные смеси, в частности переливали донорскую кровь при кровопотере в массообменнике более 250 мл. После окончания гемосорбции вводили внутривенно 50-100 мл альбумина. Во всех случаях полученные данные позволили отметить хорошие сорбционные свойства углеродных сорбентов, индифферентность к клеточным элементам крови (за исключением тромбоцитов, уровень которых после гемосорбции снижался до 25,4%, и лейкоцитов — на 10,3% от исходного уровня.) В ходе лечения гемосорбцию считали показанной в следующих случаях: • неэффективность интенсивной консервативной терапии в течение 12—24 часов с момента установления диагноза; • прогрессирующая тяжелая эндогенная (ферментативная) интоксикация с выраженной клинической симптоматикой и метаболическими нарушениями; • сохраняющиеся боли, требующие систематического введения анальгетиков и спазмолитиков; • развитие осложнений (интоксикационный делирий, механическая желтуха, перитонит, олигурии менее 500 мл в течение суток). Противопоказаниями для проведения гемосорбции явились: • острая сердечно-сосудистая недостаточность и снижение АД — менее 90/60 мм рт. ст.; • выраженные расстройства свертывающей системы крови (гемофилия, фибринолиз, тромбоцитопения и др.); • желудочно-кишечные аррозивные или паренхиматозные кровотечения; • острые расстройства мозгового кровообращения. Относительными противопоказаниями к выполнению гемосорбции считались: • выраженная гипоксия, вызванная сокращением дыхательной поверхности легких (пневмония, отек легких, шоковое легкое); • гипопротеинемия; • гиповолемия; • острая анемия; • острая лейкопения; • лимфоцитопения. При тяжелых деструктивных поражениях поджелудочной железы с развитием гнойных осложнений в поздние сроки гемосорбция временно улучшает состояние больных и позволяет добиться лучших результатов хирургического лечения. Для получения выраженного клинического эффекта в большинстве случаев было достаточным проведения одного сеанса гемосорбции на фоне интенсивной консервативной терапии с внутриаортальным введением 5-фу, особенно в первые часы от начала заболевания. Летальность при сочетанном применении 5-фу и гемосорбции составила 5%. В группе больных, леченных только при помощи гемосорбции, умерло 5 больных (20%). Следует отметить эффективность гемосорбции у больных с деструкцией железы, осложненной интоксикационным делирием или желтухой. После первого сеанса гемосорбции у всех больных исчез кожный зуд, сни-! зился уровень билирубина на 40%. Явления психоза полностью купировались или значительно уменьшались уже к концу первых суток после гемосорбции. У 17 больных в процессе лечения возникли осложнения, связанные с гемосорбцией: озноб, желудочное кровотечение из острых язв, кровоте- чение из раны после ЭПС, гипотензия. Осложнения носили обратимый характер и не привели к смерти больных. Развитием метода явилось предложение С. А. Шалимова и соавт. (1990) проводить региональную гемоперфузию панкреатодуоденальной зоны. Ее осуществляют по замкнутой веноартериальной системе со скоростью 60-90 мл/мин. Для этого используют воротную вену и чревную артерию; в некоторых случаях — верхнюю брыжеечную и селезеночную артерии. Артерии катетеризируют селективно, в зависимости от распространенности очага деструкции при остром панкреатите. Катетеризацию воротной вены осуществляют трансумбиликально, используя внебрюшинный доступ; катетеризацию артерий — по методике Сельдингера, через бедренную артерию, под ангиоскопическим контролем. Учитывая наибольшую концентрацию токсических веществ (патологических метаболитов, протеолитических ферментов и др.) при острол панкреатите в воротной вене, кровь из нее при помощи роликового насо- са подается на колонку с сорбентом, очищается от токсинов и поступает в оксигенатор емкостью 400 мл, в котором охлаждается до температуры (-15 или +20°С посредством работающего одновременно устройства для гипотермии; обогащается кислородом и возвращается в чревную артерию через стандартную одноразовую систему, служащую одновременно иоздушной ловушкой. Непосредственно перед началом перфузии аппарат заполняют раствором перфузата, состав которого и объем соответствуют таковым при экстракорпоральном способе проведения гемосорбции. В процессе перфузии к артериальному концу оксигенатора подключают капельницу с лекарственными смесями (антибиотиками, ингибиторами протеаз, анальгетиками, гемодезом, реополиглюкином, 5% раствором глюкозы), которые вводят в систему в период проведения региональной гемоперфузии. Плазмосорбция Плазмосорбция — метод детоксикации организма путем перфузии плазмы через колонки с сорбентом. Метод разработан и применен в клинике при лечении экзогенных отравлений и острой печеночной недостаточности (Лопухин Ю.М. и соавт.,1977; Шуркалин Б.К., 1977). И.И. Малиновский и соавт. (1991) использовали плазмосорбцию для печения больных деструктивными формами панкреатита при помощи сорбента, иммобилизованного на сефарозе кислотостабильного ингибитора протеиназ (КСИ-сефароза). Плазмосорбция снижает активность протеолитических ферментов в плазме крови больных на 60-75%. КСИ-сефароза обладает определенной ферментной специфичностью — пнгибирует активность панкреатического трипсина, химотрипсина, эла-стазы и в то же время не тормозит активность важнейших протеиназ плазмы крови — тромбина, плазмина, калликреина. Для плазмосорбции использовался аппарат фирмы «Gambro» (Швеция). Длительность процедуры — до 1,5 часа, объем плазмообмена— от 1,2 до 2,2 л. Из 29 больных, меченных данным методом, 22 были оперированы. Летальность в группе больных, которым был применен описанный метод, составила 20,7%. Нами метод непрерывной сепарации плазмы с последующей перфузией ее через колонки с активированным углем (плазмосорбция) проведен 12 больным с деструктивным панкреатитом. Проведено 16 сеансов. Кровь больного поступала в центрифугу, в которой происходило отделение форменных элементов от плазмы (плазмоферез). Скорость сепарации плазмы в центрифуге составляла 25—50 мл/мин. Затем плазма перфузировалась на в сорбенте и возвращалась в вену больного. После плазмофереза уменьшилась интоксикация, снизился уровень ферментов. Количество лейкоцитов, пимфоцитов и эритроцитов существенно не изменилось. Наш небольшой опыт применения плазмосорбции свидетельствует об эффективности этого метода лечения. По способности выведения ток- сических продуктов и ферментов она равноценна гемосорбции. Плазмо-сорбция безопасна и не вызывает травматизации форменных элементов крови, что делает ее методом выбора (Лопухин Ю.М., Молоденков М.Н., 1978). Тем не менее плазмосорбция не получила широкого распространения в клинической практике по экономическим соображениям, а также в связи с трудностями со снабжением сорбентами и аппаратурой. Общим недостатком сорбционных методов является необходимость специальной аппаратуры, обученного персонала и препаратов крови (плазмы) для замещения потерь. Следует иметь в виду, что сам процесс сорбции не оказывает влияния на течение процессов в поджелудочной железе; он позволяет лишь временно очистить кровь и организм от ферментов и токсинов. После окончания перфузии вследствие продолжения процесса в железе вновь возникают признаки интоксикации, для ликвидации которых можно использовать, например, форсированный диурез, требующий меньших материальных затрат. 7.3.3 Лечение панкреонекроза в фазе ремиссииФаза ремиссии (постнекротического инфильтрата) развивается на фоне медикаментозного лечения панкреонекроза после подавления панкреатической секреции, ликвидации болевого синдрома, уменьшения клинических признаков интоксикации и улучшения лабораторных показателей. За последние годы в клинике находилось 583 пациента с постнекротическим инфильтратом. В большинстве наблюдений (359 больных — 61,6%) инфильтрат сформировался на фоне жирового панкреонекроза. Геморрагическая форма аутолиза поджелудочной железы предшествовала инфильтратив-ному процессу у 224 больных (38,4%). Во всех случаях были подтверждены инструментально обширные формы панкреонекроза (тотальный и субтотальный). Фаза ремиссии наступала не ранее 7-12-го дня от начала лечения больных и имела различную продолжительность (3-4 недели) в зависимости от обширности некротического процесса и эффективности проводимой терапии (табл. 18). Клинические и инструментальные признаки осложнения отмечены к 12-му дню нахождения в стационаре у 554 больных из 583 (95,03%). Как показал анализ клинического материала, фаза постнекротического инфильтрата выявляется у пациентов в основном тогда, когда лечение токсемии начинается несвоевременно (при позднем обращении больных за помощью и при нарушениях принципов терапии), проводится не в требующемся объеме, в том числе после лапаротомий в асептической стадии некроза поджелудочной железы (табл. 19). Постнекротический инфильтрат представляет собой конгломерат из увеличенной поджелудочной железы с очагами некроза, желудочно-обо-ппчной связки, большого сальника и брыжейки поперечной ободочной кишки. В образовании инфильтрата принимают участие воспаленная стенка желудка и поперечной ободочной кишки. При геморрагическом некрозе в основном наблюдаются обширные забрюшинные инфильтраты с имбибицией и очагами некроза в забрюшинной клетчатке (Нестеренко Ю.А. и соавт., 1994). В фазе ремиссии панкреонекроза большое клиническое значение имеет уточненная диагностика, помогающая в выборе объема и интенсификации мероприятий. Традиционно применяемые лабораторные тесты, рентгенологические методики, такие как обзорная рентгенография брюшной полости, грудной клетки, а также контрастная рентгенография желудочно-кишечного тракта, не позволяют получить объективную информацию о состоянии поджелудочной железы и клетчаточных пространств. Косвенные же симптомы гнойного процесса (гидроторакс, ателектазы легких, парез кишечника, изменение топографии желудка и двенадцатиперстной кишки) не позволяют принять конкретного тактического решения с определением объема поражения и характера предстоящих санационных мероприятий. Как показывает опыт, сегодня нельзя считать полноценным ведение больных без применения высокоинформативных способов сканирования — ультразвуковой, рентгенологической и магнитно-резонансной томографии (Брискин Б.С. и соавт., 2000; Буянов В.М. и соавт., 1991; Михай-лусов СВ., 1998; Нестеренко Ю.А. и соавт., 1994). В качестве иллюстрации приводим два наблюдения. БолънойК, 42лет (и.б.2837), госпитализирован в стационар с клинической картиной острого панкреатита. Из анамнеза известно, что ухудшение состояния наступило 3 дня назад после злоупотребления алкоголем. Ранее подобных явлений не было. При поступлении выраженный болевой синдром в верхней половине живота, неукротимая рвота. Состояние больного тяжелое. Амилаза крови — 560г/л ч (норма30г/л ч поКаравею). Пациент нормостенического те'лосложения. Сразу при поступлении выполнена лапароскопия, при которой выявлены бляшки стеатонекроза и желтоватый выпот во всех отделах живота, Брюшная полость дренирована для проведения в последующем перитонеального диализа. Пациент госпитализирован в реанимационное отделение, где начато проведение комплексной терапии (инфузионное лечение, внутриаортально» введение 5-фу, антибиотиков— полусинтетических пенициллинов и аминогликозидов). На фоне проводимого лечения состояние больного улучшилось. На 6-е сутки пациент переведен в хирургическое отделение. С 7-х суток отмечено повышений температуры тела до 37,8-38"С, лейкоцитоз, а с 13-го дня пребывания вклини* ке пальпаторно определили инфильтрат в верхней половине живота и влевоЩ подреберье. Продолжена антибактериальная терапия с применением цефало$ поринов. К 19-му дню появились явления гастростаза. Лихорадка сохранялась Рентгенологически на 17-е сутки верифицирован левосторонний гидроторакс Ввиду отрицательной динамики в состоянии больного на21-есутки произведу на лапаротомия, при которой выявлен выраженный инфильтративный процесс с вовлечением желудка, поперечной ободочной кишки, большого сальниЩ мезоколон. При попытке разделения инфильтрата возникло кровотечен При ревизии гнойников в инфильтрате не выявлено. Операция закончена дренированием и тампонированием сальниковой сумки. Послеоперационный период протекал тяжело. Дважды пациент повторно оперирован по поводу кровотечения. На фоне продолжающегося лечения состояние больного стабилизировалось. Рана заживала вторичным натяжением. Больной выписан из стационара на 43-и сутки. Данное наблюдение иллюстрирует возможность ошибки в выборе тактики ведения больного в стадии ремиссии панкреонекроза. Несмотря на манифестирующие клинические проявления процесса, следовало бы более настойчиво продолжить диагностический поиск, идентифициро-нать либо отвергнуть наличие гнойных очагов, что во многом бы изменило подход к ведению пациента и прежде всего позволило бы отказаться от неоправданной лапаротомии. Больная У., 63 лет (и.б. 17592), госпитализирована в стационар с жалобами на сильные боли в верхней половине живота, иррадиирующие в поясничную об-пасть, рвоту, не приносящую облегчения. Давность заболевания — 3 дня. Ухудшение состояния отмечает после приема жирной пищи. Ранее в стационаре не лечилась, не обследовалась. При поступлении в клинику состояние больной средней тяжести. При ультразвуковом исследовании диагностирован жировой панкреонекроз, патологии со стороны билиарного тракта и жидкости в брюшной полости не выявлено. Начато комплексное консервативное лечение в условиях отделения реанимации, включающее эндоскопическую аспирацию панкреатического сока, инфузионное лечение, внутриаортальное введение 5-фу, применение цефалоспоринов. На 12-е сутки пальпаторно выявляется инфильтрат в тигастральной области, отмечено повьпиение температуры тела до 38°С, пепкоцитоз. При динамических ультразвуковых исследованиях на 12—13-е сутки подтвержден инфильтрат сальниковой сумки. На 15-е сутки обнаружены юны разряжении в инфильтрате. Незамедлительно произведена тонкоигольная пункция подозрительных на гнойные очаги зон под контролем ультразвука при помощи игл Хиба. При первичной манипуляции получено 15мл мутной жидкости без запаха. При посеве микрофлоры не выявлено. На фоне сохраняющихся илинико-инструментальных признаков инфильтрата на 26-е сутки произведена повторная пункция инфильтрата. Отделяемого не получено. Продолжена 1штибактериальная терапия с использованием тиенама. На фоне лечения со-i тояние больной улучшилось. На 32-е сутки пациентка выписана из стационара в удовлетворительном состоянии. Данный клинический случай показал практическую ценность уточненной инструментальной диагностики с использованием эхотомогра-фии. Аргументированное отрицание нагноения инфильтрата дало возможность обоснованно продолжить консервативную терапию, что по-шолило получить желаемый результат. Учитывая материальные затраты, с нашей точки зрения, для уточненной диагностики гнойных осложнений панкреонекроза следует шире использовать эхотомографию. На этапе, когда в клинике не было возможности широко использовать лечебно-диагностические возможности эхотомографии, применялась консервативная тактика, основу которой составляла антибактериальная терапия (в основном полусинтетические пенициллины, аминогликози-ды). По мере совершенствования схемы обследования при круглосуточно работающей ультразвуковой хирургической службе стали шире использоваться атибиотики широкого спектра действия, и, наконец, была внедрена уточненная диагностика инфильтрата с включением в комплекс терапии современных препаратов .Как показывает анализ клинического материала, широкое применение ультразвукового исследования позволило значительно сократить количество больных, подвергнутых неоправданным оперативным вмешательствам в фазе ремиссии. Внедрение в повседневную работу тонкоигольных пункций для уточненного обследования пациентов практически исключает вероятность тактических ошибок в процессе лечения инфильтрата. В настоящее время большинство хирургов солидарны во мнении о главенствующей роли антибактериальных препаратов в лечении панкреатического инфильтрата. Несмотря на то, что присоединение вторичной инфекции к дегенеративным процессам, по нашим данным, произошло у 114 больных из 583 (19,6%), все же дальнейшее совершенствование лечебных консервативных программ можно считать весьма перспективным. Как видно из таблицы 20, при использовании современных антибактериальных препаратов широкого спектра действия количество случаев нагноения инфильтрата снижается. Таким образом, ведение больных в фазе ремиссии панкреонекроза должно быть сугубо консервативным. При этом основным компонентом терапии следует считать антибиотики широкого спектра действия (цефалоспорины, карбапенемы, фторхинолоны). В процессе лечения доступное высокоинформативное ультразвуковое исследование оказывает несравнимую помощь в оценке состояния ткани поджелудочной железы и парапанкреатической клетчатки. Кроме того, уточненной диагностике способствуют тонкоигольные направленные пункции под визуальным ультразвуковым контролем. Их использование практически исключает вероятность тактических ошибок при подозрении на нагноение инфильтрата. |
