Инженерная химия (1-21 вопрос). Дисциплина Инженерная химия
 Скачать 0.86 Mb. Скачать 0.86 Mb.
|
|
2. Технологические критерии эффективности химико-технологических процесса (производительность, интенсивность, степень превращения для различных видов реакций, селективность, выход продукта). Производительность, П – это количество полученных продуктов (переработанного сырья) в единицу времени. П = G/t, кг/ч, Т/год, м3/час, кмоль/мин. G-количество получаемого продукта или перерабатываемого сырья за время t. Максимально достигнутая производительность на реакторе называется мощностью. Интенсивность, I – это количество перерабатываемого сырья или образующегося продукта в единице объема аппарата. Этот показатель характеризует интенсивность протекания процесса в технологическом аппарате и совершенство организации процесса. 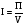 = = 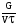 , , 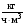 , ,Степень превращения – это доля исходного реагента, использованного на химическую реакцию. 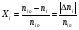 , %, доли , %, долиnio – число молей i-го реагента, входящего в элемент ХТС; ni - число молей i-го реагента, выходящего из элемента ХТС. Откуда, 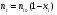 , ,Для обратимых реакций, степень превращения обратимая 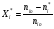 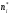 - равновесное количество, выходящего реагента; - равновесное количество, выходящего реагента;Откуда, 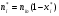 . .Для реакций типа: aA+bB=cC+rR степень превращения вещества рассчитывается для каждого вещества в отдельности. Между которыми существует связь 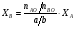 . .Для реакций, протекающих без изменения объема  , степень превращения Хi можно выразить через концентрации: , степень превращения Хi можно выразить через концентрации: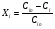 Откуда, 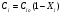 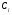 - текущая концентрация i-го реагента (концентрация на выходе из реактора); - текущая концентрация i-го реагента (концентрация на выходе из реактора);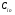 - начальная концентрация i-го реагента. - начальная концентрация i-го реагента.Для реакций, протекающих с изменением объема 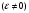 : :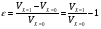 , ,следовательно 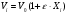 , ,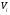 - текущий объем системы; - текущий объем системы; 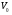 - первоначальный объем системы. - первоначальный объем системы.Например, для реакции 3А+В=2С 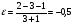 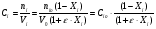 . .Селективность – это отношение количества исходного реагента, расходуемого на целевую реакцию, к общему количеству реагента, пошедшего на реакцию (то есть доля реагента, претерпевшего превращение в какой-то продукт). Селективность бывает полной (интегральной) и мгновенной (дифференциальной). 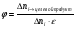 Полная селективность рассчитывается при полном завершении реакци. - для параллельных (последовательных) реакций: aA+bB=cC+rR (целевая) a1A+b1B=zZ+yY (побочная) 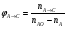 или или 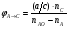 При протекании последовательных, параллельных и последовательно-селективных реакций, селективность может изменяться по закономерностям, проходя через максимум для той или иной реакции. Вводят мгновенную (в данный момент времени) селективность. 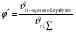 , %, доли , %, доли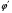 - это отношение скорости расходуемого реагента в целевой продукт к суммарной скорости расходования исходного реагента. - это отношение скорости расходуемого реагента в целевой продукт к суммарной скорости расходования исходного реагента.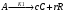 (целевая реакция) (целевая реакция)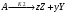 (побочная реакция) (побочная реакция)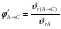 или или 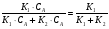 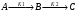 Выход продукта – бывает технологический и химический. Технологический выход – характеризует потери продукта на стадиях выделения. Химический выход – характеризует протекание самой химической реакции в реакторе. Выход (технологический) – это отношение количества продукта, выходящего из элемента ХТС к количеству продукта поступающего в элемент ХТС. Gi Gio Элемент ХТС  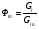 , %, доли. , %, доли.Выделение продукта часто бывает многостадийным. Для последовательно соединенных элементов ХТС: 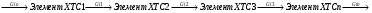 Фm,1 Фm,2 Фm,3 Фm,n 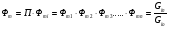 При проведении многостадийных синтезов снижение технологического выхода при выделении играет существенную роль. Выход химический Ф – это отношение реально полученного количества продукта к максимально возможному его количеству по уравнению реакции. aA+bB=cC+rR где R – целевой продукт. 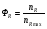 , %, доли. , %, доли.Конечное выражение для химического выхода зависит от химической схемы. - для необратимых реакций: aA=cC+rR, 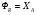 ; ;- для обратимых реакций: 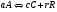 , , 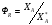 ; ;- для параллельных реакций: 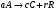 (целевая реакция); (целевая реакция);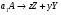 (побочная реакция). (побочная реакция).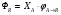 . .Расходные коэффициенты - величины, характеризующие расход различных видов сырья, воды, топлива, электроэнергии, пара на единицу полученной продукции. Особое значение имеют расходные коэффициенты по сырью, поскольку для большинства химических производств 60-70% себестоимости продукции приходится на эту статью расхода. Различают теоретические и практические расходные коэффициенты. Теоретические расходные коэффициенты учитывают расход исходного сырья с учетом стехиометрии реакции. 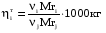 , ,где 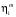 - теоретический расходный коэффициент; i , j – стехиометрические коэффициенты при реагенте и продукте; Mri, Mrj – молекулярная масса реагента и продукта соответственно. - теоретический расходный коэффициент; i , j – стехиометрические коэффициенты при реагенте и продукте; Mri, Mrj – молекулярная масса реагента и продукта соответственно.Примечание: при нахождении числа независимых реакций и составлении стехиометрической матрицы для исходных реагентов в стехиометрические коэффициенты ставят знак «-» (см. разд.2). Практические расходные коэффициенты учитывают селективность процесса, выход продукта, степень превращения и рассчитывают на базе теоретических расходных коэффициентов. 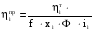 , ,где 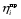 - практический расходный коэффициент; f - технологический выход; xi - степень превращенияi-го реагента; - селективность процесса; ii - содержание i-го реагента в исходном веществе. - практический расходный коэффициент; f - технологический выход; xi - степень превращенияi-го реагента; - селективность процесса; ii - содержание i-го реагента в исходном веществе.Расходные коэффициенты для одного и того же продукта зависят от состава исходных реагентов и могут существенно отличаться друг от друга. Поэтому в тех случаях, когда производство и сырье отдалены друг от друга, необходима предварительная оценка по расходным коэффициентам при выборе того или иного типа сырья с целью определения экономической целесообразности его использования. 3. Принципы составления материальных и тепловых балансов химических реакций. В основе расчета любого процесса лежит уравнение материального баланса. Уравнение материального баланса базируется на законе сохранения массы вещества. 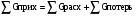 I II III I – сумма всех входящих материальных потоков в элемент ХТС; II – сумма всех выходящих материальных потоков из элемента ХТС; III – суммарные материальные потери в элементе ХТС. Различают теоретический и практический материальные балансы. Теорерический материальный баланс составляется на заданную производительность с учетом только стехиометрии реакции. А+В=С+Д GA+GB=GC+GД Практический материальный баланс рассчитывают на основе теоретического материального баланса с учетом степени превращения, селективности, выхода, соотношения исходных реагентов, степени чистоты сырья, количество растворителя или инертного газа. Уравнения практического материального баланса: 1. 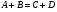 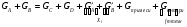 2. 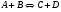 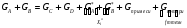 3. 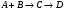  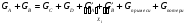 4. 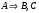 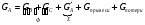 5. 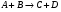 (консекутивная схема) (консекутивная схема)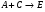 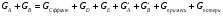 Отклонения практического от теоретического баланса обусловлены тремя основными факторами:
Материальный баланс может быть записан в виде уравнения, таблицы или диаграммы. Тепловой баланс составляется с целью определения теплового режима работы реактора. Реактор может работать в следующих тепловых режимах:
В основе теплового баланса лежит закон сохранения энергии, согласно которому åQприх. = åQрасх. +åQпот åQприх – характеризует сумму всех входящих тепловых потоков; åQрасх – сумма всех выходящих тепловых потоков; ±åQпот – суммарные тепловые потери. Для изотермического режима уравнение теплового баланса: Qреаг ± Qr. ± Qф ± QF = Qпрод,+ Qнагр. + Qпот. где Qреаг – количество тепла, поступающего с исходными реагентами; Qr – тепло химических реакций; Qф – тепло фазовых переходов; Qнагр – количество тепла, необходимое для нагрева сырья до температуры реакции. Qпот не должно превышать 5%. В отличие от материального баланса, тепловой баланс не всегда сходится. Приход тепла: Qреаг – тепло, входящее в реактор с исходными реагентами; Qреаг=∑ Qi Qреаг, i = Gi×Cpi×Ti где Gi – мольный поток i-го реагента; Cpi – теплоемкость i-го реагента, (Дж·моль)/К; 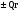 - тепло, выделяющееся (или поглощающееся) в результате химических превращений: - тепло, выделяющееся (или поглощающееся) в результате химических превращений: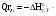 Gi(j) Gi(j)где 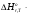 - тепловой эффект химической реакции, (Дж·моль)/К; - тепловой эффект химической реакции, (Дж·моль)/К;Gi(j) – мольный поток i-го реагента, участвующего в реакции (или полученного j-го продукта реакции); 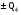 - тепло, выделяющееся (или поглощающееся) в результате фазовых превращений (испарение, конденсация, кристаллизация, плавление, возгонка, растворение): - тепло, выделяющееся (или поглощающееся) в результате фазовых превращений (испарение, конденсация, кристаллизация, плавление, возгонка, растворение):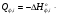 Gi(j)ф Gi(j)фгде Gi(j)ф – мольный поток i-го реагента (j-го продукта), претерпевающегося фазовый переход; 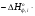 - энтальпия фазового перехода, кДж/моль (справочная величина). - энтальпия фазового перехода, кДж/моль (справочная величина).Расход тепла: Qпрод – тепло, выходящее из реактора с продуктами реакции; Qпрод 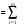 Qпрод, j Qпрод, jQпрод, j = Gj×Cpj×Tj где Gj – мольный поток j-го продукта реакции; Cpj – теплоемкость j-го продукта реакции, Дж/(моль·К); Tj – температура j-го продукта реакции, К. Qнагр – количество тепла, расходуемое на нагревание исходных реагентов до температуры реакции: Qнагр,i = ∑[Gi×Cpi× (Ti,r – Ti)] где Gi – мольный поток i - реагента, подвергаемый нагреву; Cpi – теплоемкость i- реагента, Дж/(моль·К); Ti – температура i- реагента на входе в реактор; Ti,r – температура i- реагента на выходе из реактора. Qпот – тепловые потери (1 – 5% от прихода тепла); Qпот = (0,01– 0,05)∙Qприх , ±QF – количество тепла, отводимое (подводимое) от реактора при помощи теплоносителя (хладоагента). Тепловая нагрузка на реактор. Исходя из тепловой нагрузки на реактор, рассчитывают необходимую поверхность теплообмена F. QF рассчитывают по уравнению: ±QF = Qрасх. - Qприх 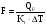 , м2 , , м2 ,где Кt – коэффициент теплопередачи; ∆Т – движущая сила теплопередачи (разность между температурой реакции и температурой теплоносителя). После нахождения поверхности теплообмена F осуществляют ее анализ, сравнивая с поверхностью теплообмена, имеющемся у реактора. F F>Fr – интенсифицируют процесс теплообмена (изменяют К и ∆T) или вводят дополнительные теплообменные устройства. F≈Fr – неустойчивый тепловой режим, но интенсифицировать его проще. Тепловой баланс записывается в виде уравнения, диаграммы или таблицы. 4. Эмпирические методы расчета тепловых эффектов. 1. Эмпирический метод расчета газообразных веществ (при 25оС) 48,8 – коэффициент, выражающий теплоту полного сгорания в расчетах на 1 г атома кислорода; 10,6 – коэффициент, учитывающий теплоту конденсации; m – число атомов кислорода, необходимое для полного сгорания вещества; n – число молей воды, которое образуется в результате сгорания; 2. Расчет С – число атомов углерода в соединении; Н – число атомов водорода в соединении; Р – число частично смещенных электронов в соединении; 3.Расчет εi, εj – энергия связи; n – число твердых атомов в исходном веществе; Qвозг – тепловая возгонка для данного элемента. 4. Эмпирический метод расчета теплоемкости: ni – число атомов; Сi – атомная теплоемкость. |
