Инженерная химия (1-21 вопрос). Дисциплина Инженерная химия
 Скачать 0.86 Mb. Скачать 0.86 Mb.
|
|
5. Термодинамическая вероятность протекания химических процессов. Расчет равновесной степени превращения и равновесного состава реакционной массы по константе равновесия, законы смещения равновесий. Принцип Ле-Шателье. При теоретическом исследовании сложных процессов часто возникает необходимость установить какие реакции из нескольких обратимых термодинамически наиболее вероятны и в каком направлении будет протекать реакция. 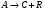 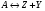 Мерой сродства реагентов к химическому взаимодействию в изобарно-изотермических условиях служит энергия Гиббса  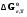 , которую рассчитывают, либо определяют на основе экспериментальных данных по уравнению: , которую рассчитывают, либо определяют на основе экспериментальных данных по уравнению: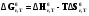 Для расчета 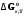 в стандартных условиях используют уравнение: в стандартных условиях используют уравнение: 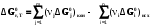 , ,где  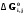 - энергия Гиббса веществ, участвующих в химической реакции при стандартной температуре; - энергия Гиббса веществ, участвующих в химической реакции при стандартной температуре; 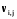 - стехиометрические коэффициенты в уравнении реакции для продуктов реакции и исходных реагентов соответственно; - стехиометрические коэффициенты в уравнении реакции для продуктов реакции и исходных реагентов соответственно; 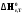 - тепловой эффект реакции при данной температуре; - тепловой эффект реакции при данной температуре; 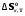 - изменение энтропии реакции при данной температуре; Т-температура реакции. - изменение энтропии реакции при данной температуре; Т-температура реакции.Изменение энтропии реакции при данной температуре можно рассчитать по уравнению: 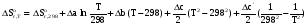 Стандартное значение 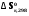 находят по разности между энтропией конечных продуктов и исходных веществ. находят по разности между энтропией конечных продуктов и исходных веществ. 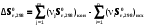 , ,где 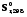 - энтропия химических веществ участников реакции при стандартной температуре; - энтропия химических веществ участников реакции при стандартной температуре; Термодинамическая вероятность протекания химических реакций определяется величиной и знаком энергии Гиббса. При 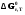 < 0 наиболее вероятное течение прямой реакции (справа налево); при < 0 наиболее вероятное течение прямой реакции (справа налево); при 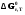 > 0 наиболее вероятное течение обратной реакции (слева направо); при > 0 наиболее вероятное течение обратной реакции (слева направо); при 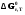 » 0 существует равновесие реакции. Для реальных условий » 0 существует равновесие реакции. Для реальных условий 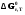 рассчитывают по уравнению Темкина-Шварцмана. рассчитывают по уравнению Темкина-Шварцмана.Если 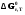 >>0 – реакция не протекает самопроизвольно. >>0 – реакция не протекает самопроизвольно.Если 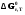 <<0 – реакция протекает самопроизвольно. <<0 – реакция протекает самопроизвольно.Таким образом, рассчитав величину энергии Гиббса для всех реакций, которые теоретически возможны в рассматриваемом сложном и (или) обратимом процессе и сравнивая их, можно установить термодинамически наиболее вероятную реакцию. Если этой реакцией является целевая реакция, то остается по добрать такие параметры технологического режима, которые будут обеспечивать наивысшую степень превращения сырья (наибольший выход продукта). Подбор параметров для обратимых реакций можно проводить при известном значении константы равновесия. Для расчета константы равновесия в изобарно-изотермических условиях используют уравнение изотермы Вант-Гоффа: 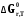 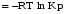 , , 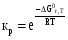 , ,где Кр - константа равновесия, R-универсальная газовая постоянная. Если рассчитанное значение Кр << 1, то равновесие в системе смещено в сторону образования исходных реагентов (выход продукта мал). При Кр>>1, равновесие в системе смещено в сторону образования продуктов реакции (выход продукта велик). Если Кр »1, то система находится в состоянии равновесия. В изохорно - изотермических процессах этот же анализ проводят на основе энергии Гельмгольца 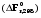 . .Все обратимые химические реакции во времени стремятся к равновесию, при котором скорости прямого и обратного процессов уравновешиваются, в результате чего соотношение компонентов в реакционной массе остается неизменным, пока в системе не изменяются параметры технологического режима (температура, давление, концентрации компонентов). При изменении параметров технологического режима равновесие в системе нарушается и самопроизвольно переходит в новое состояние, которое характеризуется новым соотношением компонентов реакционной массы. Зная значения константы равновесия, можно легко рассчитать состав реакционной массы обратимых химических реакций и определить максимально возможный (теоретический) выход целевого продукта или равновесную степень превращения. Целью расчета равновесного состава является количественное определение содержания компонентов реакционной массы в состоянии равновесия. По этим данным можно рассчитать материальный и тепловой баланс, составить кинетическую модель, а так же рассчитать реактор для обратимых химических реакций. В основе этих процессов лежит закон действующих масс. Рассмотрим, например простую обратимую химическую реакцию: А(г)+2В(г)↔С(г) Если реакция идет в газовой фазе: 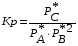 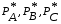 - равновесные парциальные давления соответствующих компонентов в равновесной системе. - равновесные парциальные давления соответствующих компонентов в равновесной системе.Парциальные давления любого компонента с учетом закона Дальтона: 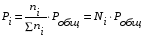 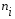 - число молей i-го компонента. - число молей i-го компонента.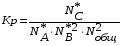 Таким образом, решение задач для определения состава равновесной смеси обратимого процесса сводится к определению мольных долей компонентов смеси, так как общее давление в процессе обычно известно. Определяем мольные доли веществ в состоянии равновесия. Для этого составим таблицу баланса молей:
Тогда суммарное количество молей в состоянии равновесия будет равно 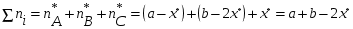 Равновесное значение мольных долей будет вычислена исходя из следующих уравнений: 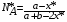 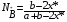 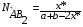 С учётом этих уравнений запишем уравнение для константы равновесия : 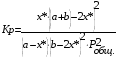 Решаем уравнение при известной Кр относительно х. 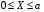 a – в недостатке; a – в недостатке;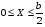 b – в недостатке. b – в недостатке.Этот метод расчета равновесного состава реакционной массы пригоден для любых типов реакций, протекающих в газовой и жидкой фазе. В случае сложных обратимых химических процессов расчет равновесного состава сводится к решению системы уравнений, число которых соответствует числу протекающих равновесных реакций. Принцип Ле-Шателье. Если на систему, находящуюся в равновесном состоянии, воздействовать из вне, изменяя какой-либо из параметров технологического режима (температура, давление, концентрация), то в системе усиливается то направление реакции, течение которого ослабляет данное воздействие. Эндотермическая – повышение температуры в сторону продуктов Повышение концентрации исходных веществ – в сторону продуктов При Для газофазных реакций, протекающих с изменением объема, введение инертного газа, равновесие смещается в сторону продуктов. 6. Кинетика гомогенных химических реакций. Скорость гомогенных химических реакций, зависимость скорости химической реакции от концентрации и температуры. Общее кинетическое уравнение химической реакции. Законы химической термодинамики позволяют определить направление и возможность протекания химической реакции, а также ее энергетический эффект. Однако термодинамика не может ответить на вопросы о том, как осуществляется данный процесс и с какой скоростью. Эти вопросы – механизм и скорость химической реакции является предметом химической кинетики. В гомогенных процессах все регулирующие компоненты находятся в одной фазе: будь то газ, жидкость или твердое вещество. При каталитической реакции катализатор тоже должен находиться в той же фазе, что и реагирующие вещества (гомогенный катализ). Цель кинетических исследований и расчетов – установить кинетическую модель реакции. Для получения кинетической модели первоначально проводят кинетический эксперимент, суть которого заключается в нахождении зависимости концентрации реагирующих веществ (продуктов реакции) от времени при различных условиях. Эту зависимость называют концентрационной зависимостью. На основе концентрационной зависимости можно определить истинную или среднюю скорость химической реакции. 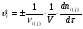 «-» - к i-му исходному реагенту; «+» - к j-му продукту реакции. V=const. 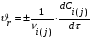 Таким образом истинную скорость реакции можно найти по тангенсу угла наклона к концентрационной зависимости 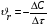 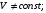 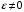 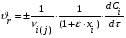 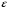 - относительное изменение объема системы. - относительное изменение объема системы.В некоторых случаях скорость реакции можно определить используя степень превращения: 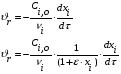 Эти уравнения позволяют рассчитать истинную скорость химической реакции. Зависимость скорости реакции от концентрации. Основной закон кинетики. Согласно основному закону кинетики скорость любой химической реакции в каждый момент времени пропорциональна произведению текущих концентраций реагирующих веществ, возведенных в некоторые степени. Если уравнение реакции имеет вид: 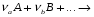 Продукты , Продукты , то для случая, когда она протекает с изменением объема (ε ≠ 0) реакционной массы, то 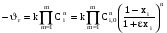 , (1) , (1)а для случая, когда реакция идет без изменения объема (ε = 0) реакционной массы 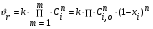 (2) (2)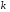 - константа скорости химической реакции; - константа скорости химической реакции;n – порядок реакции; 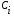 - текущая концентрация i-го реагента; - текущая концентрация i-го реагента; - коэффициент относительного изменения объема реакционной массы; 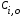 - начальная концентрация i-го реагента. - начальная концентрация i-го реагента.Порядок реакции – это показатель степени при концентрациях в уравнении скорости химической реакции. При этом различают частный и общий порядок реакции. Частный порядок (порядок по данному реагенту) равен показателю степени при концентрации того или иного реагента в кинетическом уравнении. Для - 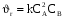 , nA = 2, nB = 1. Общий порядок реакции равен сумме показателей степеней концентраций всех реагентов, которые входят в уравнение. В некоторых случаях показатели степеней при концентрациях в уравнении скорости не совпадают со стехиометрическими коэффициентами, что обусловлено сложным механизмом реакции. Порядок простой реакции равен числу молекул (частиц), участвующих в элементарном акте, он всегда положителен и целочислен (n = 1, 2, 3). Если сложная реакция представляет ряд последовательных стадий, из которых только одна лимитирует (т.е. является самой медленной стадией) весь процесс, то порядок суммарной реакции обычно равен порядку этой лимитирующей стадии. , nA = 2, nB = 1. Общий порядок реакции равен сумме показателей степеней концентраций всех реагентов, которые входят в уравнение. В некоторых случаях показатели степеней при концентрациях в уравнении скорости не совпадают со стехиометрическими коэффициентами, что обусловлено сложным механизмом реакции. Порядок простой реакции равен числу молекул (частиц), участвующих в элементарном акте, он всегда положителен и целочислен (n = 1, 2, 3). Если сложная реакция представляет ряд последовательных стадий, из которых только одна лимитирует (т.е. является самой медленной стадией) весь процесс, то порядок суммарной реакции обычно равен порядку этой лимитирующей стадии.В общем случае порядок сложной реакции может быть любым: целочисленным, дробным, отрицательным (для автокаталитических реакций и цепных автоинициированных процессов). Для того чтобы найти общий порядок реакции, достаточно в эксперименте исходные вещества (реагенты) взять в стехиометрическом соотношении. Порядок реакции по данному реагенту можно определить, взяв все остальные реагенты в большом избытке, чтобы их изменением можно было пренебречь. При этом общий порядок реакции по данному реагенту можно рассчитать, используя: 1) метод, основанный на зависимости начальной скорости реакции от исходной концентрации реагентов (метод начальных концентраций); 2) метод, основанный на зависимости изменяющейся во времени скорости реакции от концентрации реагента (метод текущих концентраций). Рассмотрим эти два метода на примере реакции А + В → С + D При использовании первого метода проводят серию опытов с различными начальными концентрациями реагента А (СА,0), снимая зависимость СА = f(τ). Для каждого опыта определяют известными методами начальную скорость реакции и по уравнению 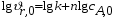 , (3) , (3)определяют порядок реакции, используя аналитический метод или логарифмическую анаморфозу. При применении второго метода в начале определяют в различные моменты времени концентрацию реагента А (сА). Затем строят график зависимости сА = f (τ), по которому для различных моментов времени находят скорости реакции. После этого, используя известное уравнение 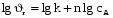 , (4) , (4)графическим или аналитическим методом определяют порядок реакции. Порядок реакции также можно определить: 3) методом подбора уравнений. Метод основан на подстановке экспериментальных данных изменения концентрации веществ во времени в кинетические уравнения реакций различных порядков: для реакции 1- го порядка 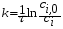 , (5) , (5)для реакции 2-го порядка 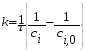 , (6) , (6)для реакции 3-го порядка 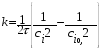 , (7) , (7)где τ- время, сек; с0 –начальная концентрация, моль/л; с- текущая концентрация, моль/л. Искомый порядок реакции соответствует тому уравнению, для которого при различных начальных концентрациях исходных веществ и в различные моменты времени при заданной температуре величина константы скорости будет оставаться постоянной. 4) графический метод. Находят такую функцию от концентрации, которая на графике зависимости ее от времени дает прямую линию. Из кинетических уравнений реакций различных порядков (уравнение 7.5-7.7) видно, что если функцией является lnc0/c, то реакция первого порядка, если 1/с, то реакция второго порядка, если 1/с2 – то реакция третьего порядка. Зависимость скорости химической реакции от температуры. Скорость химической реакции также зависит от температуры, и при увеличении температуры на 100С скорость химической реакции увеличивается в 2 – 4 раза (правило Вант - Гоффа). Более точное описание зависимости скорости реакции от температуры определяется уравнением Аррениуса: 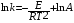 , (8) , (8)где А - предэкспоненциальный множитель; E – энергия активации; R-газовая постоянная. Избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение могло привести к образованию нового вещества, называется энергией активации Если в уравнении (8) в качестве переменных выбрать lnk и 1/T, то на графике получится прямая линия, а тангенс угла наклона прямой позволяет определить энергию активации химической реакции (рис 7.1) lnk 1/Т lnА φ 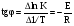 Рис. 7.1. Зависимость логарифма константы скорости химической реакции от обратной температуры Проинтегрируя (5), получим зависимость: 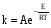 (9) (9)Если уравнение (5) проинтегрировать в пределах от Т1 до Т2, можно получить уравнение для расчета энергии активации: 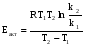 , (10) , (10)где k2 , k2 –константы скорости реакции при Т2 и Т1 Подставляя уравнение (8) в уравнения (1) и (2), можно получить полное кинетическое уравнение химической реакции. 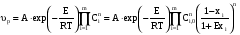 (11) (11)если ε 0, то 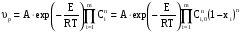 (12) (12)Таким образом, скорость химической реакции зависит от концентрации реагирующих веществ (от степени превращения), энергии активации, температуры, константы Аррениуса и относительного изменения объема реакционной массы. Кинетические расчеты осуществляются с целью получения полной кинетической модели изучаемой реакции, установления механизма реакции и последующего определения времени пребывания реагентов в реакторе. |
