Инженерная химия (1-21 вопрос). Дисциплина Инженерная химия
 Скачать 0.86 Mb. Скачать 0.86 Mb.
|
|
Основные модели топохимических процессов При описании топохимических процессов используют две модели: 1. Квазигомогенная модель 2. Модели частицы с фронтальным перемещением зоны реакции (модель частицы с невзаимодействующим ядром) Квазигомогенная модель. Согласно этой модели топохимического процесса реакция протекает одновременно во всех точках объема твердой фазы. Такая модель реализуется, если протекает медленная химическая реакция г. или ж. реагента с высокой пористой твердой фазой. Данная модель не получила широкого распространения в вследствие трудности создания твердой фазы. Модели частицы с фронтальным перемещением зоны реакции. Согласно этой модели реакция первоначально протекает на внешней поверхности твердой фазы, пока она полностью не прореагирует. По мере протекания реакции образуются твердые продукты реакции, которые называются золой. В дальнейшем исходные газообразные реагенты диффундируют через слой золы к поверхности твердой фазы. После этого протекает реакция взаимодействия продиффундирующей газовой фазы с исходной тв. фазы. Зона реакции постепенно перемещается вглубь твердой частицы и завершается после ее полного исчезновения. В произвольные моменты времени твердая частица представляет собой внутреннее ядро, окруженное внешней оболочкой. Ядро состоит из непрореагирующего реагента, поэтому эту модель называют моделью с непрореагирующем ядром. Окружающая его оболочка состоит из твердого продукта и инертных веществ. Данная модель значительно точнее отражает действительную модель процесса, поэтому и получила наибольшее распространение. В связи с этим рассмотрим механизм и кинетику топохимического процесса, описываемого данной моделью. Большинство топохимических процессов описываются моделью с невзаимодействующим ядром (рис 2.1). Согласно модели с невзаимодействующим ядром, химическая реакция вначале протекает на внешней поверхности твердой частицы. Зона реакции постепенно продвигается внутрь ее, оставляя за собой полностью превращенный продукт (золу). Следовательно, в любой момент времени имеется частица твердого материала с постоянным объемом, которая включает в себя невзаимодействующее ядро твердого материала, размер которого в ходе реакции постоянно изменяется (уменьшается). Ств Ств 3- ядро Ств 1- ГЛП 2- «зола» 4- поверхность R R R τ1 τ2 τ3 Рис 2.1. Модель частицы с невзаимодействующим ядром в различные моменты времени: τ1 ,τ2 ,τ3 ; (τ1 <τ2 <τ3); 1-газовая (жидкая) ламинарная пленка (ГЛП); 2-слой твердого продукта реакции («зола»); 3- ядро (исходный твердый реагент); 4-поверхность, на которой протекает химическая реакция Механизм и скорость процессов взаимодействия газа (жидкости). При анализе механизма процесса для частиц с невзаимодействующим ядром можно выделить 5 стадий развития процесса (рис 2.2.):
1 5 3 4 2 А Г ВТ ВТ А Г Рис. 2.2. Механизм процесса для модели с невзаимодействующим ядром В зависимости от лимитирующей стадии для топохимических процессов различают внешнедиффузионную(I; V), внутридиффузионную(II; IV) и кинетическую области(III) протекания процесса. Если сопротивление химической реакции и сопротивление переноса исходного реагента через слой «золы» будет значительно меньше сопротивления диффузии исходного реагента через ГЛП, считается, что топохимический процесс протекает во внешнедиффузионной области. При внешнедиффузионной области протекания топохимической реакции для частиц сферической формы и одинакового размера (лимитирующими стадиями являются стадии 1, 5) , процесс описывается кинетическим уравнением вида: 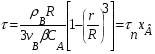 Если сопротивление диффузии жидкого (газообразного) реагента газовой пленке, окружающей ядро твердого реагента и сопротивление химической реакции на границе раздела фаз: исходное вещество – продукт значительно меньше, чем сопротивление через слой «золы», то общая скорость процесса лимитируется внутренней диффузией реагента через слой «золы». Для внутренней диффузии (лимитирующими стадиями являются стадии 2, 4) в этом случае уравнение кинетики выглядит следующим образом: 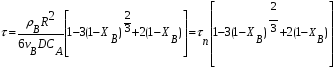 Когда скорость топохимического процесса целиком определяется химической реакцией (лимитирующей стадией является стадия 3) , то время пребывания твердого реагента в реакционной зоне, т.е. в кинетической области можно определить по формуле: 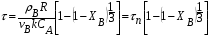 В уравнениях: В - мольная плотность вещества В, моль/см3; B - стехиометрический коэффициент при твердом веществе В; R - радиус твердой частицы; r - радиус невзаимодействующего ядра; - коэффициент массопередачи; D - коэффициент диффузии; k - константа скорости; n - время полного превращения твердого исходного реагента; XB - степень превращения вещества В. Экспериментальные методы определения области протекания топохимического процесса: 1. Изучение зависимости скорости топохимического процесса от температуры. Для этого проводят топохимический процесс в широком интервале температур и определяют скорость процесса при полном превращении твердой фазы. 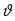 1 12 3 U1 U2 U3 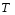 Первая область характеризуется экспериментальны увеличением скорости от времени, что соответствует кинетической области. Вторая область характеризуется соизмерительными скоростями, что говорит о том, что топохимический процесс протекает в переходной области. На третьей стадии слабая зависимость скорости от температуры, а также зависимость от линейной скорости движения газа – диффузионная область. 2. Сопоставление теор. и эксер. зависимости 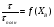 Для внешнедиффузионной области: 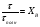 Для внутридиффузионной: 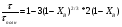 Для кинетической области: 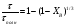 По этим уравнениям строят теор. зависимости. Далее проводят эксперимент и с помощью аналитического метода определяют степень превращения. Если экспериментально точки ложатся на одну из теоретических зависимостей, то предполагают, что процесс протекает в той области, которой соответствует данная теоретическая зависимость. 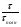 III IIIII I  3. Оценка влияния размеров частиц твердой фазы Согласно этому методу проводят серию опытов при постоянной температуре, давлению, скорости движения газовой фазы и различных размеров твердой фазы. Строят график зависимости Хв от времени Хв=1 R1 R2 R3 Хв время Определяют время полного превращения твердой фазы и рассчитывают время полного превращения твердой фазы и размеров. Для внешнедиффузионной области: 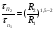 Для внутридиффузионной области: 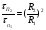 Для кинетической области: 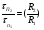 14. Общие положения, понятие о химических реакторах, классификация химических реакторов: периодические, непрерывнодействующие и полупериодические реакторы. Под химическим реактором подразумевают аппарат, в котором осуществляют химическую реакцию. Конструкция реактора и химический процесс, протекающий в нем оказывают важное влияние на технологию производства целевого продукта, прежде всего на стадии выделения целевого продукта. Химические реакторы классифицируют по:
- изотермический режим (температура на входе, выходе и в самом реакторе одинакова); - адиабатический режим (отсутствует теплообмен с окружающей средой); - политропический режим. В изотермическом реакторе поддерживается постоянная температура за счет циркуляции хладагента (теплоносителя), за счет испарения веществ, находящихся в реакторе. В адиабатическом реакторе тепло выделяющееся или поглощающееся в результате химической реакции идет на нагрев (охлаждение) реакционной массы. В политропическом режиме (смешанный тепловой режим) существуют зоны, где реализуется изотермический режим и зоны в адиабатическом режиме.
Реакторы смешения – за счет эффективного перемешивания выравниваются концентрации реагирующих веществ и продуктов реакции во всех точках объема реакционной массы. Реакторы вытеснения называют также проточными реакторами. При эффективном перемешивающем устройстве и небольшом объеме реактора можно создать в нем режим идеального смешения.
1. Реакторы периодического действия - подвод и отвод осуществляется периодически. 2. Реакторы непрерывного действия – подвод и отвод осуществляется непрерывно. 3. Реакторы полунепрерывного действия - подвод осуществляется периодически, а отвод продуктов непрерывно. 4. Реакторы полупериодического действия – подвод сырья осуществляется непрерывно, а отвод продуктов периодически. 4) По конструкции: (аппараты емкостного типа, шахтного типа, колонного типа, типа котел (автоклав) и т. д.). 5) По стационарности процесса: (реактора стационарного типа, нестационарного типа). В стационарных реакторах отсутствует градиент параметров во времени (реактора изотермического типа непрерывного действия). К нестационарным реакторам относят реактора периодического действия.
- с неподвижной твердой фазой; - с движущейся твердой фазой (прямоток, противоток); - реактора с кипящей твердой фазой (псевдоожиженный режим). При расчете любого химического реактора используют уравнение материального баланса записанного в виде мольного потока i-го исходного реагента: 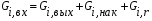  - количество i-го исходного реагента, поступающего в элементарный объем реактора в единицу времени; - количество i-го исходного реагента, поступающего в элементарный объем реактора в единицу времени;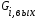 - количество вещества, выходящего из элементарного объема реактора в единицу времени; - количество вещества, выходящего из элементарного объема реактора в единицу времени;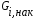 - количество i-го исходного реагента накапливаемого в элементарном объеме реактора; - количество i-го исходного реагента накапливаемого в элементарном объеме реактора;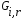 - количество i-го исходного реагента, вступившего в реакцию. - количество i-го исходного реагента, вступившего в реакцию.15. Общие положения, понятие о химических реакторах, классификация химических реакторов: изотермические, адиабатические и политропные реакторы, реакторы смешения и вытеснения. Под химическим реактором подразумевают аппарат, в котором осуществляют химическую реакцию. Конструкция реактора и химический процесс, протекающий в нем оказывают важное влияние на технологию производства целевого продукта, прежде всего на стадии выделения целевого продукта. Химические реакторы классифицируют по:
- изотермический режим (температура на входе, выходе и в самом реакторе одинакова); - адиабатический режим (отсутствует теплообмен с окружающей средой); - политропический режим. В изотермическом реакторе поддерживается постоянная температура за счет циркуляции хладагента (теплоносителя), за счет испарения веществ, находящихся в реакторе. В адиабатическом реакторе тепло выделяющееся или поглощающееся в результате химической реакции идет на нагрев (охлаждение) реакционной массы. В политропическом режиме (смешанный тепловой режим) существуют зоны, где реализуется изотермический режим и зоны в адиабатическом режиме.
Реакторы смешения – за счет эффективного перемешивания выравниваются концентрации реагирующих веществ и продуктов реакции во всех точках объема реакционной массы. Реакторы вытеснения называют также проточными реакторами. При эффективном перемешивающем устройстве и небольшом объеме реактора можно создать в нем режим идеального смешения. 16. Расчет изотермических реакторов для проведения гомогенных химических процессов, реакторы идеального смещения периодического действия, реакторы идеального смешения непрерывного действия, реакторы идеального вытеснения, реакторы идеального смешения полупериодического действия, последовательное соединение реакторов вытеснения и смешения, произвольная система идеальных реактор. Расчет реактора РИС-П В реакторе идеального смешения за счет эффективного перемешивания выравниваются концентрации реагирующих веществ и продуктов реакции во всех точках объема реакционной массы. Для достижения эффективного перемешивания применяются различные перемешивающие устройства: мешалки, барботеры. Обычно это реактора емкостного типа. Сi Cj Cj Ci   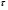 Xi=1 Xi Ci C i,1; 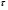 C i,2; 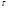 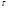 У(X, Z) У(X, Z)Для периодического реактора: 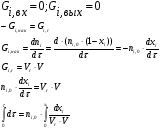 Разделяем переменные и интегрируем: 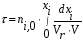 где Vr – скорость химической реакции; V – объем реакционной массы. Если V=const 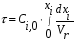 Эти выражения позволяют рассчитать время реакции при заданной степени превращения и известном уравнении скорости химической реакции. Частные случаи будут зависеть от изменения объема системы и от уравнения скорости. 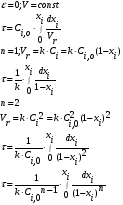 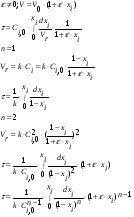 Если объем системы постоянный, то 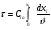 Объем РИС-П рассчитывается по уравнению: 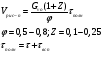 Z – коэффициент запаса мощности 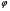 -коэффициент заполнения -коэффициент заполнения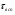 - вспомогательное время для проведения процесса (загрузка, нагревание, охлаждение, выгрузка продукта и т. д.). - вспомогательное время для проведения процесса (загрузка, нагревание, охлаждение, выгрузка продукта и т. д.).Для характеристики работы реактора вводят 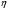 : : 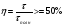 Реактор идеального смешения непрерывного действия РИС-Н Сio;Ci Хi 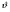 У У 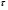 1 С=const 2 X=const 3 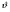 =const =constВ реакторе концентрация любого компонента постоянна по всему объему. Поэтому уравнение мат. баланса имеет вид: 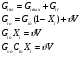 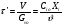 - проектное уравнение РИС-Н - проектное уравнение РИС-Н 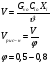 Реактор идеального вытеснения РИВ В РИВ реакционная масса движется в одном направлении без продольного или поперечного перемещения. В виду схожести движения реакционной массы с движением поршня этот режим еще называют поршневым. Обычно такой режим достигается в аппаратах колонного типа и соотношение l /d >20. Ci Gio,Cio dV C Cio  Cj l Ci=f(l) Xi=f(l) Материальный баланс для РИВ записывается на единицу элементарного объема 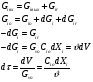 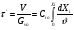 - проектное уравнение РИВ - проектное уравнение РИВ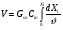 Частные случаи определяются уравнением скорости и изменением объема. |
