Инженерная химия (1-21 вопрос). Дисциплина Инженерная химия
 Скачать 0.86 Mb. Скачать 0.86 Mb.
|
|
10. Основные стадии и кинетические особенности гетерогенно- каталитических процессов. Гетерогенно-каталитическая реакция на поверхности твердого катализатора – это сложный многостадийный процесс. Наблюдаемая общая скорость каталитической реакции зависит от относительных скоростей нескольких различных по своей физической и химической природе стадий. Рассмотрим основные стадии процесса взаимодействия газообразного реагента с зерном пористого катализатора. 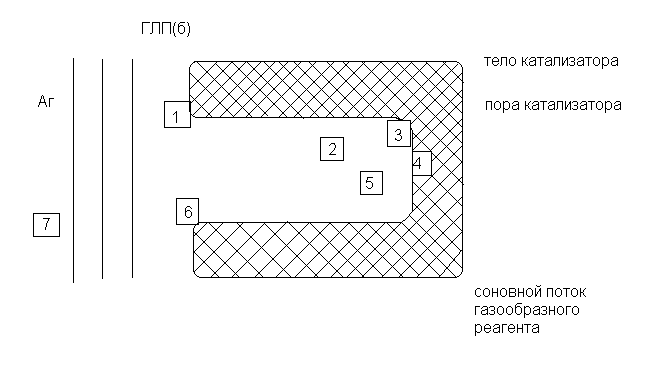 Основной поток Согласно общепризнанной модели вблизи поверхности катализатора существует пограничная газовая ламинарная пленка, которая препятствует прохождению молекул газа через нее. Гетерогенно-каталитическая реакция протекает внутри поры катализатора. Доля реакций, протекающей на внешней поверхности катализатора ничтожно мала. Перенос вещества осуществляется за счет конвективной, и за счет молекулярной диффузии. 1-я стадия. Как и в гетерогенном некаталитическом процессе, сначала происходит диффузия газообразного реагента из основного потока к внешней поверхности зерна катализатора через газовую ламинарную пленку, в которой концентрация реагента ниже, а концентрация продукта выше, чем в основном потоке. Эту стадию можно назвать стадией внешней диффузии. 2-я стадия. Основная часть молекул газообразного реагента диффундирует внутри пор катализатора (стадия внутренней диффузии). Скорость диффузии молекул через пористую среду во много раз меньше скорости их поступательного движения. Это объясняется тем, что во время прохождения через катализатор молекулы сталкиваются со стенками пор и с другими молекулами, что приводит к совершенно беспорядочному их движению. В зависимости от соотношения длины свободного пробега молекул и диаметра пор, а также от перепада давления вдоль поры различают объемное (свободное) течение газов, течение Кнудсена и вынужденное течение. Все эти виды диффузии можно описать уравнениями молекулярной диффузии (законы Фика). 3-я стадия. Молекулы реагента адсорбируются на поверхности катализатора. Адсорбция представляет собой явление, связанное с уменьшением количества газа при соприкосновении газа (адсорбата) с твердым телом (адсорбентом), и заключается в некотором уплотнении газа на поверхности твердого тела. Различают физическую адсорбцию и хемосорбцию в зависимости от природы сил, вызывающих это концентрирование молекул адсорбата у поверхности твердого тела. Если эти силы имеют такую же природу, как и молекулярное взаимодействие в газах, жидкостях и твердых телах, говорят о физической адсорбции. При хемосорбции проявляются силы взаимодействия химической природы – молекулы адсорбата теряют свою индивидуальность, образуя поверхностные соединения с адсорбентом. (стадия адсорбции) При протекании каталитических процессов основная роль принадлежит хемосорбции, или активированной адсорбции, результатом которой является образование активированного комплекса адсорбции – неустойчивого промежуточного соединения между реагентом и катализатором. Стадия активированной адсорбции определяет специфичность действия катализаторов в отношении различных реакций. Если химическая связь реагента с адсорбентом слишком сильная, разрушение образовавшегося комплекса, ведущее к образованию продуктов, затрудняется. Если же связь адсорбента и адсорбата слишком слабая, близкая по своей природе к физической адсорбции, в молекуле адсорбата не происходит разрыхления связей, приводящих к снижению энергии активации каталитического процесса по сравнению с некаталитическим процессом. 4-я стадия. Вслед за адсорбцией происходит собственно поверхностная химическая реакция, которая заключается либо в перегруппировке активированного комплекса адсорбции, либо во взаимодействии одного адсорбированного реагента с молекулами другого. Механизм этой реакции может быть различным; от него зависит и вид кинетического уравнения. В результате поверхностной реакции образуется адсорбированный продукт. (кинетическая стадия). 5-я стадия. Следующим этапом процесса является десорбция продукта с поверхности катализатора. На этом этапе также проявляются специфические свойства катализатора: энергия связи адсорбированного продукта и адсорбента должна быть такой, чтобы десорбция в объем не вызывала затруднений. (стадия десорбции). Стадии 3, 4, 5 являются центральными в ходе каталитического процесса. Суммарно их можно рассматривать как поверхностную химическую реакцию. Эти стадии могут протекать одновременно с предыдущими – диффузионными – стадиями, причем как на внешней поверхности зерна катализатора, так и на внутренней поверхности пор. 6-я стадия. Десорбированные газообразные продукты диффундируют из пор к внешней поверхности катализатора (обратная внутренняя диффузия). 7-я стадия. Газообразные продукты диффундируют от поверхности катализатора в газовый поток через пограничную пленку, окружающую зерно катализатора. Таким образом, гетерогенно-каталитический процесс – это сложная система последовательных и параллельных стадий, имеющих разную природу. Как и в случае некаталитического гетерогенного процесса, одна из стадий может оказывать наиболее сильное тормозящее воздействие на весь процесс, тогда скорости остальных стадий «подстраиваются» под скорость этой наиболее затрудненной стадии, которая может быть названа лимитирующей. В зависимости от лимитирующей стадии ГКП может протекать в следующих областях: внешнедиффузионной (наиболее медленная 1 и 7); внутренней диффузионной (наиболее медленная 2 и 6); область адсорбции и десорбции (4 и 5); кинетическая область (наиболее медленная 4). Если ГКП протекает в тех случаях, когда скорости стадий соизмеримы между собой, то считают, что ГКП протекает в переходной области. С0 С0 С0 С0 11. Исследование кинетики гетерогенно-каталитичексих процессов в дифференциальном и интегральном реакторе. Определение лимитирующей стадии гетерогенно-каталитических процессов. С С С С0 С0 С С0 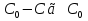 Схемы установок для кинетических измерений
 - кинетическая область - кинетическая область – диффузионная область – диффузионная область
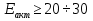 ккал/моль – кинетическая область ккал/моль – кинетическая область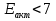 ккал/моль – диффузионная область ккал/моль – диффузионная область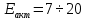 ккал/моль – переходная область ккал/моль – переходная область
Исходя из объемного расхода и площади поперечного сечения рассчитывают линейную скорость и строят график зависимости: U Xi I II Сv,3 Сv,2 Сi,3 Сi,2 xi,1 xi,2 xi,3 xi,1 xi,2 xi,3 I – внешнедиффузионная область 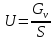 =[м/сек] =[м/сек] II – внутридиффузионная обл.
1/R Xi I II G3,v G2,v G1,v Сi,1 Xi,1 Сi,1 Xi,3 Сi,1 Xi,2 I – внутр.диффузия II – адсорбционная или кинетическая обл t, d, mkat, Ci,o, Gv,o=const, R-var От размера частиц зависит внутренняя диффузия. Проводят серию опытов при одинаковом значении массы катализатора, объемном расходе, диаметре реактора, температуры, начальной концентрации газообразного реагента и переменном значении размера частиц.
Для обработки полученных данных используются интегральные и дифференциальные методы. Для эксперимента используются интегральные проточные реактора, либо дифференциальные реакторы смешения. Проводят ряд опытов при T=const, mkat=const, Co=const, R частиц kat = const, d=var. S – разная, значит U – разная и время реакции разное. 12. Кинетика гетерофазных химических. Процессов в системах газ-жидкость, жидкость-жидкость (несмешивающиеся). Диффузионная, кинетическая и переходная области гетерофазного процесса. Газожидкостные реакции – это гетерогенные процессы, включающие химические взаимодействия между реагентами, один из которых находится в газовой фазе, а другой в жидкой. В виду схожести механизмов к этим процессам относят и системы жидкость-жидкость несмешивающаяся. Газожидкостные реакции находят широкой применение в промышленности: хлорирование ароматических соединений, в экологии, адсорбция кислых газов водными растворами щелочей, поглощение угарного газа и др. Газожидкостным реакциям предшествует процесс абсорбции газа жидкостью. Этот процесс является равновесным. Количество абсорбированного газа зависит от температуры, давления, концентрации, с увеличением давления и уменьшением температуры количество абсорбируемого газа возрастает, т.к абсорбция протекает на границе раздела фаз, то существенное значение имеет величина поверхности раздела фаз. Кинетические модели газожидкостных реакций получила модель Льюиса – Уитмана. Согласно этой модели между газом и жидкостью существует граница раздела фаз. Вблизи границы располагаются пограничные пленки, в которых сосредоточены диффузионные сопротивления. Диффузия вещества происходит через эти пограничные пленки и описывается уравнением молекулярной диффузии. Конвективный перенос вещества в пленках отсутствует. В объемах жидкой и газовой фазах происходит интенсивное перемешивание. В связи с этим отсутствует градиент концентрации. В зависимости от используемой системы реагентов различают: 1. Однопленочную модель имеет место в системах г-ж 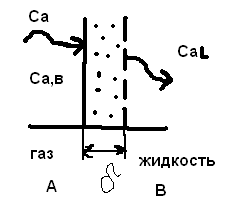 2. Двухпленочную модель имеет место в системах ж-ж несмешивающаяся. 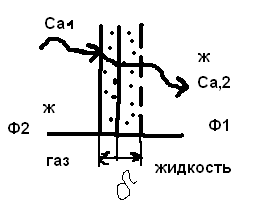 В соответствии с моделью Л-У зона реакции может находится на границе раздела фаз в пограничных пленках и в объемах фаз. При этом расположенные в зонах реакции зависит от концентрации или парциального давления исходных реагентов, поверхности раздела фаз, соотношение скоростей диффузии и скорости химической реакции. Если скорость диффузии меньше, чем скорость самой реакции, то газожидкостная реакция протекает в диффузионной области, а зона реакции, располагается либо на границе раздела фаз, или на пограничных пленках. Если наоборот, то в кинетической области. При этом зона реакции находится в объемах жидкой фазы. Диффузионная область. Рассмотрим наиболее общий случай, когда зона реакции расположена внутри пограничной диффузионной пленки. Применяя двухпленочную модель для реакции типа Аж + Вж = продукты нарисуем профиль изменения концентраций реагентов в данной области. Наиболее общий случай когда реакция протекает в пограничной пленке одной из фаз. 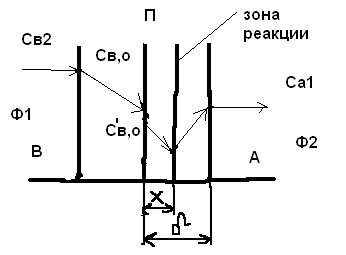 Профиль изменения концентрации исходных реагентов Аж и Вж в диффузионной области в случае протекания реакции в пограничной области фазы 1. Уравнение диффузионных потоков для стационарного режима складывается из уравнений диффузий вещества В через свою пограничную пленку, через чужую пограничную пленку. В установившемся процессе скорости диффузионных потоков равны и соответствуют общей скорости массопередачи. 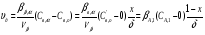 Решая это уравнение можно найти расположение зоны реакции в пограничной пленке. 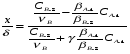 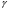 - коэффициент растворимости. - коэффициент растворимости. Если в зависимости от соотношения величин в этом уравнении отношение 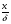 может иметь различные значения: может иметь различные значения: 1. Если 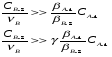 , то , то 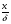 ---1; это значит, что зона реакции находится на внутренней границе поверхности пограничной пленки. ---1; это значит, что зона реакции находится на внутренней границе поверхности пограничной пленки. 2. Если примерно равны, тогда 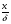 ---0, то реакция находится на границе раздела фаз. ---0, то реакция находится на границе раздела фаз. 3. Если намного меньше, тогда 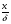 <0, то зона реакции переходит в другую фазу. <0, то зона реакции переходит в другую фазу. Общее уравнение скорости диффузии процесса, протекающего в диффузионной области можно записать: 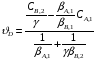 Числитель характеризует движущую силу процесса, а знаменатель диффузионное сопротивление, сосредоточенное в пограничной пленке. Кинетическая область. 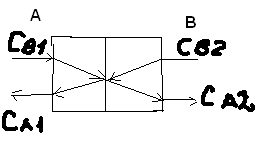 В случае кинетической области химическая реакция является наиболее медленной и протекает в объеме фазы 1 и 2. Таким образом, общая скорость процесса равна сумме скоростей реакции в каждой фазе в отдельности. Обозначим объем первой фазы V1, а второй V2, общий V=V1+V2. Доля первой фазы: 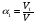 Доля второй фазы: 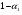 Тогда 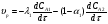 Если кинетическое уравнение для фаз 1 и 2 одинаковы, частные порядки реакции равны 1, и константы различны, то согласно основному закону кинетики скорость процесса равна: 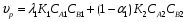 Если учесть, что 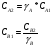 ,то ,то 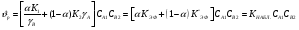 Кнабл. – наблюдаемая константа скорости. Для г-ж реакции типа Аж+Вг = продукты. Профиль изменения концентрации исходных реагентов А и В в кинетической области в случае протекания реакции в жидкой фазе Фаза 1 Фаза 2 Са1 Рв2 Св1 А В 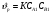 - скорость процесса - скорость процесса Т.к 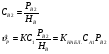 Нв – константа Генри Переходная область. Если скорость химической реакции в массопередачи сравнимы между собой, то в химической гетерофазной системе наблюдается переходная область. Скорость диффузии реагента В из второй фазы в первую равна: 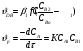 В стационарном режиме все скорости равны: 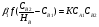 Порядок реакции по В=1, А=0 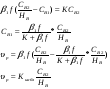 13. Кинетика топохимических процессов, основные модели топохимических процессов и особенности их протекания, механизм и скорость процессов взаимодействия газа (жидкости) с частицами сферической формы и постоянных размеров, механизм и скорость взаимодействия газа (жидкости) с частицами сферической формы и переменных размеров, методы определения лимитирующих стадий топохимических процессов. Химические реакции с участием газа (жидкости) и твердой фазы, сопровождающиеся возникновением или исчезновением твердой фазы, называются топохимическими. Можно указать много таких процессов, имеющих промышленное значение, например: 1) А (ТВ)+ В (Г) = С(ТВ) + Д Г(Ж). Окисление пирита кислородом воздуха в производстве серной кислоты: 4FeS2(ТВ)+ 11O2 (Г) = 2Fe2O3 (ТВ) + 8SO2 (Г). 2) А (ТВ)+ В(Ж) = С(Г) + Е (ТВ). Синтез ацетилена из карбида кальция: CaC2(ТВ) + 2H2O(Ж) = C2H2(Г) + Ca(OH)2(ТВ). 3) А (ТВ)+ В(Ж) = С(ТВ) + Д (Ж) + Е (Г). Разложение карбоната кальция под действием кислот: CaCО3(ТВ) + H2SO4 (Ж) = CaSO4(ТВ) +H2O(Ж) + CO2(Г). 4) А (ТВ)+ В(Г) = Д (Г). Горение угля: С(ТВ) + O2(Г) = СO2(Г). 5) А (ТВ)+ В(Г) = С(ТВ). Окисление металлов: 2Fe(ТВ) + 3/2O2(Г) = Fe2O3(ТВ). |
