Единица 1 Роль белков в питании. Азотистый баланс Переваривание белков в желудке и кишечнике, всасывание аминокислот Трансаминирование и дезаминирование аминокислот Модульная единица 2
 Скачать 2.45 Mb. Скачать 2.45 Mb.
|
|
ТЕМА 9.3. ТРАНСАМИНИРОВАНИЕ И ДЕЗАМИНИРОВАНИЕ АМИНОКИСЛОТ 1. Промежуточный обмен аминокислот чаще всего начинается с отщепления α-аминогруппы от аминокислоты. Это происходит с помощью двух типов реакций: • трансаминирования; • дезаминирования. Трансаминирование - реакция переноса аминогруппы с аминокислоты (донора) на α-кетокислоту (акцептор), в результате чего образуются новая кетокислота и новая аминокислота. Реакция обратима.  Реакция трансаминирования происходит с участием ферментов аминотрансфераз (трансаминаз), которые локализованы в цитозоле и митохондриях клеток практически всех органов. Коферментом этих ферментов является производное витамина В6 - пиридоксальфосфат. Трансаминированию подвергаются все аминокислоты, кроме лизина, треонина и пролина. Реакция трансаминирования происходит с участием ферментов аминотрансфераз (трансаминаз), которые локализованы в цитозоле и митохондриях клеток практически всех органов. Коферментом этих ферментов является производное витамина В6 - пиридоксальфосфат. Трансаминированию подвергаются все аминокислоты, кроме лизина, треонина и пролина.Аминотрансферазы обладают субстратной специфичностью к разным аминокислотам. В тканях человека обнаружено более 10 различных аминотрансфераз. Наиболее распространенными являются: • аспартатаминотрансфераза (АСТ), по обратной реакции - глутаматоксалоацетаттрансаминаза; • аланинаминотрансфераза (АЛТ), по обратной реакции - глутаматпируваттрансаминаза. Название каждой аминотрансферазы включает названия субстратов: • донора аминогруппы (аминокислоты); • акцептора аминогруппы (α-кетокислоты). Например, фермент, катализирующий реакцию Основными донорами аминогрупп в реакциях трансаминирования являются глутамат, аспартат и аланин. Реакции трансаминирования играют большую роль в обмене аминокислот.
• Путем трансаминирования из соответствующих α-кетокислот синтезируются заменимые аминокислоты, если их в данный момент в ткани недостаточно. Таким образом происходит перераспределение аминного азота в тканях и органах. • 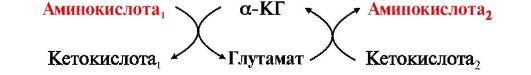 Трансаминирование - один из начальных этапов катаболизма аминокислот. Образующиеся α-кетокислоты могут затем окисляться в цикле трикарбоновых кислот, а некоторые - использоваться для синтеза глюкозы или кетоновых тел. Трансаминирование - один из начальных этапов катаболизма аминокислот. Образующиеся α-кетокислоты могут затем окисляться в цикле трикарбоновых кислот, а некоторые - использоваться для синтеза глюкозы или кетоновых тел.Трансаминирование происходит во многих тканях, но наиболее активно - в печени. 2. В клинике широко используется определение активности некоторых аминотрансфераз в сыворотке крови, особенно часто - АСТ и АЛТ. Эти ферменты являются органоспецифическими, наиболее активны в клетках печени и сердца. В норме их активность в крови мала - 5-40 ЕД/л. Существуют изоферменты АСТ: цитозольная форма (ц-АСТ) и митохондриальная (м-АСТ). В печени, миокарде и большинстве других органов м-АСТ представляет 80% массы фермента, но в сыворотке - лишь менее 12% как у здоровых людей, так и у больных. Повышение активности м-АСТ в сыворотке крови имеет место при острых поражениях печени, инфаркте миокарда, сопровождающихся некрозом тканей и разрушением клеточных мембран, при этом повышение активности м-АСТ отражает тяжесть болезни, поражение органа и прогноз. Определение активности АЛТ и АСТ применяется для диагностики заболеваний миокарда и печени, в том числе при отравлении хлорорганическими соединениями, используемыми на химических производствах (CCl4, хлороформ и др.). В этом случае активность ферментов в сыворотке крови увеличивается до 400 ед. и больше. • Особенно важное значение для диагностики имеет увеличение активности АЛТ при безжелтушных формах вирусного гепатита. • Для определения степени поражения печени и сердца определяют соотношение активностей АСТ-АЛТ в сыворотке крови - коэффициент де Ритиса, который в норме составляет 1,33+0,42.
• При гепатитах активность АЛТ увеличивается в 6-8 раз по сравнению с нормой, а АСТ - в 2-4 раза (рис. 9.4). Коэффициент де Ритиса уменьшается до -0,6. Однако при циррозе печени коэффициент де Ритиса приближается к 1,0 вследствие развивающегося некроза тканей и выхода в кровь митохондриальной фракции АСТ. • При инфаркте миокарда активность АСТ увеличивается в 8-10 раз, а активность АЛТ - в 1,5-2 раза (рис. 9.5). Коэффициент де Ритиса значительно увеличивается. При стенокардии, пороках сердца, инфаркте легкого активность аминотрансфераз в крови не увеличивается, что дает возможность дифференциальной диагностики заболеваний сердца. 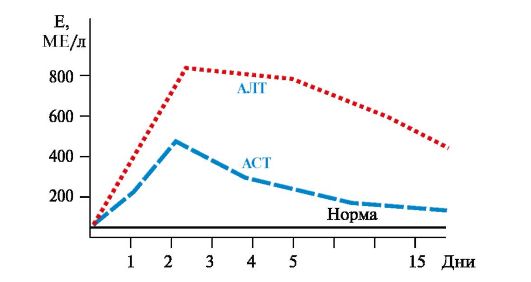 Рис. 9.4. Активность аминотрансфераз сыворотки крови при остром гепатите Рис. 9.4. Активность аминотрансфераз сыворотки крови при остром гепатите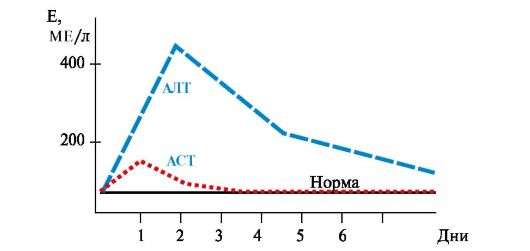 Рис. 9.5. Активность аминотрансфераз сыворотки крови при инфаркте миокарда Рис. 9.5. Активность аминотрансфераз сыворотки крови при инфаркте миокардаОсобую важность имеет возможность дифференциальной диагностики тяжести заболеваний печени и сердца, а также анализ динамики течения заболевания. 3. Катаболизм аминокислот начинается с реакции дезаминирования - удаления α-аминогруппы, которая выделяется в виде аммиака и образования безазотистого остатка (α-кетокислоты). При дезаминировании в отличие от трансаминирования общее количество аминокислот уменьшается. Продукт дезаминирования аммиак - токсичное соединение, в клетках подвергается обезвреживанию. Безазотистый остаток представляет собой α-кетокислоту, которая включается: • в реакции окисления до СО2 и Н2О; • в реакции трансаминирования для синтеза заменимых аминокислот; • в анаплеротические реакции для восполнения убыли метаболитов ОПК или для синтеза других соединений; • в глюконеогенез; • в кетогенез. Дезаминированию подвергаются все аминокислоты кроме лизина и пролина (табл. 9.3). Существует несколько типов реакций дезаминирования:
• окислительное - характерно только для Глу; • неокислительное - характерно для Сер, Тре и Гис; • непрямое - для остальных аминокислот. Прямому окислительному дезаминированию подвергается только глутамат. Окислительное дезаминирование глутамата происходит под действием фермента глутаматдегидрогеназы, коферментом которого является NAD+. Реакция идет в митохондриях многих тканей, наиболее активно - в печени. В реакцию неокислительного дезаминирования вступают: • серин и треонин - с отщеплением воды; • гистидин - внутримолекулярным способом. Большинство аминокислот подвергается в клетке непрямому дезаминированию, которое включает две стадии: А. Трансаминирование с α-кетоглутаратом и образование Глу в цитозоле клетки; Б. Окислительное дезаминирование Глу в митохондриях. Центральную роль в непрямом дезаминировании играют глутамат и α-кетоглутарат. Другой тип дезаминирования аминокислот - непрямое неокислительное - происходит с участием цикла ИМФ-АМФ и характерен для мышечной ткани и мозга, в которых глутаматдегидрогеназа малоактивна: 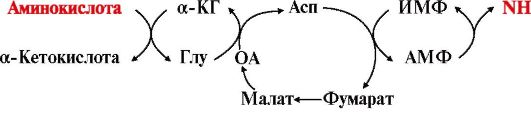 Аминогруппа аминокислот с помощью двух последовательных реакций трансаминирования переносится на ИМФ с образованием АМФ, который гидролитически дезаминируется с выделением аммиака. Аминогруппа аминокислот с помощью двух последовательных реакций трансаминирования переносится на ИМФ с образованием АМФ, который гидролитически дезаминируется с выделением аммиака.Таблица 9.3. Реакции дезаминирования аминокислот 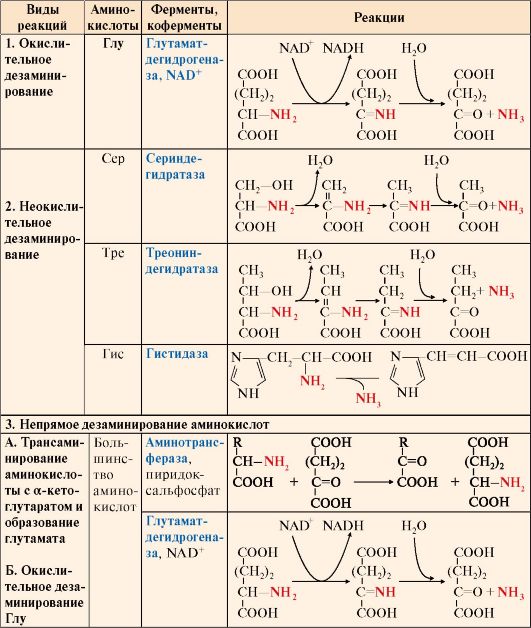 Катаболизм аминокислот и, соответственно, реакции дезаминирования ускоряются при: Катаболизм аминокислот и, соответственно, реакции дезаминирования ускоряются при:• голодании в результате ускорения распада белков тканей; • поступлении с пищей больших количеств белка; • сахарном диабете и других длительно протекающих тяжелых заболеваниях, также сопровождающихся распадом тканевых белков. ТЕМА 9.4. ОБМЕН АММИАКА: ИСТОЧНИКИ, ПРЕВРАЩЕНИЕ В ТКАНЯХ 1. Основным источником аммиака является катаболизм аминокислот в тканях. Небольшая часть аммиака образуется в клетках при распаде азотсодержащих соединений (биогенных аминов, нуклеотидов и др.) (рис. 9.7), а также при гниении белков в кишечнике в результате деятельности микрофлоры, откуда он частично всасывается и поступает в воротную вену. Концентрация аммиака в крови воротной вены существенно выше, чем в общем кровотоке.
Катаболизм аминокислот и образование аммиака происходит во всех тканях организма. Однако концентрация аммиака в крови очень мала, так как он быстро связывается в клетках с образованием нетоксичных продуктов. Содержание аммиака в крови в норме составляет всего 0,4-0,7 мг/л (25-40 мкмоль/л). Из организма аммиак выводится почками в виде конечных продуктов азотистого обмена: • мочевины - синтезируется в печени; • аммонийных солей - образуются в почках. 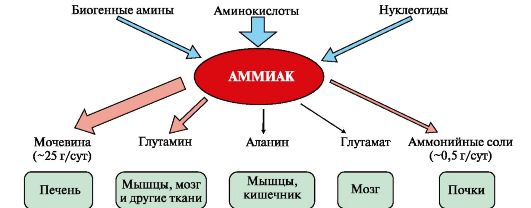 Рис. 9.7. Источники аммиака и пути его превращения в разных тканях Рис. 9.7. Источники аммиака и пути его превращения в разных тканях2. В разных тканях существует несколько способов связывания и выведения аммиака (рис. 9.8). Основной реакцией обезвреживания аммиака почти во всех тканях является синтез глутамина под действием глутаминсинтетазы: Глутамин можно считать транспортной формой аммиака, он является нейтральной аминокислотой и способен легко проникать через клеточные мембраны путем облегченной диффузии (в отличие от глутамата, требующего механизмов активного транспорта). Глутамин поступает в кровь из многих органов, в наибольшем количестве - из мышц и мозга (см. рис. 9.8). 3. Из тканей глутамин транспортируется в почки и кишечник. В клетках кишечника под действием фермента глутаминазы происходит отщепление амидной группы в виде NH3 а образовавшийся глутамат с помощью АЛТ превращается в аланин. 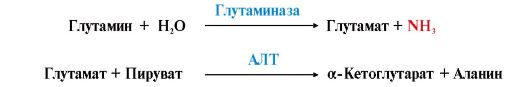 Таким образом, в энтероцитах амидная группа глутамина превращается в аммиак, а аминогруппа глутамина - включается в состав аланина. Таким образом, в энтероцитах амидная группа глутамина превращается в аммиак, а аминогруппа глутамина - включается в состав аланина.4. В почках глутамин также подвергается действию фермента глутаминазы и расщепляется на глутамат, который реабсорбируется и возвращается в клетки тканей, и аммиак (см. рис. 9.8, В).
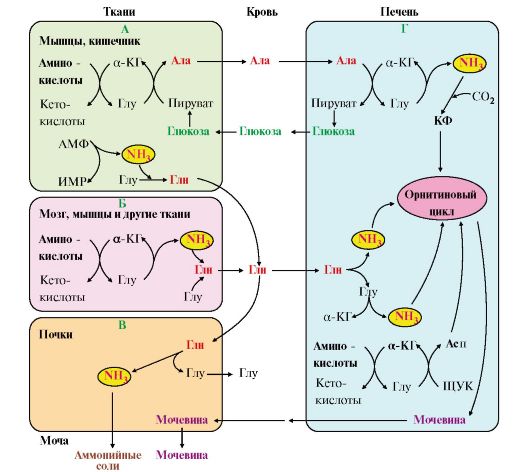 Рис. 9.8. Пути обмена азота аминокислот и аммиака: Рис. 9.8. Пути обмена азота аминокислот и аммиака:А - выведение азота из мышц и кишечника в составе аланина и глутамина; Б - выведение азота из мозга и мышц в виде глутамина; В - экскреция аммиака из почек в виде аммонийных солей; Г - включение азота аминокислот в мочевину в печени Глутаминаза почек активируется при ацидозе; образовавшийся аммиак используется для нейтрализации кислых продуктов и образования аммонийных солей [в основном, NH4Cl, (NH4)2SO4], которые экскретируются с мочой (рис. 9.9). Экскреция солей аммония в норме составляет -0,5 г/сут, при ацидозе выведение аммонийных солей может увеличиться до 10 г/сут. Этот путь выведения аммиака: • поддерживает кислотно-щелочной баланс в норме; • защищает организм от потери с мочой ионов Na+ и К+, которые также могут использоваться для выведения избытка анионов. 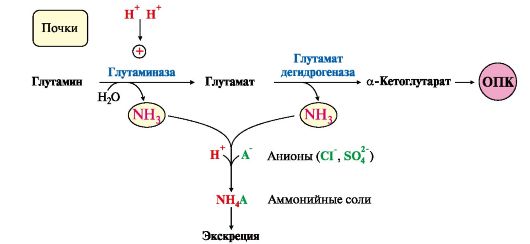 Рис. 9.9. Использование глутамина в почках для поддержания кислотно-щелочного баланса Рис. 9.9. Использование глутамина в почках для поддержания кислотно-щелочного баланса5. В мозге и некоторых других органах для обезвреживания аммиака используется реакция восстановительного аминирования α-кетоглутаратапод действием глутаматдегидрогеназы, которая катализирует реакцию, обратную окислительному дезаминированию глутамата. Однако этот путь в тканях используется слабо. Хотя, если учитывать возможность последующего образования глутамина, он является выгодным для клеток, так как способствует обезвреживанию сразу двух молекул NH3: 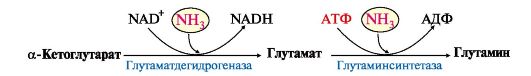 6. Из мышц, клеток кишечника и некоторых других тканей избыток азота выводится в кровь в виде аланина (см. рис. 9.8, А, Г). Образование аланина в этих органах можно представить следующей схемой: 6. Из мышц, клеток кишечника и некоторых других тканей избыток азота выводится в кровь в виде аланина (см. рис. 9.8, А, Г). Образование аланина в этих органах можно представить следующей схемой: Аминогруппы разных аминокислот в ходе реакций трансаминирования переносятся на пируват, источником которого служат глюкоза и безазотистые остатки аминокислот. Особенно много аланина выделяют мышцы в силу их большой массы, а также потому, что работающие мышцы часть энергии получают за счет распада аминокислот.Аланин поступает в печень, Аминогруппы разных аминокислот в ходе реакций трансаминирования переносятся на пируват, источником которого служат глюкоза и безазотистые остатки аминокислот. Особенно много аланина выделяют мышцы в силу их большой массы, а также потому, что работающие мышцы часть энергии получают за счет распада аминокислот.Аланин поступает в печень,
где подвергается непрямому дезаминированию. Выделившийся аммиак обезвреживается в процессе синтеза мочевины, а пируват включается в глюконеогенез или ОПК. Глюкоза из печени поступает в ткани и в процессе гликолиза окисляется до пирувата. Образование аланина в мышцах, его перенос в печень и перенос глюкозы в обратном направлении составляют глюкозоаланиновый цикл (см. рис. 9.8, А, Г). 7. В печени аммиак обезвреживается путем связывания с СО2 и образования карбамоилфосфата (см. рис. 9.8, Г). Реакцию катализируеткарбамоилфосфатсинтетаза I, которая использует 2 моль АТФ. Фермент локализован в митохондриях гепатоцитов. Продукт реакции -карбамоилфосфат - включается затем в орнитиновый цикл Кребса-Гензелейта для синтеза мочевины. ТЕМА 9.5. ОРНИТИНОВЫЙ ЦИКЛ И ЕГО БИОЛОГИЧЕСКАЯ РОЛЬ 1. Мочевина - конечный продукт азотистого обмена, в составе которого из организма выводится избыток аммиака. Экскреция мочевины в норме составляет -25 г/сут. Синтез мочевины происходит только в печени (рис. 9.10). Содержание мочевины в сыворотке крови в норме составляет 2,5-8,4 мМ/л (15-50 мг/дл). Катаболизм аминокислот и образование аммиака происходит во многих тканях. Азот из тканей транспортируется в печень в составе трех соединений: глутамина, аланина и аммиака. Полный набор ферментов цикла синтеза мочевины есть только в гепатоцитах. Первые две реакции протекают в митохондриях, а последующие три - в цитозоле. Молекула мочевины (карбамида, двойного амида угольной кислоты) содержит два атома азота: • первая аминогруппа (ем. рис. 9.10) включается в цикл в виде аммиака, образующегося в митохондриях гепатоцитов при дезаминировании аминокислот или поступающего из крови. Реакцию катализирует митохондриальная карбамоилфосфатсинтетаза I (цитоплазматическая карбамоилфосфатсинтетаза II участвует в синтезе пиримидиновых нуклеотидов);
• вторая аминогруппа (см. рис. 9.10) вводится в молекулу мочевины из аспартата. 2. Аммиак, используемый карбамоилфосфатсинтетазой I, поставляется в печень, главным образом, из кишечника с кровью воротной вены.Роль других источников, в том числе окислительного дезаминирования глутамата и гидролиза глутамина в печени, существенно меньше. 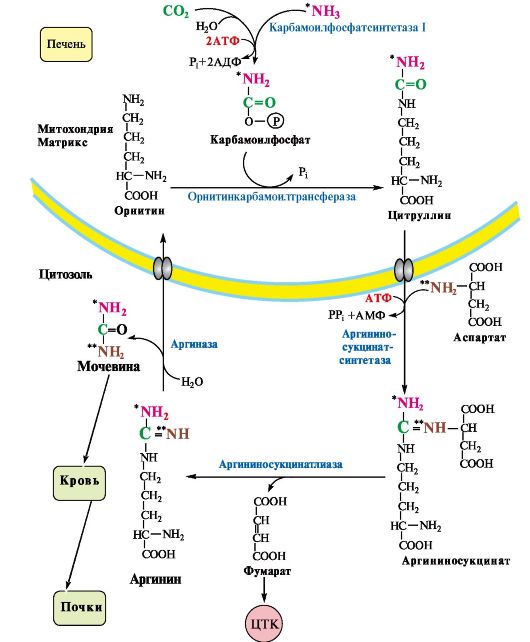 Рис. 9.10. Орнитиновый цикл Кребса-Гензелейта. Рис. 9.10. Орнитиновый цикл Кребса-Гензелейта.Ферменты орнитинового цикла локализованы в митохондриях и цитозоле гепатоцитов. В цикле происходит трансмембранный перенос цитруллина и орнитина. На схеме показаны пути включения двух атомов азота из разных аминокислот в молекулу мочевины: - азот одной аминогруппы - в виде аммиака в матриксе митохондрии (*N); - азот второй аминогруппы поставляется в составе аспартата в цитозоле (**N) Аспартат, необходимый для синтеза аргининосукцината, образуется в печени: • преимущественно с использованием аминогруппы аланина, который поступает из мышц и клеток кишечника (рис. 9.11); • путем трансаминирования глутамата с оксалоацетатом. Образующийся в орнитиновом цикле фумарат включается в реакции цитратного цикла и превращается в оксалоацетат, который путем трансаминирования снова образует аспартат (см. рис. 9.11). Таким образом, с орнитиновым циклом сопряжен цикл регенерации аспартата из фумарата. Пируват, образующийся в этом цикле, используется в ОПК или для глюконеогенеза. 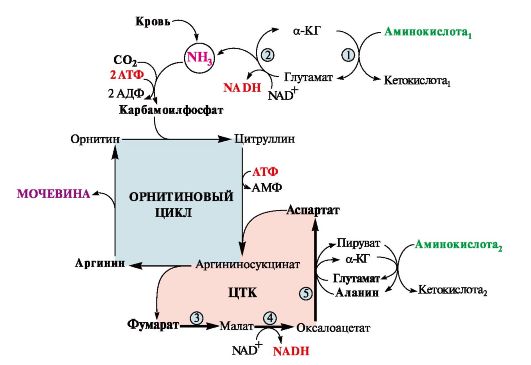 Рис. 9.11. Цикл регенерации аспартата. Рис. 9.11. Цикл регенерации аспартата.Ферменты, катализирующие реакции: 1 - аминотрансфераза; 2 - глутаматдегидрогеназа; 3 - фумараза; 4 - малатдегидрогеназа; 5 - аминотрансфераза 3. В орнитиновом цикле расходуется энергия четырех макроэргических связей трех молекул АТФ на синтез одной молекулы мочевины. Затраты энергии происходят также при трансмембранном переносе компонентов цикла (цитруллина, орнитина, мочевины) (см. рис. 9.10). В почках перенос мочевины из крови в мочу происходит за счет градиента ионов натрия, создаваемого К, Na-АТФазой, которая потребляет АТФ.
Процесс синтеза мочевины имеет возможность компенсации энергозатрат (см. рис. 9.11): • при регенерации аспартата из фумарата на стадии дегидрирования малата образуется NADH, который может обеспечить синтез трех молекул АТФ; • при окислительном дезаминировании глутамата в разных органах также образуется NADH, соответственно - еще три молекулы АТФ. 4. Орнитиновый цикл в печени выполняет две функции: • превращение азота аминокислот в мочевину, которая экскретируется и помогает избежать накопления аммиака в организме; • синтез аргинина и пополнение его фонда в организме. Эффективность работы орнитинового цикла при нормальном питании человека и умеренных физических нагрузках составляет примерно 60% его мощности. Такой запас мощности необходим для предотвращения гипераммониемии при изменениях количества белка в пище. 5. Регуляторными реакциями являются синтез карбамоилфосфата, цитруллина и заключительная реакция, катализируемая аргиназой. Основным регуляторным фактором является содержание субстратов, прежде всего аммиака. Высокий уровень NH3 вызывает повышение уровня образования мочевины. Кроме того, скорость орнитинового цикла регулируется с помощью двух механизмов: • аллостерическая активация карбамоилфосфатсинтетазы I N-ацетил- глутаматом (N-АГ); • индукция синтеза ферментов карбамоилфосфатсинтетазы I, орнитинкарбамоилтрансферазы и аргиназы кортизолом. N-ацетилглутамат является активатором карбамоилфосфатсинтетазы I. Образуется в матриксе митохондрий гепатоцитов из глутамата и ацетил-КоА специфической синтазой (рис. 9.12), которая активируется при повышении содержания аргинина в печени. 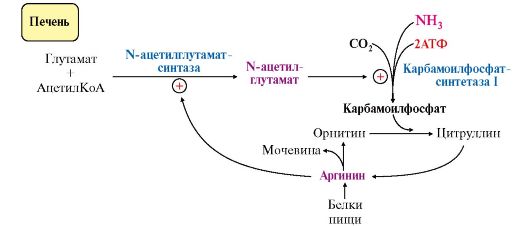 Рис. 9.12. Регуляция карбамоилфосфатсинтетазы I Рис. 9.12. Регуляция карбамоилфосфатсинтетазы IИндукция синтеза ферментов орнитинового цикла происходит в ответ на повышение скорости распада белков при голодании, длительной физической работе и при высокобелковой диете. В этих случаях углерод аминокислот превращается в глюкозу, а азот включается в молекулу мочевины. Индукция синтеза ферментов орнитинового цикла происходит параллельно с индукцией ферментов глюконеогенеза, АЛТ и глутаматдегидрогеназы. Заболевания, характеризующиеся интенсивным распадом белков тканей (сахарный диабет и др.), также сопровождаются активацией орнитинового цикла. |
