Единица 1 Роль белков в питании. Азотистый баланс Переваривание белков в желудке и кишечнике, всасывание аминокислот Трансаминирование и дезаминирование аминокислот Модульная единица 2
 Скачать 2.45 Mb. Скачать 2.45 Mb.
|
|
ТЕМА 9.6. ГИПЕРАММОНИЕМИЯ И ЕЕ ПРИЧИНЫ 1. Аммиак превращается в мочевину только в печени, поэтому при заболеваниях печени (гепатиты, цирроз и др.) или наследственных дефектах ферментов обезвреживания аммиака наблюдается повышение содержания аммиака в крови (гипераммониемия), которое оказывает токсическое действие на организм. Гипераммониемия сопровождается следующими симптомами: • тошнота, рвота; • головокружение, судороги; • потеря сознания, отек мозга (в тяжелых случаях). Все перечисленные симптомы обусловлены действием аммиака на центральную нервную систему и прежде всего на головной мозг. 2. Механизмы токсического действия аммиака связаны с тем, что: • аммиак вызывает снижение концентрации α-кетоглутарата, так как сдвигает реакцию, катализируемую глутаматдегидрогеназой, в сторону образования глутамата: • • основного тормозного медиатора: 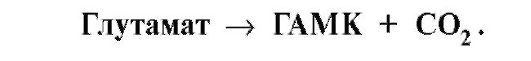 Это нарушает проведение нервного импульса, вызывает судороги. Накопление глутамина в нервных клетках повышает осмотическое давление и, в больших концентрациях, может вызвать отек мозга; Это нарушает проведение нервного импульса, вызывает судороги. Накопление глутамина в нервных клетках повышает осмотическое давление и, в больших концентрациях, может вызвать отек мозга;В крови и цитозоле аммиак превращается в ион NH4+: 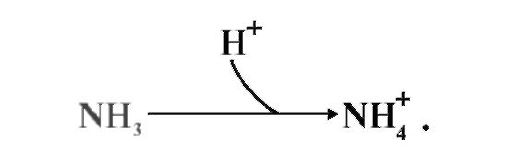 Накопление NH4+ нарушает трансмембранный перенос одновалентных катионов Na+ и К+, что также влияет на проведение нервных импульсов. Накопление NH4+ нарушает трансмембранный перенос одновалентных катионов Na+ и К+, что также влияет на проведение нервных импульсов.3. Известно пять наследственных заболеваний, обусловленных дефектом пяти ферментов орнитинового цикла (табл. 9.5). Нарушение орнитинового цикла наблюдается при гепатите и некоторых других вирусных заболеваниях; так, например, вирус гриппа подавляет синтез карбамоилфосфатсинтетазы I.
Все нарушения орнитинового цикла приводят к значительному повышению в крови концентрации: • аммиака; • глутамина; • аланина. Диагностика различных типов гипераммониемии производится путем определения: • содержания аммиака в крови; • метаболитов орнитинового цикла в крови и моче; • активности фермента в биоптатах печени. Основным диагностическим признаком служит повышение концентрации аммиака в крови. Однако в большинстве хронических случаев уровень аммиака может повышаться только после белковой нагрузки или в течение острых осложненных заболеваний. Для снижения концентрации NH3 в крови и облегчения состояния больных рекомендуется: • малобелковая диета; • введение метаболитов орнитинового цикла (аргинина, цитруллина, глутамата), которые стимулируют выведение аммиака в обход нарушенных реакций (рис. 9.13), например, в составе фенилацетилглутамина и гиппуровой кислоты. Тема 9.8. БИОСИНТЕЗ ЗАМЕНИМЫХ АМИНОКИСЛОТ 1.Углеродный скелет восьми заменимых аминокислот (Ала, Асп, Асн, Сер, Гли, Про, Глу, Глн)и цистеинаможет синтезироваться из глюкозы (рис. 9.15). α-Аминогруппа вводится в соответствующие α-кетокислоты с помощью реакции трансаминирования. Универсальным донором α-аминогруппы является глутамат. Непосредственно путем трансаминирования метаболитов ОПК с глутаматом синтезируются: 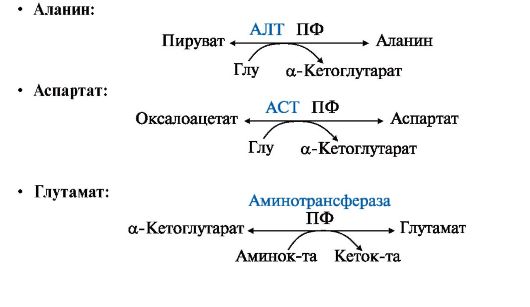 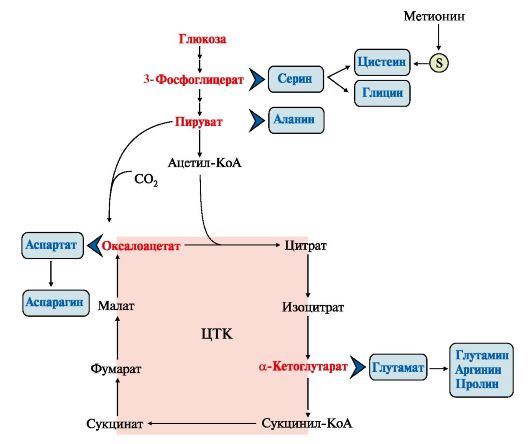 Рис. 9.15. Пути биосинтеза заменимых аминокислот Рис. 9.15. Пути биосинтеза заменимых аминокислот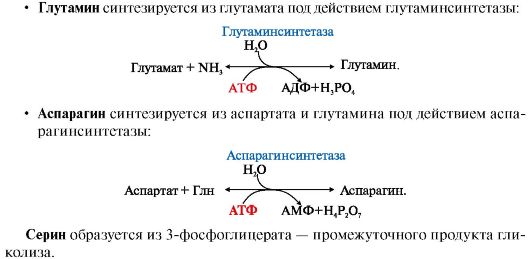  2. Частично заменимые аминокислоты Арг и Гиссинтезируются в небольших количествах, которые не отвечают потребностям организма, что особенно ощутимо в детском возрасте. Синтез аргининапроисходит в реакциях орнитинового цикла. Гистидинсинтезируется из АТФ и рибозы. 2. Частично заменимые аминокислоты Арг и Гиссинтезируются в небольших количествах, которые не отвечают потребностям организма, что особенно ощутимо в детском возрасте. Синтез аргининапроисходит в реакциях орнитинового цикла. Гистидинсинтезируется из АТФ и рибозы.Условно заменимые аминокислоты Тир и Цисобразуются с использованием незаменимых аминокислот: • фенилаланин превращается в тирозинпод действием фенилаланингидроксилазы; • для образования цистеинанеобходима сера, донором которой является метионин. В синтезе используются углеродный скелет и α-аминогруппа серина. ЕМА 9.9. ОБМЕН СЕРИНА И ГЛИЦИНА. РОЛЬ ФОЛИЕВОЙ КИСЛОТЫ Кроме путей обмена, характерных для большинства аминокислот, входящих в состав белков, почти для всех аминокислот существуют и специфические пути превращения. Рассмотрим обмен некоторых аминокислот, специфические пути превращения которых приводят к синтезу биологически важных продуктов и во многом определяют физиологическое состояние человека. 1. Серин - заменимая аминокислота, синтезируется из промежуточного продукта гликолиза - 3-фосфоглицерата в последовательности реакций дегидрирования, трансаминирования и гидролиза под действием фосфатазы (рис. 9.17). В организме серин используется для синтеза: • фосфолипидов (фосфатидилсерины, сфингомиелины); • аминокислот (глицина, цистеина). Основной путь катаболизма серина - его дезаминирование с образованием пирувата (см. тему 9.3). 2. Глицин образуется из серина под действием сериноксиметилтрансферазы. Коферментом этого фермента является тетрагидрофолиевая кислота (Н4-фолат), которая присоединяет β-углеродный атом серина, образуя метилен - Н4-фолат (рис. 9.18): Глицин является предшественником: • порфиринов (гема), • пуриновых оснований, • коферментов, • глутатиона и др. Катаболизм глицина происходит также с участием Н4-фолата, который связывает а-СН2-группу глицина (см. рис. 9.18). 3. Н4-фолат образуется в печени из фолиевой кислоты (фолата) с участием ферментов фолатредуктазы и дигидрофолатредуктазы (рис. 9.19). Коферментом этих редуктаз является NADPH. Метиленовая группа -СН2- в молекуле метилен-Н4-фолата может превращаться в другие одноуглеродные группы:  Н4-фолат способен передавать эти группы на другие соединения и играет роль промежуточного переносчика одноуглеродных групп. Н4-фолат способен передавать эти группы на другие соединения и играет роль промежуточного переносчика одноуглеродных групп.
Одноуглеродные фрагменты используются для синтеза нуклеотидов и ряда соединений (см. рис. 9.18). 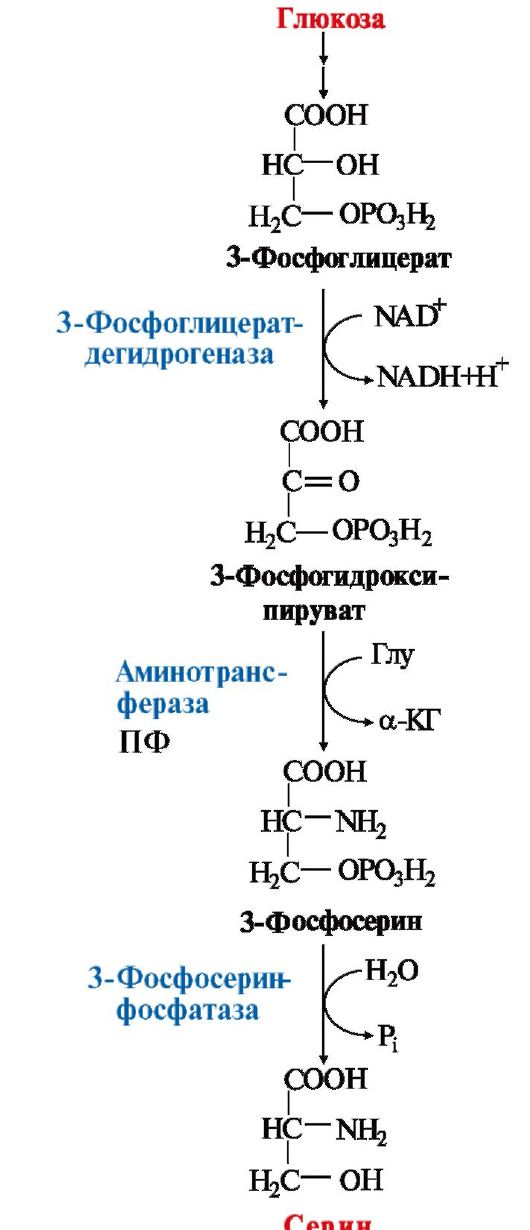 Рис. 9.17. Синтез серина из глюкозы Рис. 9.17. Синтез серина из глюкозы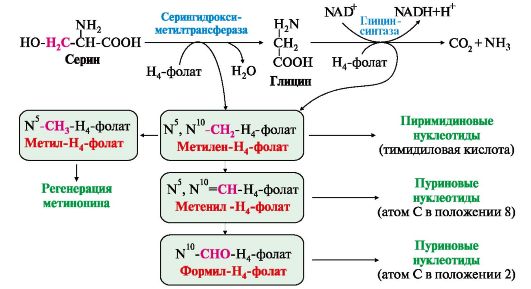 Рис. 9.18. Биологическая роль одноуглеродных групп Рис. 9.18. Биологическая роль одноуглеродных групп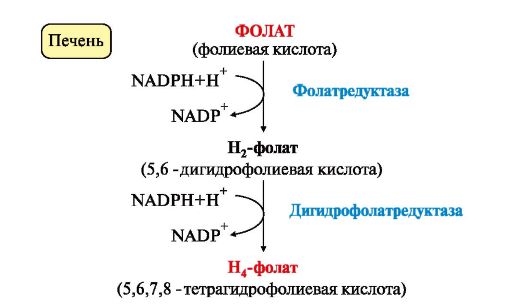 Рис. 9.19. Схема синтеза Н4-фолата в печени Рис. 9.19. Схема синтеза Н4-фолата в печени4. Фолиевая кислота является витамином для человека и большинства млекопитающих (витамин ВСили В9). Она широко распространена в пищевых продуктах и синтезируется бактериями кишечника. Гиповитаминоз у человека возникает достаточно редко. Причинами его могут послужить: • неправильное питание - недостаточное потребление овощей, фруктов и мясных продуктов; • нарушение всасывания фолиевой кислоты в кишечнике; • гепатит, цирроз и другие поражения печени, вызывающие снижение активности фолатредуктазы. Гиповитаминоз фолиевой кислоты приводит к нарушению синтеза нуклеиновых кислот в организме, что сказывается прежде всего на быстро делящихся клетках крови, и развитию мегалобластной анемии. 5. Многие патогенные микроорганизмы способны синтезировать фолиевую кислоту из парааминобензойной кислоты, которая является составной частью фолата. На этом основано бактериостатическое действие сульфаниламидных лекарственных препаратов, которые являются структурными аналогами n-аминобензойной кислоты: 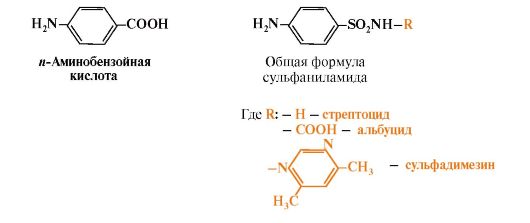 Препараты являются конкурентными ингибиторами ферментов синтеза фолиевой кислоты у бактерий или могут использоваться как псевдосубстраты, в результате чего образуется соединение, не выполняющее функции фолиевой кислоты, Это делает невозможным деление клеток, бактерии перестают размножаться и погибают. Сульфаниламиды называют антивитаминами. Препараты являются конкурентными ингибиторами ферментов синтеза фолиевой кислоты у бактерий или могут использоваться как псевдосубстраты, в результате чего образуется соединение, не выполняющее функции фолиевой кислоты, Это делает невозможным деление клеток, бактерии перестают размножаться и погибают. Сульфаниламиды называют антивитаминами.ТЕМА 9.10. ОБМЕН МЕТИОНИНА. РЕАКЦИИ ТРАНСМЕТИЛИРОВАНИЯ 1. Метионин - незаменимая аминокислота, необходимая для синтеза белков. Мет-тРНКмет участвует в инициации процесса трансляции каждого белка. Как и многие другие аминокислоты, метионин подвергается транс- и дезаминированию. Особая роль метионина заключается в том, что метильная группа этой аминокислоты используется для синтеза целого ряда соединений в реакциях трансметилирования. Основным донором метильной группы является S-аденозилметионин (SAM) - активная форма метионина, который присутствует во всех типах клеток и синтезируется из метионина и АТФ под действием фермента метионин-аденозилтрансферазы:
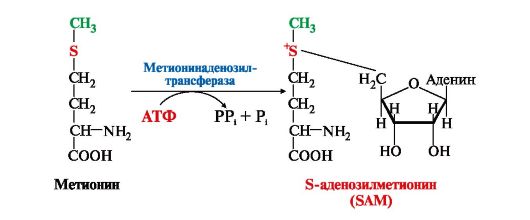 Структура -S+-CH3 в SAM является нестабильной, метильная группа легко отщепляется, что определяет высокую способность ее к переносу на другие соединения в реакциях трансметилирования (рис. 9.20). Структура -S+-CH3 в SAM является нестабильной, метильная группа легко отщепляется, что определяет высокую способность ее к переносу на другие соединения в реакциях трансметилирования (рис. 9.20).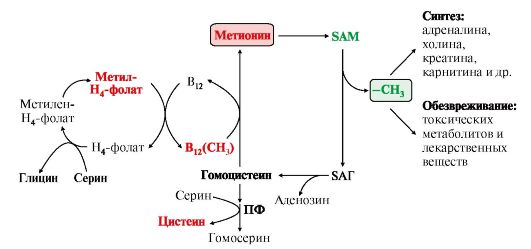 Рис. 9.20. Метаболизм метионина Рис. 9.20. Метаболизм метионинаВ реакциях трансметилирования SAM превращается в S-аденозилгомо- цистеин (SAr), который гидролитически расщепляется с образованием аденозина и гомоцистеина. Последний может снова превращаться в метионин с участием метил-Н4-фолата и витамина В12. Регенерация метионина тесно связана с обменом серина и глицина и взаимопревращениями производных Н4-фолата (см. рис. 9.20). 2. Метионин и серин необходимы для синтеза условно заменимой аминокислоты цистеина, причем в этом процессе метионин является донором атома серы. Цистеин образуется непосредственно из гомоцистеина в ходе двух реакций, которые происходят с участием пиридоксальфосфата (см. рис. 9.20). Генетический дефект этих ферментов приводит к нарушению использования гомоцистеина в организме и превращению его вгомоцистин. Гомоцистин может накапливаться в крови и тканях, выделяться с мочой, вызывая гомоцистинурию. Заболевание сопровождается эктопией (смещением) хрусталика глаза, катарактой, остеопорозом, умственной отсталостью (-50% больных). Причиной заболевания могут служить как наследственные нарушения обмена гомоцистеина, так и гиповитаминоз фолиевой кислоты или витаминов В12 и SАМ как донор метильной группы участвует в синтезе многих веществ (лецитина, адреналина, карнитина, ацетилхолина, креатина и др.), а также в инактивации нормальных метаболитов и обезвреживании токсических веществ в печени. 3. Синтез фосфатидилхолина (лецитина) наиболее активно протекает в печени, которая использует лецитин на построение мембран и формирование липопротеинов. Реакцию катализирует фосфатидилэтаноламинтрансметилаза.
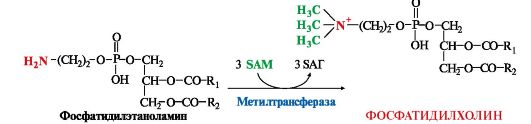 В клетки других тканей фосфатидилхолин доставляется в составе ЛПНП. Особую роль лецитин играет в метаболизме ЛПВП (см. модуль 8). В клетки других тканей фосфатидилхолин доставляется в составе ЛПНП. Особую роль лецитин играет в метаболизме ЛПВП (см. модуль 8).4. Синтез карнитина - переносчика ацильной группы в митохондрии - происходит путем метилирования γ-аминомасляной кислоты с участием SAM: 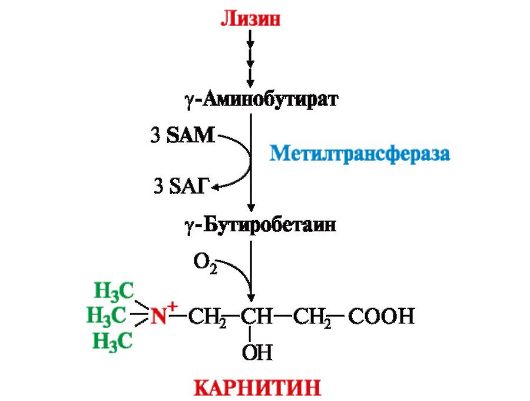 5. Синтез креатина происходит с использованием трех аминокислот:аргинина, глицина и метионина. Процесс начинается в почках, в реакцию вступают аргинин и глицин. Образующийся гуанидинацетат поступает затем в печень, где подвергается метилированию с участием SAM и превращается в креатин. Из печени креатин транспортируется в мышцы и головной мозг. 5. Синтез креатина происходит с использованием трех аминокислот:аргинина, глицина и метионина. Процесс начинается в почках, в реакцию вступают аргинин и глицин. Образующийся гуанидинацетат поступает затем в печень, где подвергается метилированию с участием SAM и превращается в креатин. Из печени креатин транспортируется в мышцы и головной мозг.Креатин в клетках превращается в креатинфосфат - макроэргическое соединение, являющееся резервной формой энергии в мышечной и нервной тканях. Содержание креатинфосфата в покоящейся мышце в восемь раз выше, чем АТФ. Эту реакцию катализирует ферменткреатинкиназа (рис. 9.21). 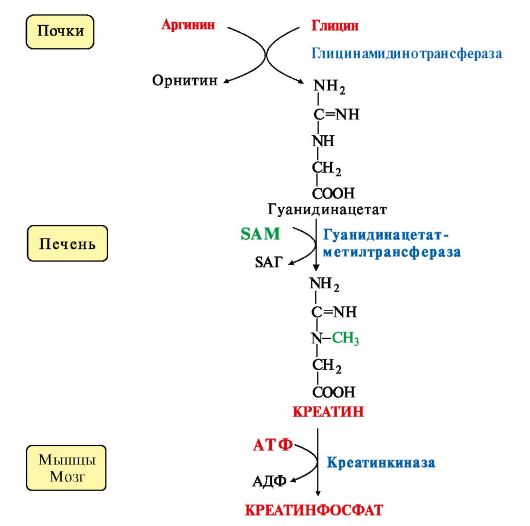 Рис. 9.21. Схема синтеза и использования креатина Рис. 9.21. Схема синтеза и использования креатинаКреатинфосфат играет важную роль в обеспечении работающей мышцы энергией в начальный период физической работы. В работающей мышце концентрация АТФ некоторое время остается постоянной, а концентрация креатинфосфата быстро снижается. Часть образовавшегося креатина и креатинфосфата с постоянной скоростью превращается в креатинин, который выводится с мочой (норма - 1-2 г/сут, или 8,8-17,6 ммоль/л) При уменьшении массы мышц вследствие длительного отрицательного азотистого баланса, при состояниях, ведущих к атрофии мышц,выделение креатинина снижается (голодание, острые инфекции, сахарный диабет, гипертиреоз и т.д.). Определение содержания в крови креатина и креатинина используется для диагностики заболеваний, а также как показатель эффективности работы мышц в спортивной медицине. ТЕМА 9.11. ОБМЕН ФЕНИЛАЛАНИНА, ТИРОЗИНА И ГИСТИДИНА В РАЗНЫХ ТКАНЯХ
1. Фенилаланин - незаменимая аминокислота, так как в клетках животных не синтезируется ароматическое кольцо. Основная часть поступающего с пищей фенилаланина используется в синтезе тканевых белков, превращение остальной части начинается с его гидроксилирования, в результате чего образуется тирозин. Реакция эта катализируется специфической монооксигеназой - фенилаланингидроксилазой, коферментом которой является тетрагидробиоптерин (Н4-БП) (рис. 9.22). 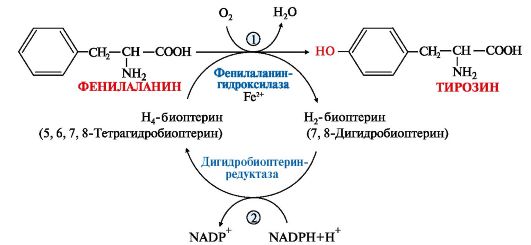 Рис. 9.22. Реакция гидроксилирования фенилаланина и регенерация тетрагидробиоптерина (Н4БП): Рис. 9.22. Реакция гидроксилирования фенилаланина и регенерация тетрагидробиоптерина (Н4БП):1. Реакцию катализирует фенилаланингидроксилаза (1), коферментом которой является Н4БП. Кофактором являются ионы Fe2+. Н4БП в результате реакции окисляется в дигидробиоптерин (Н2БП). 2. Регенерация дигидробиоптерина (2) происходит при участии дигидробиоптеринредуктазы с использованием NADPH. 2. Тирозин - условно заменимая аминокислота. Синтезируется только из фенилаланина. Катаболизм Фен и Тир происходит в печени. В результате ряда реакций образуется фумарат и ацетоацетат (рис. 9.23, А). Фумарат используется для синтеза глюкозы (глюконеогенез) или окисляется до СО2 и Н2О. Ацетоацетат - кетоновое тело, которое окисляется в тканях с выделением энергии. Таким образом, Фен и Тир относятся к смешанным (гликокетогенным) аминокислотам по использованию безазотистого остатка. Превращение промежуточного продукта катаболизма Тир - гомогентизиновой кислоты - в фумарилацетоацетат сопровождается расщеплением ароматического кольца. 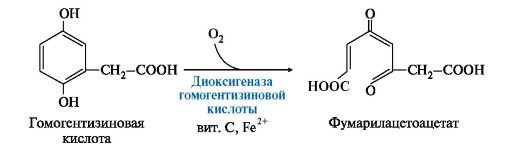 Процессы расщепления ароматических колец в биологических системах катализируются ферментами диоксигеназами. Для катализа диоксигеназам необходимы кофакторы - Fe2+ или гем (для некоторых - Сu+), а также - витамин С. Процессы расщепления ароматических колец в биологических системах катализируются ферментами диоксигеназами. Для катализа диоксигеназам необходимы кофакторы - Fe2+ или гем (для некоторых - Сu+), а также - витамин С.3. В мозговом веществе надпочечников и нервной ткани из тирозина синтезируются катехоламины (дофамин, норадреналин, адреналин) (рис. 9.23, В).
Тирозин под действием специфической монооксигеназы - тирозингидроксилазы превращается в ДОФА. Для протекания реакции необходимы Н4БП, О2 и Fe2+ (реакция аналогична гидроксилированию фенилаланина, см. рис. 9.22). Тирозингидроксилаза найдена только в надпочечниках и катехоламинэргических нейронах (преимущественно в их нервных окончаниях). Этот фермент является регуляторным и определяет скорость синтеза катехоламинов. Одна из функций последних - регуляция деятельности сердечнососудистой системы. Активность тирозингидроксилазы значительно изменяется в результате: • аллостерической регуляции по принципу ретроингибирования норадреналином; • фосфорилирования с участием цАМР - зависимой протеинкиназы, при этом снижается Км для кофермента Н4БП и сродство фермента к норадреналину, в результате чего происходит активация тирозингидроксилазы; • индукции синтеза фермента кортизолом. Катехоламины выполняют очень важные функции в организме. Дофамин является медиатором среднего отдела мозга. Норадреналин - тормозный медиатор синаптической нервной системы и разных отделов головного мозга, но может выполнять функцию возбуждающего медиатора в гипоталамусе. Адреналин - гормон интенсивной физической работы, который синтезируется при стрессе и регулирует основной обмен, а также усиливает сокращение сердечной мышцы. В щитовидной железе тирозин используется для синтеза гормонов иодтиронинов (тироксина и трииодтиронина) (рис. 9.23, Г). Подробно их функции и синтез рассматриваются в модуле 11. В меланоцитах - пигментных клетках кожи, сетчатки глаз тирозин является предшественником пигментов меланинов (см. рис. 9.23, Б). 4. Частично заменимая аминокислота гистидин синтезируется из глутамата в сложном процессе, поскольку образование гетероциклического радикала в клетках человека и млекопитающих сопряжено с большими трудностями.
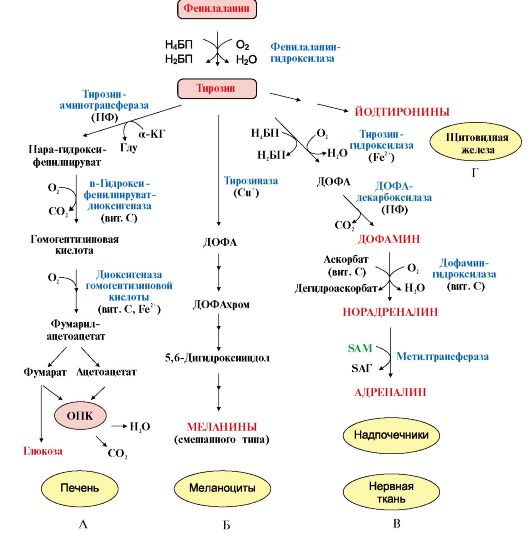 Рис. 9.23. Пути превращения фенилаланина и тирозина в разных тканях: Рис. 9.23. Пути превращения фенилаланина и тирозина в разных тканях:А - катаболизм фенилаланина и тирозина в печени; Б - синтез меланинов в меланоцитах; В - синтез катехоламинов в надпочечниках и нервной ткани; Г - синтез иодтиронинов в щитовидной железе Обмен гистидина включает синтез гистамина в соединительной ткани, а также путь катаболизма, который происходит в печени и, частично, в коже человека. В печени и коже дезаминирование гистидина катализирует фермент гистидаза. Образующийся уроканат только в печени способен превращаться через ряд стадий в глутамат. Наследственный дефект гистидазы вызывает накопление гистидина в организме и развитие гистидинемии, которая проявляется задержкой в умственном и физическом развитии детей. Ферменты гистидаза и уроканиназа (рис. 9.24) являются гепатоспецифическими, поэтому их определение используется в клинике для диагностики поражений печени. 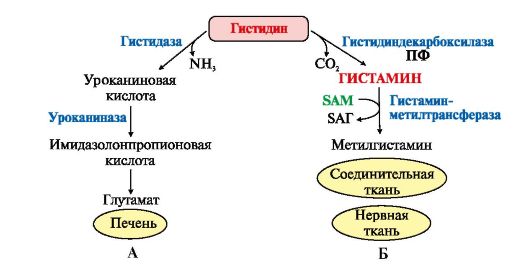 Рис. 9.24. Схема обмена гистидина в разных тканях: Рис. 9.24. Схема обмена гистидина в разных тканях:А - катаболизм гистидина в печени; Б - синтез и инактивация гистамина 7. Гистамин синтезируется путем декарбоксилирования гистидина в тучных клетках соединительной ткани, образует комплекс с белками и сохраняется в секреторных гранулах. Выделяется в кровь при повреждении ткани (удар, ожог, воздействие эндо- и экзогенных веществ). Гистамин выполняет следующие функции: • стимулирует секрецию желудочного сока, слюны (пищеварительный гормон); • обеспечивает воспалительную реакцию - расширение сосудов, покраснение кожи, отечность ткани; • обеспечивает аллергическую реакцию; • повышает проницаемость капилляров, вызывает отеки, снижает артериальное давление (но увеличивает внутричерепное давление, вызывает головную боль); • сокращает гладкую мускулатуру легких, вызывает удушье;
• выполняет роль нейромедиатора. |
