Единица 1 Роль белков в питании. Азотистый баланс Переваривание белков в желудке и кишечнике, всасывание аминокислот Трансаминирование и дезаминирование аминокислот Модульная единица 2
 Скачать 2.45 Mb. Скачать 2.45 Mb.
|
|
Гипераммониемия сопровождается появлением следующих симптомов:
486 Таблица 9-4. Наследственные нарушения орнитинового цикла и основные их проявления
Все симптомы гипераммониемии - проявление действия аммиака на ЦНС (см. выше подраздел IV, Б). Для диагностики различных типов гипераммониемии производят определение содержания аммиака в крови, метаболитов орнитинового цикла в крови и моче, акгивности фермента в биоптатах печени. Основной диагностический признак - повышение концентрации аммиака в крови. Содержание аммиака в крови может достигать 6000 мкмоль/л (в норме - 60 мкмоль/л). Однако в большинстве хронических случаев уровень аммиака может повышаться только после белковой нагрузки или в течение острых осложнённых заболеваний. 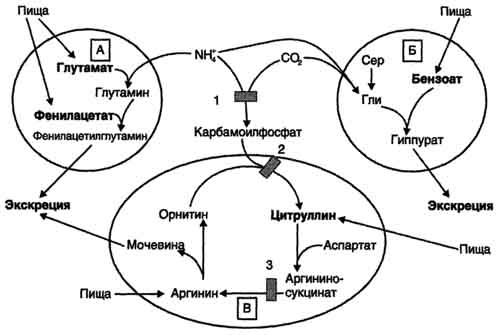 Лечение больных с различными дефектами орнитинового цикла в основном направлено на снижение концентрации аммиака в крови за счёт малобелковой диеты, введения кетоаналогов аминокислот в рацион и стимуляцию выведения аммиака в обход нарушенных реакций:
Вводимый больным с дефектом карбамоил-фосфатсинтетазы I в качестве пищевой добавки фенилацетат в результате его конъюгации с глутамином образует фенилацетилглутамин, который экскретируется почками. Состояние больных при этом улучшается, так как происходит активация синтеза глутамина и снижение концентрации аммиака в крови (рис. 9-19, А). Аналогичное действие оказывает введение бензоата, который связывает молекулу глицина. Образующаяся пшпуровая кислота выводится с мочой (рис. 9-19, Б). В составе гиппурата происходит выделение азота из организма. Недостаток глицина компенсируется либо путём синтеза его из серина, либо за счёт образования из NH3 и СО2 в реакции, катализируемой глицинсинтетазой. При этом образование глицина сопровождается связыванием одной молекулы аммиака. При гипераммониемии II типа (дефект орнитинкарбамоилтрансферазы) введение больших 487 Рис. 9-19. Пути выведения аммиака при включении в диету глутамата и фенилацетата (А), бензоата (Б), цитруллина и аргинина (В). На рисунке обозначены ферментные блоки: 1 - дефект карбамоилфосфатсинтетазы I; 2-дефект орнитинкарбамоилтрансферазы; 3 - дефект аргининосукцинатлиазы. доз цитруллина стимулирует синтез мочевины из аспартата (рис. 9-19, В), что также приводит к вьшедению азота из организма. Введение больших доз аргинина при аргининосукцинатурии (дефект аргининосукцинатлиазы) стимулирует регенерацию орнитина и выведение азота в составе цитруллина и аргининосукцината. 1. Особенности обмена метионина Метионин - незаменимая аминокислота. Она необходима для синтеза белков организма, участвует в реакциях дезаминирования, является источником атома серы для синтеза цистеина. Метионил-тРНК участвует в инициации процесса трансляции. Метальная группа метионина - мобильный одноуглеродный фрагмент, используемый для синтеза ряда соединений. Перенос метильной группы метионина на соответствующий акцептор называют реакцией трансметилирования, имеющей важное метаболическое значение. 499 Метальная группа в молекуле метионина прочно связана с атомом серы, поэтому непосредственным донором этого одноутлеродного фрагмента служит активная форма аминокислоты. Реакция активация метионина Активной формой метионина является S-аденозилметионин (SAM) - сульфониевая форма аминокислоты, образующаяся в результате присоединения метионина к молекуле аденозина. Аденозин образуется при гидролизе АТФ (см. схему А). Эту реакцию катализирует фермент метионин аденозилтрансфераза, присутствующий во всех типах клеток. Структура (-S+-CH3) в SAM - нестабильная группировка, определяющая высокую активность метильной группы (отсюда термин "активный метионин"). Эта реакция уникальна для биологических систем, так как, по-видимому, является единственной известной реакцией, в результате которой освобождаются все три фосфатных остатка АТФ. Отщепление метильной группы от SAM и перенос её на соединение-акцептор катализируют ферменты метилтрансферазы. SAM в ходе реакции превращается в S-аденозилгомоцистеин (SAT). Примеры реакций трансметилирования Синтез фосфатидилхолина из фосфатидилэтиноламина Фосфатидилхолины (лецитины) - наиболее распространённая группа глицерофосфолипидов, участвующих в образовании мембран клеток и липопротеинов, в составе которых осуществляется транспорт липидов (см. раздел 8) (см. схему Б). Синтез карнитина Карнитин - переносчик жирных кислот через мембрану митохондрий (см. раздел 8) (см. схему А на с. 501). Синтез креатина Креатин необходим для образования в мышцах высокоэнергетического соединения - кре-атинфосфата. Синтез креатина идёт в 2 стадии с участием 3 аминокислот: аргинина, глицина и метионина. В почках образуется гуанидинацетат при действии глицинамидинотрансферазы (см. схему Б на с. 501). Затем гуанидинацетат транспортируется в печень, где происходит реакция его метилирования (см. схему В на с. 501). 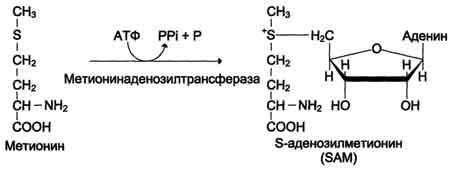 Схема А 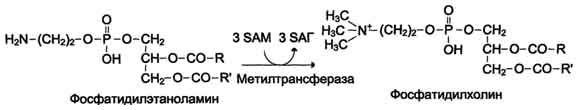 Схема Б 500 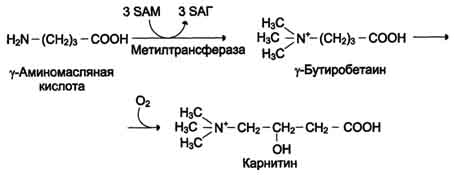 Схема А 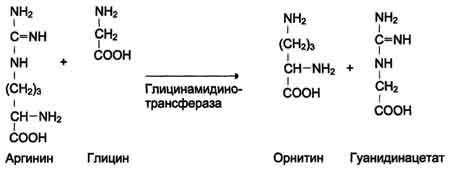 Схема Б 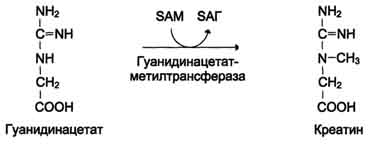 Схема В Креатин с кровотоком переносится в мышцы и клетки мозга, где из него образуется высокоэнергетическое соединение - креатинфосфат. (см. схему А на с. 502). Эта реакция легко обратима и катализируется ферментом креатинкиназой. Фермент локализован в цитозоле и митохондриях клеток, обладает органоспецифичностью. В норме активность его в крови очень мала. Обнаружено три изоферментные формы креатинкиназы (см. раздел 2). Креатинфосфат играет важную роль в обеспечении энергией работающей мышцы в начальный период. В результате неферментативного дефосфорилирования, главным образом в мышцах, креатинфосфат превращается в креатинин, выводимый с мочой. Суточное выделение кре-атинина у каждого индивидуума постоянно и пропорционально общей мышечной массе (см. схему Б на с. 502). Определение содержания креатина и креати-нина в крови и моче используется для характеристики интенсивности работы мышц в спортивной медицине и при некоторых патологических состояниях. Определение активности фермента креатинкиназы и его изоферментных форм в 501  Схема A 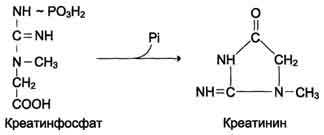 Схема Б крови используется в медицине для диагностики таких заболеваний, как инфаркт миокарда, миопатии, мышечные дистрофии и др. Реакции трансметилирования используются также для:
Регенерация метионина Реакции метилирования играют важную роль в организме и протекают очень интенсивно. Это вызывает большой расход метионина, так как он является незаменимой аминокислотой (в клетках метионин синтезироваться не может). В связи с этим большое значение приобретает возможность регенерации метионина с участием заменимых аминокислот (Сер, Гли). В результате отщепления метильной группы SAM превращается в S-аденозилгомоцистеин (SAT), который при действии гидролазы расщепляется на аденозин и гомоцистеин. S-аденозилгомоцистеин + Н2О → Аденозин + Гомоцистеин Гомоцистеин может снова превращаться в ме тионин под действием гомоцистеинметилтранс феразы. Донором метильной группы в этом слу чае служит N5-метил-Н4-фолат: 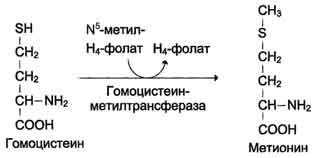 Промежуточным переносчиком метильной группы в этой реакции служит производное витамина В12 - метилкобаламин, выполняющий роль кофермента. Метионин - незаменимая аминокислота, однако может регенерироваться из гомоцистеина. Следовательно, незаменим именно гомоцистеин, но единственным его источником в организме служит метионин. В пище гомоцистеина крайне мало, поэтому потребности человека в метиони-не и гомоцистеине обеспечиваются только мети-онином пиши. Общая схема метаболизма метионина, связанная с обменом одноуглеродных фрагментов, представлена на рис. 9-27. Первичным донором одноуглеродныхкфраг-ментов является серии. Образовавшийся N5,N10-метилен-Н4-фолат восстанавливается до N5-метил-Н4-фолата, передающего метильную группу на кобаламин (витамин В12). Метилкобаламин непосредственно участвует в регенерации метионина. Гомоцистеин может использоваться также для синтеза цистеина. Метаболизм фенилаланина и тирозина Фенилаланин - незаменимая аминокислота, так как в клетках животных не синтезируется её бензольное кольцо. Тирозин - условно заменимая аминокислота, поскольку образуется из фенилаланина. Содержание этих аминокислот в пищевых белках (в том числе и растительных) достаточно велико. Фенилаланин и тирозин используются для синтеза многих биологически Схема Глутатион 504  Схема A  Схема Б активных соединений. В разных тканях метаболизм этих аминокислот происходит поразному (рис. 9-28). 1. Метаболизм феиилаланина Основное количество фенилаланина расходуется по 2 путям:
Превращение фенилаланина в тирозин прежде всего необходимо для удаления избытка фенилаланина, так как высокие концентрации его токсичны для клеток. Образование тирозина не имеет большого значения, так как недостатка этой аминокислоты в клетках практически не бывает. Основной путь метаболизма фенилаланина начинается с его гидроксилирования (рис. 9-29), в результате чего образуется тирозин. Эта реакция катализируется специфической монооксиге-назой - фенилаланингидр(жсилазой, кофермен-том которой служит тетрагидробиоптерин (Н4БП). Активность фермента зависит также от наличия Fe2+. Реакция необратима. Н4БП в результате реакции окисляется в дигидробиоптерин (Н2БП). Регенерация последнего происходит при участии дигидроптеридинредуктазы с использованием NADPH + H+. 2. Особенности обмена тирозина в разных тканях Обмен тирозина значительно сложнее, чем обмен фенилаланина. Кроме использования в синтезе белков, тирозин в разных тканях выступает предшественником таких соединений, как катехоламины, тироксин, меланины, и ка-таболизируется до СО2 и Н2О. Катаболизм тирозина в печени В печени происходит катаболизм тирозина до конечных продуктов. Специфический путь катаболизма включает несколько ферментативных реакций, завершающихся образованием фумарата и ацетоацетата (см. схему А на с. 507):
Обмен фенилаланина и тирозина связан со значительным количеством реакций гидроксилирования, которые катализируют оксигеназы. Ферменты оксигеназы (гидроксилазы) используют молекулу О2 и кофермент-донор водорода (чаще - Н4БП). Для катализа оксигеназам не- 505 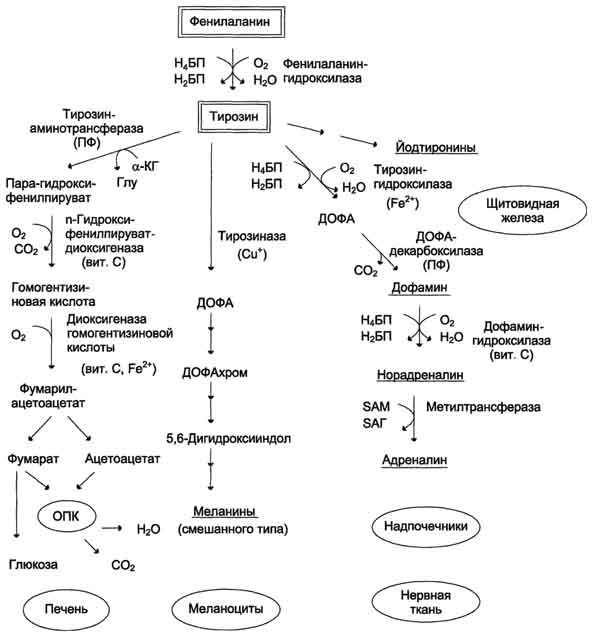 Рис. 9-28. Пути превращения фенилаланина и тирозина в разных тканях. Н4БП - тетрагидробиоптерин; Н2БП - дигидробиоптерин; ПФ - пиридоксальфосфат; SAM - S-аденозилметионин. обходимы кофакторы - Fe2+ или гем (для некоторых - Сu+), а для многих ещё и витамин С. Оксигеназы делят на 2 группы: | ||||||||||||||||||||||||||||||||||||||
