Единица 1 Роль белков в питании. Азотистый баланс Переваривание белков в желудке и кишечнике, всасывание аминокислот Трансаминирование и дезаминирование аминокислот Модульная единица 2
 Скачать 2.45 Mb. Скачать 2.45 Mb.
|
|
ТЕМА 9.12. ЗАБОЛЕВАНИЯ, СВЯЗАННЫЕ С НАРУШЕНИЕМ ОБМЕНА ФЕНИЛАЛАНИНА И ТИРОЗИНА Метаболизм фенилаланина, тирозина и гистидина в разных тканях приводит к образованию различных биологически активных соединений. Дефекты ферментов обмена этих аминокислот проявляются как наследственные заболевания (энзимопатии). 1. В печени фенилаланин метаболизируется двумя путями. Большая часть не использованного для синтеза белков Фен (до 80%) превращается в тирозин под действием фермента фенилаланингидроксилазы при участии кофермента тетрагидробиоптерина. Небольшое его количество включается в альтернативный путь: 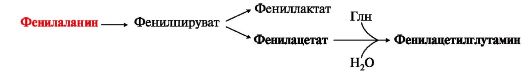 Конъюгат фенилацетата с глутамином выводится с мочой. При нормальной активности фенилаланингидроксилазы этот путь не имеет большого значения. Он становится главным при нарушении превращения фенилаланина в тирозин. Дефект фенилаланингидроксилазы приводит к заболеванию фенилкетонурии (ФКУ). Известны две формы заболевания: Конъюгат фенилацетата с глутамином выводится с мочой. При нормальной активности фенилаланингидроксилазы этот путь не имеет большого значения. Он становится главным при нарушении превращения фенилаланина в тирозин. Дефект фенилаланингидроксилазы приводит к заболеванию фенилкетонурии (ФКУ). Известны две формы заболевания:• классическая - наследственное заболевание, связанное с мутациями в гене фенилаланингидроксилазы. Наиболее тяжелое проявление - нарушение умственного и физического развития, судорожный синдром; • вариантная (биоптеринзависимая гиперфенилаланинемия) - следствие мутаций в генах, контролирующих метаболизм тетрагидробиоптерина(см. рис. 9.22). Клинические проявления - близкие, но не совпадающие с классической ФКУ. Тяжелые проявления ФКУ связаны с токсическим действием на клетки мозга высоких концентраций фенилаланина, фенилпирувата, фениллактата. Большие концентрации Фен ограничивают транспорт Тир и Три через гематоэнцефалический барьер и тормозят синтез нейромедиаторов. Тетрагидробиоптерин (Н4БП) необходим для реакций гидроксилирования не только Фен, но также Тир и Три, поэтому при недостатке этого кофермента нарушается метаболизм всех трех аминокислот, в том числе синтез нейромедиаторов - катехоламинов и серотонина. Заболевание характеризуется тяжелыми неврологическими нарушениями и ранней смертью (злокачественная ФКУ).
2. Нарушение катаболизма Тир в печени на стадии расщепления гомогентизиновой кислоты приводит к алкаптонурии («черная моча»). Для этого заболевания характерно выделение с мочой гомогентизиновой кислоты, которая, окисляясь кислородом воздуха, образует черные пигменты - алкаптоны. Алкаптоны способны откладываться в хрящевой ткани и суставах, что вызывает артриты и охроноз (черные пятна). Болезнь врожденная, связана с дефектом фермента диоксигеназы гомогентизиновой кислоты. 3. Наследственный дефект тирозиназы - фермента, катализирующего в меланоцитах превращение тирозина в ДОФА, вызывает нарушение синтеза темных пигментов меланинов, которое приводит к альбинизму. Основным клиническим проявлением альбинизма (от лат. albus - белый) являются отсутствие пигментации кожи и волос. У больных часто снижается острота зрения и появляется светобоязнь. Длительная инсоляция таких больных приводит к ожогам и раку кожи. 4. Недостаточность дофамина в черной субстанции мозга приводит к болезни Паркинсона. Это одна из самых распространенных неврологических болезней (частота встречаемости 1:200 среди людей старше 60 лет). Характеризуется снижением активности тирозингидроксилазы или ДОФА-декарбоксилазы. Заболевание сопровождается тремя основными симптомами: акинезия (скованность движений), ригидность (напряжение мышц), тремор конечностей (непроизвольное дрожание). Дофамин не проникает через гематоэнцефалический барьер, поэтому для лечения паркинсонизма используются следующие подходы: • заместительная терапия препаратами - предшественниками дофамина (производными ДОФА) - леводопа, мадопар, наком и др.; • подавление инактивации дофамина ингибиторами МАО - депренил, ниаламид, пиразидол и др. 5. Депрессивные состояния часто связаны со снижением в нервных клетках содержания дофамина и норадреналина. Гиперсекреция дофамина в височной доле мозга наблюдается при шизофрении.
ТЕМА 9.13. БИОГЕННЫЕ АМИНЫ: СИНТЕЗ, ИНАКТИВАЦИЯ, БИОЛОГИЧЕСКАЯ РОЛЬ 1. Некоторые аминокислоты и их производные могут подвергаться декарбоксилированию - отщеплению α-карбоксильной группы. Продуктами реакции являются СО2 и биогенные амины (табл. 9.7). Образование биогенных аминов происходит с участием ферментов декарбоксилаз в присутствии кофермента пиридоксальфосфата. 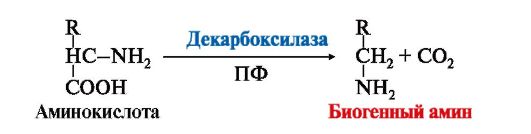 Биогенные амины являются биологически активными веществами, выполняют функцию нейромедиаторов (серотонин, дофамин, ГАМК), гормонов (адреналин), регуляторных факторов местного действия (гистамин). Биогенные амины являются биологически активными веществами, выполняют функцию нейромедиаторов (серотонин, дофамин, ГАМК), гормонов (адреналин), регуляторных факторов местного действия (гистамин).2. В нервных клетках декарбоксилирование глутамата приводит к образованию γ-аминомасляной кислоты (ГАМК), которая являетсяосновным тормозным медиатором. Инактивации ГАМК происходит либо путем трансаминирования и превращения в сукцинат, являющийся метаболитом ЦТК, либо окислительным путем под действием моноаминооксидазы (МАО) (рис. 9.25).  Рис. 9.25. Схема синтеза и инактивации ГАМК Рис. 9.25. Схема синтеза и инактивации ГАМКГАМК в виде препаратов гаммалон или аминалон применяют при нарушениях мозгового кровообращения, умственной отсталости, эндогенных депрессиях и травмах головного мозга. 3. В нервной ткани из серина синтезируется ацетилхолин, который также относится к биогенным аминам: 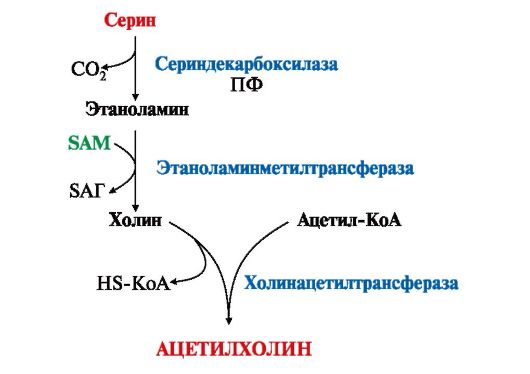 Нарушение образования ацетилхолина в синапсах может вызватьмиастению - мышечную слабость. Нарушение образования ацетилхолина в синапсах может вызватьмиастению - мышечную слабость.4. Серотонин - нейромедиатор проводящих путей, образуется в гипоталамусе, надпочечниках из аминокислоты триптофана: 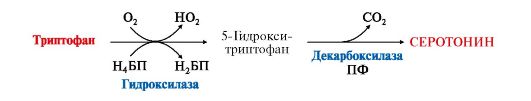 Серотонин представляет собой биологически активное вещество широкого спектра действия. Он стимулирует сокращение гладкой мускулатуры, перистальтику кишечника, оказывает сосудосуживающий эффект, регулирует артериальное давление, температуру тела, дыхание, обладает антидепрессантным действием («гормон удовольствия»), принимает участие в аллергической реакции, поскольку в небольших количествах синтезируется в тучных клетках. Серотонин представляет собой биологически активное вещество широкого спектра действия. Он стимулирует сокращение гладкой мускулатуры, перистальтику кишечника, оказывает сосудосуживающий эффект, регулирует артериальное давление, температуру тела, дыхание, обладает антидепрессантным действием («гормон удовольствия»), принимает участие в аллергической реакции, поскольку в небольших количествах синтезируется в тучных клетках.
5. К биогенным аминам относятся и катехоламины (дофамин, норадреналин и адренамин) (см. рис. 9.23, В). Таблица 9.7. Биологическая роль и предшественники некоторых биогенных аминов 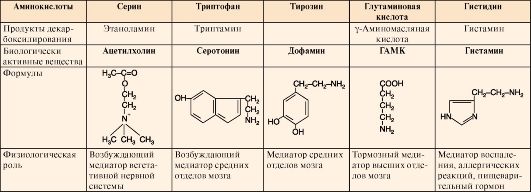 6. Инактивация биогенных аминов происходит двумя путями: 6. Инактивация биогенных аминов происходит двумя путями:• метилирование с участием SAM под действием метилтрансфераз - характерно для гистамина, адреналина, норадреналина: 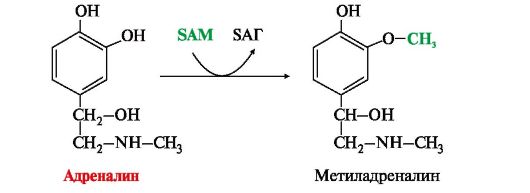 окисление ферментами моноаминооксидазами (МАО) с коферментом FAD - характерно для дофамина, норадреналина, серотонина, ГАМК. окисление ферментами моноаминооксидазами (МАО) с коферментом FAD - характерно для дофамина, норадреналина, серотонина, ГАМК.При окислении биогенных аминов происходит дезаминирование и образование альдегида, а затем кислоты, которые выводятся почками: 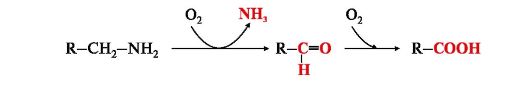 1. Белки являются одним из важнейших элементов живого организма, именно поэтому мы начнем с описания роли и строения именно этого класса биоорганических соединений. Белки в организме выполняют следующие функции: 1. Структурная или пластическая функция. Белки являются универсальным строительным материалом, из которого состоят практически все структуры живых клеток. Например, в организме человека белки составляют около 1/6 от массы тела. Причем, у тренированных людей с хорошо развитыми мышцами эта цифра может быть и выше. 2. Каталитическая функция. Многие белки, называемые ферментами или энзимами, выполняют в живых системах функцию катализаторов, то есть изменяют скорости протекания химических реакций (о чем подробно будет сказано ниже). 3. Сократительная функция. Именно белковые молекулы лежат в основе всех форм движения живых систем. Мышечное сокращение = это, прежде всего работа белков. 4. Регуляторная функция. В основе этой функции лежит способность белковых молекул реагировать и с кислотами и основаниями, называемых в химии амфотерностью. Белки участвуют в создании гомеостаза(поддержание постоянства внутренней стреды) организма. Многие белки являются гормонами. 5. Рецепторная функция. В основе этой функции лежит способность белков реагировать на возникающие изменения условий внутренней среды организма. Различные рецепторы в организме, чувствительные к температуре, давлению, освещенности являются белками. Рецепторы гормонов – это тоже белки. 6. Транспортная функция. Белковые молекулы имеют большой размер, хорошо растворимы в воде, что позволяет им легко перемещаться по водным растворам и переносить различные вещества. Например, гемоглобин переносит газы, альбумины крови переносят жиры и жирные кислоты. 7. Защитная функция. Белки защищают организм, прежде всего, участвуя в создании иммунитета. 8. Энергетическая функция. Белки не являются главными участниками энергетического обмена, но все же до 10% суточной потребности организма в энергии обеспечивают именно они. В то же время, это слишком ценный продукт, чтобы использовать его, как источник энергии. Поэтому белки используются в качестве источника энергии только после углеводов и жиров. По материал Интернет  Изучение проблемы нормы белка в питании человека имеет, кроме академического интереса, большое социальное значение. Принятые в нашей стране нормы белка для взрослого человека и для детей разного возраста основаны на результатах многочисленных научных исследований отечественных ученых, учитывают разные климатические условия, условия труда, профессию, возраст и другие факторы. Эти нормы выводятся из оптимального содержания белка в пищевом рационе. Так, взрослый человек, занимающийся умственным трудом или подвергающийся средней физической нагрузке (полностью механизированный труд), должен получать 100–120 г белкав сутки при трате общего количества энергии 12000 кДж. При изменении условий труда (недостаточно механизированный труд) и больших тратах энергии нормабелка увеличивается на 10 г на каждые 2100 кДж. Рабочие, выполняющие тяжелую физическую работу, должны получать 130–150 г белка в сутки. Потребности в белках детей определяются в первую очередь возрастом и массой тела. Дети даже раннего детского возраста нуждаются в 55–72 г белка в сутки. С возрастом (от 12 до 15 лет) эта норма увеличивается до суточной нормы взрослого человека. Суточные потребности в белке резко возрастают прибеременности и лактации, а также при некоторых патологических состояниях, когда организм теряет белок с мочой или асцитной жидкостью, экссудатами при нефритах, тяжелых инфекционных заболеваниях, ожогах, травмах и т.д. На долю аминокислот (в составе белков и свободных) приходится более 95 % всего азота организма. Поэтому об общем состоянии аминокислотного и белкового обмена можно судить по азотистому балансу, т. е. разнице между количеством азота,поступающего с пищей, и количеством выделяемого азота (главным образом в составе мочевины). 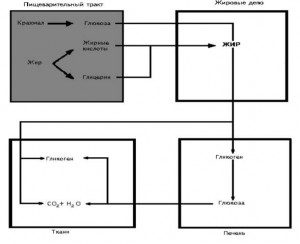 Азотистый баланс - схема. У взрослого здорового человека при нормальном питании имеет место азотистое равновесие, т. е. количество выделяемого азота равно количеству поступающего. В период роста организма, а также при выздоровлении после истощающих заболеваний выводится азота меньше, чем поступает, — положительный азотистый баланс. При старении, голодании и в течение истощающих заболеваний азота выводится больше, чем поступает, — отрицательный азотистый баланс. При положительном азотистом балансе часть аминокислот пищи задерживается в организме, включаясь в состав белков и клеточных структур; общая масса белков в организме увеличивается. Наоборот, при отрицательном азотистом балансе общая масса белков уменьшается (катаболическое состояние). Если из диеты исключить все белки, но полностью сохранить другие компоненты в количествах, обеспечивающих энергетические потребности организма, то азотистый баланс становится отрицательным. Примерно через неделю пребывания на такой диете количество выводимого азота стабилизируется, достигая величины около 4 г за сутки. Такое количество азота соответствует 25 г белка (или аминокислот). Следовательно, при белковом голодании организм ежесуточно расходует около 25 г белков собственных тканей. Практически такой же результат получается при исключении из диеты не всех белков, а только незаменимых аминокислот или даже только одной из них. При полном голодании отрицательный азотистый баланс еще больше, чем при исключении из пищи только белков. Это обусловлено тем, что аминокислоты, образующиеся при распаде тканевых белков, при полном голодании используются также и для обеспечения энергетических потребностей организма. В рационе, достаточном по калорийности, минимальное количество белков, необходимое для поддержания азотистого равновесия, составляет 30-50 г. Однако это количество не обеспечивает оптимума для здоровья и работоспособности. Взрослый человек при средней физической нагрузке должен получать о100коло 100 г белков в сутки. 2. В пищевых продуктах содержание свободных аминокислот очень мало. Подавляющее их количество входит в состав белков, которые гидролизуются 461 в ЖКТ под действием ферментов протеаз (пептидщцролаз). Субстратная специфичность этих ферментов заключается в том, что каждый из них с наибольшей скоростью расщепляет пептидные связи, образованные определёнными аминокислотами. Протеазы, гидролизующие пептидные связи внутри белковой молекулы, относят к группе эндопептидаз. Ферменты, относящиеся к группе экзопептидаз, гидролизуют пептидную связь, образованную концевыми аминокислотами. Под действием всех протеаз ЖКТ белки пищи распадаются на отдельные аминокислоты, которые затем поступают в клетки тканей. А. Переваривание белков в желудке Желудочный сок - продукт нескольких типов клеток. Обкладочные (париетальные) клетки стенок желудка образуют соляную кислоту, главные клетки секретируют пепсиноген. Добавочные и другие клетки эпителия желудка выделяют муцинсодержащую слизь. Париетальные клетки секретируют в полость желудка также гликопротеин, который называют "внутренним фактором" (фактором Касла). Этот белок связывает "внешний фактор" - витамин В12, предотвращает его разрушение и способствует всасыванию. 1. Образование и роль соляной кислоты Основная пищеварительная функция желудка заключается в том, что в нём начинается переваривание белка. Существенную роль в этом процессе играет соляная кислота. Белки, поступающие в желудок, стимулируют выделение гистамина и группы белковых гормонов -гастринов (см. раздел 11), которые, в свою очередь, вызывают секрецию НСI и профермента - пепсиногена. НСI образуется в обкладочных клетках желудочных желёз в ходе реакций, представленных на рис. 9-2. Источником Н+ является Н2СО3, которая образуется в обкладочных клетках желудка из СО2, диффундирующего из крови, и Н2О под действием фермента карбоангидразы (карбонатдегидра-тазы): Н2О + СО2 → Н2СО3 → НСО3- + H+ Диссоциация Н2СО3 приводит к образованию бикарбоната, который с участием специальных белков выделяется в плазму в обмен на С1-, и ионов Н+, которые поступают в просвет желудка путём активного транспорта, катализируемого мембранной Н+/К+-АТФ-азой. При этом концентрация протонов в просвете желудка увеличивается в 106 раз. Ионы С1- поступают в просвет желудка через хлоридный канал. Концентрация НСl в желудочном соке может достигать 0,16 М, за счёт чего значение рН снижается до 1,0-2,0. Приём белковой пищи часто сопровождается выделением щелочной мочи за счёт секреции большого количества бикарбоната в процессе образования НСl. 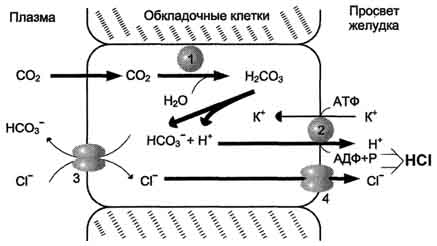 Рис. 9-2. Секреция соляной кислоты в желудке. 1 - карбоангидраза; 2 - Н+/К+- АТФ-аза; 3 - белки-переносчики анионов; 4 - хлоридный канал. 462 Под действием НСl происходит денатурация белков пищи, не подвергшихся термической обработке, что увеличивает доступность пептидных связей для протеаз. НСl обладает бактерицидным действием и препятствует попаданию патогенных бактерий в кишечник. Кроме того, соляная кислота активирует пепсиноген и создаёт оптимум рН для действия пепсина. 2.Механизм активации пепсина Под действием гастринов в главных клетках желудочных желёз стимулируются синтез и секреция пепсиногена - неактивной формы пепсина. Пепсиноген - белок, состоящий из одной полипептидной цепи с молекулярной массой 40 кД. Под действием НСl он превращается в активный пепсин (молекулярная масса 32,7 кД) с оптимумом рН 1,0-2,5. В процессе активации в результате частичного протеолиза от N-конца молекулы пепсиногена отщепляются 42 аминокислотных остатка, которые содержат почти все положительно заряженные аминокислоты, имеющиеся в пепсиногене. Таким образом, в активном пепсине преобладающими оказываются отрицательно заряженные аминокислоты, которые участвуют в конформационных перестройках молекулы и формировании активного центра. Образовавшиеся под действием НСl активные молекулы пепсина быстро активируют остальные молекулы пепсиногена (аутокатализ). Пепсин в первую очередь гидролизует пептидные связи в белках, образованные ароматическими аминокислотами (фенилаланин, триптофан, тирозин) и несколько медленнее - образованные лейцином и дикарбоновыми аминокислотами. Пепсин - эндопептидаза, поэтому в результате его действия в желудке образуются более короткие пептиды, но не свободные аминокислоты. 3.Возрастные особенности переваривания белков в желудке У детей грудного возраста в желудке находится фермент реннин (химозин) , вызывающий свёртывание молока. Основной белок молока - казеин, представляющий смесь нескольких белков, различающихся по аминокислотному составу и электрофоретической подвижности. Реннин катализирует отщепление от казеина гликопептида, в результате чего образуется параказеин. Параказеин присоединяет ионы Са2+, образуя нерастворимый сгусток, чем предотвращает быстрый выход молока из желудка. Белки успевают расщепиться под действием пепсина. В желудке взрослых людей реннина нет, молоко у них створаживается под действием НСl и пепсина. В слизистой оболочке желудка человека найдена ещё одна протеаза - гастриксин. Все 3 фермента (пепсин, реннин и гастриксин) сходны по первичной структуре, что указывает на их происхождение от общего гена-предшественника. 4. Нарушения переваривания белков в желудке При различных заболеваниях ЖКТ в желудке нарушается выделение НСl и пепсиногена, при этом переваривание белков заметно снижается. Наиболее часто встречаются патологические изменения кислотности желудочного сока. Нарушение образования пепсина отмечают реже и выявляют при более значительных поражениях желудка. Определение кислотности желудочного сока используют для диагностики различных заболеваний желудка (табл. 9-2). Повышенная кислотность желудочного сока обычно сопровождается изжогой, диареей и может быть симптомом язвы желудка и двенадцатиперстной кишки, а также гиперацидного гастрита. Пониженная кислотность бывает при некоторых видах гастритов. Полное отсутствие НСl и пепсина (желудочная ахилия) наблюдается при атрофических гастритах и часто сопровождается пернициозной анемией вследствие недостаточности выработки фактора Касла и нарушения всасывания-витамина В12 (см. раздел 3). Анацидность (рН желудочного сока >6,0) свидетельствует о значительной потере слизистой оболочкой желудка обкладочных клеток, секретирующих соляную кислоту, что часто вызывает рак желудка. Кислотность желудочного сока выражается в титрационных единицах (ТЕ) - количество 0,1 М NaOH в 1 мл, затраченное на титрование 100 мл желудочного сока по определённому индикатору. При определении кислотности желудочного сока различают: общую кислотность, связанную НСl и свободную НСl.
463 Таблица 9-2. Компоненты желудочного сока в норме и при патологических состояниях
Значения общей кислотности в норме составляют 40-60 ТЕ.
Молочная кислота в норме в желудочном соке отсутствует. Она образуется при уменьшении содержания или отсутствии свободной соляной кислоты в результате размножения молочнокислых бактерий или при злокачественных опухолях желудка, в клетках которых глюкоза окисляется анаэробным путём. При диагностике заболеваний желудка, кроме биохимических анализов, обязательно проводят рентгенологические и эндоскопические исследования, а также биопсию. Б. Переваривание белков в кишечнике Желудочное содержимое (химус) в процессе переваривания поступает в двенадцатиперстную кишку. Низкое значение рН химуса вызывает в кишечнике выделение белкового гормона секретина, поступающего в кровь. Этот гормон в свою очередь стимулирует выделение из поджелудочной железы в тонкий кишечник панкреатического сока, содержащего НСО3-, что приводит к нейтрализации НСl желудочного сока и ингибированию пепсина. В результате рН резко возрастает от 1,5-2,0 до ∼7,0. Поступление пептидов в тонкий кишечник вызывает секрецию другого белкового гормона - холецистокинина (см. раздел 11), который стимулирует выделение панкреатических ферментов с оптимумом рН 7,5-8,0. Под действием ферментов поджелудочной железы и клеток кишечника завершается переваривание белков. 1. Активация панкреатических ферментов В поджелудочной железе синтезируются проферменты ряда протеаз: трипсиноген, химотрипсиноген, проэластаза, прокарбоксипептидазы А и В. В кишечнике они путём частичного протеолиза превращаются в активные ферменты трипсин, химотрипсин, эластазу и карбок-сипептидазы А и В. Активация трипсиногена происходит под действием фермента эпителия кишечника энтеропептидазы. 464 Этот фермент отщепляет с N-конца молекулы трипсиногена гексапептид Вал-(Асп)4-Лиз. Изменение конформации оставшейся части полипептидной цепи приводит к формированию активного центра, и образуется активный трипсин. Последовательность Вал-(Асп)4-Лиз присуща большинству известных трипсиноге-нов разных организмов - от рыб до человека. Образовавшийся трипсин активирует химотрипсиноген, из которого получается несколько активных ферментов (рис. 9-3). Химотрипсиноген состоит из одной полипептидной цепи, содержащей 245 аминокислотных остатков и пяти дисульфидных мостиков. Под действием трипсина расщепляется пептидная связь между 15-й и 16-й аминокислотами, в результате чего образуется активный π-химотрипсин. Затем под действием π-химотрипсина отщепляется дипептид сер(14)-арг(15), что приводит к образованию δ-химотрипсина. Отщепление дипептида тре(147)-арг(148) завершает образование стабильной формы активного фермента - α-химотрипсина, который состоит из трёх полипептидных цепей, соединённых дисульфидными мостиками. Остальные проферменты панкреатических протеаз (проэластаза и прокарбоксипептидазы А и В) также активируются трипсином путём частичного протеолиза. В результате образуются активные ферменты - эластаза и карбокси-пептидазы А и В. 2. Специфичность действия протеаз Трипсин преимущественно гидролизует пептидные связи, образованные карбоксильными группами аргинина и лизина. Химотрипсины наиболее активны в отношении пептидных связей, образованных карбоксильными группами ароматических аминокислот (Фен, Тир, Три). Карбоксипептидазы А и В - цинксодержащие ферменты, отщепляют С-концевые остатки аминокислот. Причём карбоксипептидаза А 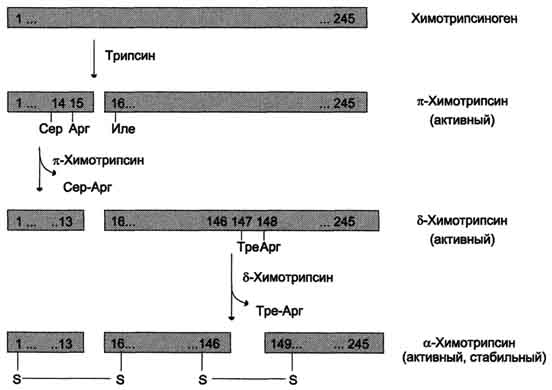 Рис. 9-3. Активация химотрипсиногена. Молекула химотрипсиногена состоит из 245 аминокислотных остатков и имеет пять дисульфидных мостиков. На схеме показаны участки фермента, подвергающиеся протеолизу. а-Химотрипсин - активная стабильная форма фермента - состоит из трёх полипептидных цепей, ковалентно связанных между собой двумя дисульфидными мостиками и нековалентно - за счёт водородных связей и гидрофобных взаимодействий. 465 отщепляет преимущественно аминокислоты, содержащие ароматические или гидрофобные радикалы, а карбоксипептидаза В - остатки аргинина и лизина. Последний этап переваривания - гидролиз небольших пептидов, происходит под действием ферментов аминопептидаз и дипептидаз, которые синтезируются клетками тонкого кишечника в активной форме.
В результате последовательного действия всех пищеварительных протеаз большинство пищевых белков расщепляется до свободных аминокислот. В. Защита клеток от действия протеаз Клетки поджелудочной железы защищены от действия пищеварительных ферментов тем, что:
В полости желудка и кишечника протеазы не контактируют с белками клеток, поскольку слизистая оболочка покрыта слоем слизи, а каждая клетка содержит на наружной поверхности плазматической мембраны полисахариды, которые не расщепляются протеазами и тем самым защищают клетку от их действия. Разрушение клеточных белков протеазами происходит при язвенной болезни желудка или двенадцатиперстной кишки. Однако начальные механизмы возникновения язвы ещё мало изучены. Г. Транспорт аминокислот в клетки Аминокислоты, образовавшиеся при переваривании белков, быстро всасываются в кишечнике. Транспорт их осуществляется двумя путями: через воротную систему печени, ведущую прямо в печень, и по лимфатическим сосудам, сообщающимся с кровью через грудной лимфатический проток. Максимальная концентрация аминокислот в крови достигается через 30-50 мин после приёма белковой пищи (углеводы и жиры замедляют всасывание аминокислот). Всасывание L-аминокислот (но не D-изомеров) - активный процесс, требующий затраты энергии. Аминокислоты переносятся через кишечную стенку от слизистой её поверхности в кровь (рис. 9-4). Перенос через щёточную кайму осуществляется целым рядом переносчиков, многие из которых действуют при участии Nа+-зависимых механизмов симпорта, подобно переносу глюкозы (см. раздел 7). Различная скорость проникновения аминокислот через мембраны клеток указывает на наличие транспортных систем, обеспечивающих перенос аминокислот как через внешнюю плазматическую мембрану, так и через внутриклеточные мембраны. В настоящее время известно по крайней мере пять специфических транспортных систем, каждая из которых функционирует 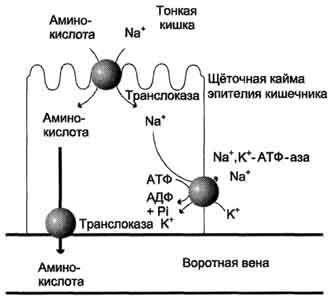 Рис. 9-4. Механизм всасывания аминокислот в кишечнике. L-аминокислота поступает в энтероцит путём симпорта с ионом Na+. Далее специфическая транслоказа переносит аминокислоту через мембрану в кровь. Обмен ионов натрия между клетками осуществляется путём первично-активного транспорта с помощью Nа+,К+-АТФ-азы. 466 для переноса определённой группы близких по строению аминокислот:
Причём к числу Nа+-зависимых относятся переносчики аминокислот, входящих в первую и пятую группы, а также переносчик метионина. Независимые от Na+ переносчики специфичны для некоторых нейтральных аминокислот (фенилаланин, лейцин) и аминокислот с катионными радикалами (лизин). Аминокислоты конкурируют друг с другом за специфические участки связывания. Например, всасывание лейцина (если концентрация его достаточно высока) уменьшает всасывание изолейцина и валина. Одна из специфических транспортных систем для некоторых нейтральных аминокислот функционирует в кишечнике, почках и, по-видимому, мозге. Она получила название γ-глутамильного цикла (рис. 9-5). В этой системе участвуют 6 ферментов, один из которых находится в клеточной мембране, а остальные - в цитозоле. Ключевую роль в транспорте аминокислоты играет мембранно-связан-ный фермент γ-глутамилтрансфераза. Этот фермент является гликопротеином и катализирует перенос γ-глутамильной группы от глутатиона (иногда другого γ-глутамильного пептида) на транспортируемую аминокислоту и последующий перенос комплекса в клетку. Глутатион представляет собой трипептид - γ-глутамилцистеинилглицин, который находится во всех тканях животных. Реакция протекает следующим образом (см. схему А на с. 468). Аминокислота, связанная с γ-глутамильным остатком, оказывается внутри клетки. В следующей реакции происходит отщепление γ-глутамильного 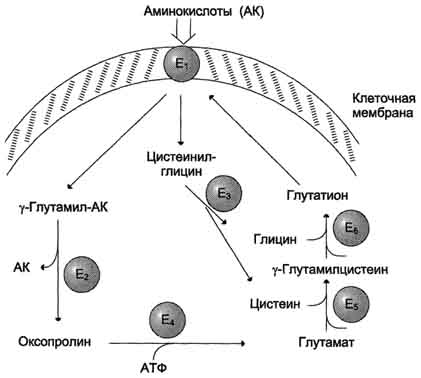 Рис. 9-5. γ-Глутамильный цикл. Система состоит из одного мембранного и пяти цитоплазматических ферментов. Перенос аминокислоты внутрь клетки осуществляется в комплексе с глутамильным остатком глутатиона под действием γ-глутамилтрансферазы. Затем аминокислота освобождается, а γ-глутамильный остаток в несколько стадий превращается в глутатион, который способен присоединять следующую молекулу аминокислоты. Е1 - γ-глутамилтрансфераза; Е2 - у-глутамилциклотрансфераза; Е3 - пептидаза; Е4 - оксопролиназа; Е5 - γ-глутамилцистеинсинтетаза; Е6 - глутатионсинтетаза. 467 остатка под действием фермента γ-глутамилциклотрансферазы (см. схему Б). Дипептид цистеинилглицин расщепляется под действием пептидазы на 2 аминокислоты - цис-теин и глицин. В результате этих 3 реакций происходит перенос одной молекулы аминокислоты в клетку (или внутриклеточную структуру). Следующие 3 реакции обеспечивают регенерацию глутатиона, благодаря чему цикл повторяется многократно. Для транспорта в клетку одной молекулы аминокислоты с участием γ-глутамильного цикла затрачиваются 3 молекулы АТФ. Д. Нарушение переваривания белков и транспорта аминокислот Небольшую долю продуктов переваривания белка составляют негидролизованные короткие пептиды. У некоторых людей возникает иммунная реакция на приём белка, что, очевидно, связано со способностью к всасыванию таких пептидов. Продукты полностью переваренного белка (аминокислоты) лишены антигенных свойств и иммунных реакций не вызывают. У новорождённых проницаемость слизистой оболочки кишечника выше, чем у взрослых, поэтому в кровь могут поступать антитела молозива (секрет молочных желёз, выделяющийся в первые дни после родов, обогащённый антителами и антитоксинами). Это усугубляется наличием в молозиве белка - ингибитора трипсина. Протеолитические ферменты в пищеварительных секретах новорождённых обладают низкой активностью. Всё это способствует всасыванию в кишечнике небольшого количества нативных белков, достаточного для обеспечения иммунной реакции. Очевидно, подобное усиление всасывающей способности кишечника является причиной наблюдаемой иногда непереносимости белков пищи (например, молока и яиц) у взрослых людей. Гниение Известно, что микроорганизмы кишечника для своего роста также нуждаются в доставке с пищей определенных аминокислот. Микрофлора кишечника располагает набором ферментных систем, отличных от соответствующихферментов животных тканей и катализирующих самые разнообразные превращения пищевых аминокислот. В кишечнике создаются оптимальные условия для образования ядовитых продуктов распада аминокислот: фенола,индола, крезола, скатола, сероводорода, метилмер-каптана, а также нетоксичных для организма соединений: спиртов, аминов, жирных кислот,кетокислот, оксикислот и др. Все эти превращения аминокислот, вызванные деятельностью микроорганизмовкишечника, получили общее название «гниение белков в кишечнике». Так, в процессе распада серосодержащих аминокислот (цистин, цистеин, метионин) в кишечнике образуются сероводород H2S и метил-меркаптан CH3SH. Диаминокислоты – орнитин и лизин – подвергаются процессудекарбоксилирования с образованием аминов – путресцина и кадаверина. Из ароматических аминокислот: фенилаланин, тирозин и триптофан – при аналогичном бактериальном декарбоксилировании образуются соответствующие амины: фенилэтиламин, параоксифенилэтиламин (или тира-мин) и индолилэтиламин (триптамин). Кроме того, микробные ферментыкишечника вызывают постепенное разрушение боковых цепей циклическихаминокислот, в частности тирозина и триптофана, с образованием ядовитых продуктов обмена – соответственно крезола и фенола, скатола и индола. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
