Экзаменационные вопросыответы на экзамен по биохимии для педиатрического факультета 2012 года
 Скачать 4.91 Mb. Скачать 4.91 Mb.
|
|
Экзаменационные вопросы/ответы на экзамен по биохимии для педиатрического факультета 2012 года 1. Биохимия, ее задачи. Значение биохимии для медицины. Современные биохимические методы исследования. БХ—наука о структуре веществ, входящих в состав живого организма, их превращениях и физико-химических процессах, лежащих в основе жизнедеятельности. Задачи БХ 1.Изучение процессов БИОКАТАЛИЗА. 2.Изучение механизмов наследственности на молекулярном уровне. 3.Изучение строения и обмена нуклеиновых кислот. 4.Изучение строения и обмена белков, жиров 5.Изучение превращения углеводов. 7.Изучение биологической роли сигнальных молекул (ГОРМОН). 8.Изучение роли витаминов в обмене веществ. 9.Изучение роли минеральных веществ. Значение БХ для медицины. Основные задачи медицины: патогенез, диагностика, лечение, профилактика заболеваний. 1.Значение БХ для понимания механизма заболевания. ПР. Сердечно-сосудистые заболевания (атеросклероз). В настоящее время предполагают, что важным является чувствительность рецепторов клеток к ЛПНП 2.Значение БХ для диагностики заболеваний. Широкое использование биохимических исследований биологических жидкостей. A. Количество субстратов. Б. Исследование активности ферментов. B. Исследование уровня гормонов. Методы РИА, ИФА. Выявление ПРЕДЗАБОЛЕВАНИЙ. 3. Значение БХ для лечения. Выявление нарушенных звеньев метаболизма, создание соответствующих лекарственных препаратов, широкое использование природных препаратов. 4.Значение БХ для профилактики заболеваний. ПР. Недостаток вит. С —цинга—для профилактики вит. С. Недостаток вит. D— рахит—вит. D 2. Аминокислоты, их классификация. Строение и биологическая роль аминокислот. Хроматография аминокислот. Белки состоят из АК. Все АК можно разделить на 4 группы: 1 .Заменимые - синтезируются в организме: АЛА, АСП, АСН, ГЛУ, ГЛН, ГЛИ, ПРО, СЕР. 2.Незаменимые - не синтезируются в организме и поступают с пищей: ВАЛ, ЛЕЙ, ИЛЕ. ЛИЗ. ТРЕ, МЕТ, ФЕН, ТРИ. 3.Частично заменимые - синтезируются в организме, но очень медленно и не покрывают всех потребностей организма: ГИС, АРГ. 4.Условно заменимые - синтезируются из незаменимых аминокислот: ЦИС (МЕТ), ТИР (ФЕН). Полноценность белкового питания определяется: 1. Наличием всех незаменимых аминокислот. Отсутствие даже одной незаменимой аминокислоты нарушает биосинтез белка.
В изоэлектрическом состоянии белок менее устойчив. Это свойство белков используется при их ФРАКЦИВАНИИ: 1.ИОНООБМЕННАЯ ХРОМАТОГРАФИЯ. Для неё используется ИОНООБМЕННИКИ, которые изготавливаются из чистой целлюлозы: ДЭАЭ - целлюлоза (содержит катионные группы); КМ - целлюлоза (содержит анионные группы). На ДЭАЭ разделяют отрицательно заряженные белки, на КМ - положительно заряженные. Чем больше в белке СООН групп, тем прочнее он связывается с ДЭАЭ целлюлозой. 2.Разделение белков на основании величины заряда - электрофорез белков. С помощью электрофореза в сыворотке крови выделяют как минимум 5 фракций: АЛЬБУМИНЫ, альфа, альфа-2, гамма, бета - глобулины. 1. Белки - АЗОТСОДЕРЖАЩИЕ вещества (до 16 %). 2. Структурной единицей белков являются альфа АК L-РЯДА. З.АК связываются ПЕПТИДНЫМИ связями в ПОЛИПЕПТИДНУЮ цепь, 4. Большая молекулярная масса белков (от 20000 до нескольких миллионов дальтон). 5. Сложная структурная организация. ПЕРВИЧНАЯ СТРУКТУРА - последовательное соединение АК в ПОЛИПЕПТИДНОЙ цепи с помощью ПЕПТИДНЫХ связей. Свойства ПОЛИПЕПТИДНОЙ цепи зависят от составляющих её АК. ВТОРИЧНАЯ СТРУКТУРА - способ укладки в пространстве ПОЛИПЕПТИДНОЙ цепи. Образуется за счет водородных связей между 1 и 4 АК. Выделяют 3 вида вторичной структуры: 1 .Альфа спираль ( Л.ПОЛЛИНГ) - виток составляет от 3 до 6 АК. Терминатором спирали является АК-ПРОЛИН. 2.Бетта складчатый слой. 3.Петли ПОЛИПЕПТИДНОЙ цепи (соединительные петли). ТРЕТИЧНАЯ СТРУКТУРА - укладка вторичной структуры более компактно, в виде ГЛОБУЛЫ или ФИБРИЛЛЫ. Осуществляется за счёт водородных, ионных, ДИСУЛЬФИДНЫХ и гидрофобных связей. Домены - это фрагменты ПОЛИПЕПТИДНОЙ цепи, сходные по свойствам с самостоятельными глобулярными белками. Домен автономен. Домены возникают в результате слияния нескольких генов отдельных белков. ЧЕТВЕРТИЧНАЯ СТРУКТУРА - объединение неск. доменов. П. Гемоглобин-4 субъединицы. 3. Электро-химические свойства белков как основа методов их исследования. Электрофорез белков крови. 1.Молекулярная масса белков определяет многие свойства белков: седиментация, диффузия, плотность белковых растворов, коллоидные свойства белков и др. характеристики. Молекулярную массу белка можно определить по скорости седиментации (осаждения) при УЛЬТРАЦЕНТРИФУГИРОВАНИИ. На основании этого определяют коэффициент седиментации. Др. методом определения молекулярной массы является метод ГЕЛЬФИЛЬТРАЦИИ (молекулярное просеивание). 2.Способность белков связываться с ЛИГАНДАМИ. Белки способны связываться с определенными веществами. Белки специфично узнают свои ЛИГАНДЫ. ИЗБИРАТЕЛЬНОСТЬ обеспечивается белковой частью гемоглобина. Центр связывания ЛИГАНДА называется активным центром. Это свойство лежит в основе АФФИНой ХРОМОТОГРАФИи. 3.Электрохимические свойства белков. А. АМФОТЕРНОСТЬ. Белки - АМФОТЕРНЫЕ ЭЛЕКТРОЛИТЫ. Б. Буферные свойства - способность поддерживать РН среды. Наиболее мощным буфером крови является ГЕМОГЛОБИНОВЫЙ буфер, т.к. в большом количестве содержит ГИСТИДИН. B. Белки содержат заряд, который зависит от соотношения кислотных и основных групп, а оно в свою очередь зависит от их диссоциации, определяющейся РН среды. Изоэлектрическое состояние - это состояние молекулы белка, при котором её заряд равен 0. В изоэлектрическом состоянии белок менее устойчив. Это свойство белков используется при их ФРАКЦИВАНИИ: 1.ИОНООБМЕННАЯ ХРОМАТОГРАФИЯ. Для неё используется ИОНООБМЕННИКИ, которые изготавливаются из чистой целлюлозы: ДЭАЭ - целлюлоза (содержит катионные группы); КМ - целлюлоза (содержит анионные группы). 2.Разделение белков на основании величины заряда - электрофорез белков. С помощью электрофореза в сыворотке крови выделяют как минимум 5 фракций: АЛЬБУМИНЫ, альфа, альфа-2, гамма, бета - глобулины. 4. Принципы классификации белков. Характеристика простых белков. Характеристика гистонов и протаминов. Альбумины и глобулины крови, их физико-химические свойства, функции. 1 .По функции выделяют: 1. Транспортные белки (гемоглобин О2, альбумин жирные кислоты). 2. Каталитические (ферменты), 3. Регуляторные (гормоны). 4. Структурные (белки соединительной ткани, мембранные белки). 5. Защитные (антитела). 6. Сократительные (актин, миозин). 7. Рецепторные участвуют в образовании рецепторов. 2. По форме выделяют: 1. Глобулярные.
Просты́е белки́ — белки, которые построены из остатков α-аминокислот и при гидролизе распадаются только на аминокислоты. Простые белки по растворимости в воде и солевых растворах условно подразделяются на: протамины, гистоны, альбумины, глобулины, проламины, глютелины. Простые белки по растворимости и пространственному строению разделяют на глобулярные и фибриллярные. Глобулярные белки отличаются шарообразной формой молекулы, растворимы в воде. К этой группе относятся все ферменты и БАВ. Среди глобулярных белков можно выделить:
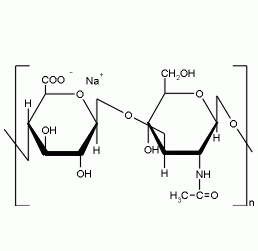
Фибриллярные белки характеризуются волокнистой структурой, практически нерастворимы в воде и солевых растворах. Полипептидные цепи в молекулах расположены параллельно одна другой. Участвуют в образовании структурных элементов соединительной ткани (коллагены, кератины, эластины). 5) Нуклеопротеины, виды Нуклеи́новая кисло́та — высокомолекулярное органическое соединение, биополимер, образованный остатками нуклеотидов. Нуклеиновые кислоты ДНК и РНК присутствуют в клетках всех живых организмов и выполняют важнейшие функции по хранению, передаче и реализации наследственной информации. Генетическая догма: информация записана в ДНК и передаётся на дочерние молекулы ДНК из поколения в поколение с помощью процесса репликации. ДНК РНК белок РЕПЛИКАЦИЯ - процесс самоудвоения ДНК Строение Полимерные формы нуклеиновых кислот называют полинуклеотидами. Цепочки из нуклеотидов соединяются через остаток фосфорной кислоты(фосфодиэфирная связь). Поскольку в нуклеотидах существует только рибоза и дезоксирибоза, то и имеется лишь дезоксирибонуклеиновая (ДНК) и рибонуклеиновая (РНК). Мономерные формы также встречаются в клетках и играют важную роль в процессах передачи сигналов или запасании энергии. Наиболее известный мономер РНК — АТФ, важнейший аккумулятор энергии в клетке.
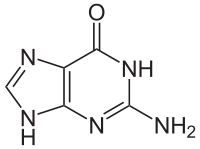 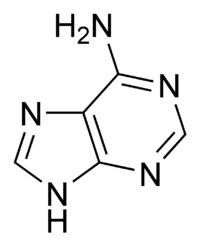 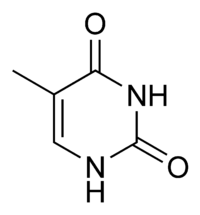 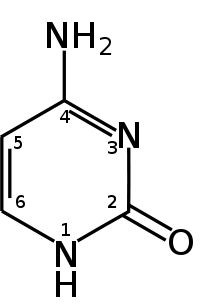 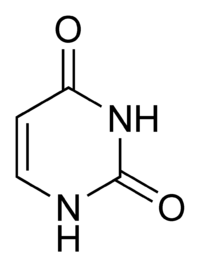 Гуанин аденин тимин цитозин урацил 6. Хромопротеины. Строение и функции гемоглобина. Типы гемоглобинов. Миоглобин. Хромопротеиды. К ним относится множество белков с металлсодержащей порфириновой простетической группой, выполняющие разнообразные функции — гемопротеины, хлорофиллы. Гемоглобин — это гемопротеин, с молекулярной массой около 60 тыс., окрашивающий эритроцит в красный цвет после связывания молекулы O2 с ионом железа (Fe++). У мужчин в 1 л крови содержится 157 (140—175) г, у женщин — 138 (123—153) г. Молекула гемоглобина состоит из четырех субъединиц гема, связанных с белковой частью молекулы — глобином, сформированной из полипептидных цепей. Главная функция гемоглобина состоит в переносе кислорода. У плода содержится фетальный гемоглобин. Соединение гемоглобина с молекулой 02 называется оксигемоглобином. Оксигемоглобин, отдавший кислород, называется дезоксигемоглобином. Гемоглобин способен связывать в тканях небольшое количество CO2 и освобождать его в лёгких. Монооксид углерода (CO) связывается с гемоглобином крови намного сильнее, чем кислород, образуя карбоксигемоглобин (HbCO). Некоторые процессы приводят к окислению иона железа в геме до степени окисления +3 и образуется метгемоглобин (HbOH). Миоглоби́н — кислород-связывающий белок скелетных мышц и мышцы сердца. Миоглобин отвечает за транспорт кислорода в скелетных мышцах и в мышце сердца. Этот факт используется для определения диагноза инфаркта миокарда по появлению специфического «сердечного» изотипа миоглобина. 7. Углевод-белковые комплексы. Строение углеводных компонентов. Гликопротеины и их протеоглиганы.
Классификация:
Это ВМС, состоящие из белка и ГАГ. Они образуют основное вещество межклеточного матрикса. В матриксе представлены крупные и малые протеогликаны. Крупные: агрекан и версикан. Агрекан - основной протеогликан хрящевого матрикса. Белковый компонент агрекана – коровый белок + ГАГ. Функции:
Синтез этих соединений состоит из этапов:
Катаболизм происходит при обновлении клеток. Коровый белок расщепляется протеиназами. Цепи ГАГ разрушаются эндо и экзогликозидазами. Расщепление необходимых фрагментов до моносахаридов осуществляется лизосомальными гидролазами 8. Липид-белковые комплексы. Строение липидных компонентов. Структурные протеолипиды и липопротеины, их функции. Протеолипиды – это белково-липидные соединения, экстрагируемые органическими растворителями из ткани мозга. Отличаются от водорастворимых липопротеинов тем, что они нерастворимы в воде. Белки, освобожденные от липидов, растворимы в воде. Наибольшее количество протеолипидов сосредоточено в миелине. Транспорт липидов кровью и лимфой осуществляется липопротеинами. Ядро состоит из гидрофобных молекул (триацилглицеролов), наружный слой содержит фосфолипиды, аполипопротеины и холестерол. 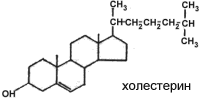 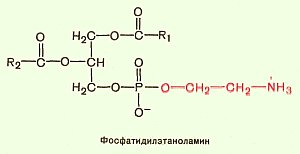
9. Ферменты, их химическая природа, структурная организация. Активный центр ферментов, его строение. Роль металлов в ферментативном катализе, примеры. Ферменты - это биологические катализаторы белковой природы. Ферменты начинают своё каталитическое действие в ЖКТ, продолжают его в тканях, на этапе выведения и образования конечных продуктов. Все реакции в организме ферментативные. 1. Повышают скорость реакции. 2. В реакциях они не расходуются. 3. Для обратимых процессов и прямая, и обратная реакция катализируется одним и тем же ферментом. ОТЛИЧИТЕЛЬНЫЕ ПРИЗНАКИ. 1 .Ферменты обладают более высокой эффективностью действия. 2.Ферменты чувствительны к температуре (ТЕРМОЛАБИЛЬНЫ) 3.Ферменты чувствительны к значениям РН среды. 4.Ферменты обладают высокой специфичностью действия. 5.Ферменты - это катализаторы с регулируемой активностью. Ферменты, как и все функциональные белки, могут быть простыми и сложными. Простые ферменты представлены только белковой частью (состоят из АК) - ПЕПСИН, ТРИПСИН, ФОСФАТАЗЫ. В структурном отношении имеют 3 уровня организации. Сложные ферменты представлены: 1 .Белковой частью (состоит из АК) - АПОФЕРМЕНТ; 2.Небелковой частью - КОФАКТОР. Выделяют 2 основных КОФАКТОРА: А. Ионы металлов (К, Na, Ca, Mg, Mn) большинство всех ферментов являются МЕТАЛЛОФЕРМЕНТАМИ. В продуктах питания должны обязательно содержаться микроэлементы. В. КОФЕРМЕНТЫ - низкомолекулярные органические вещества не белковой природы. Активный центр - это участок в молекуле фермента, где происходит связывание и превращение субстрата. АКТ. Ц обычно располагается в гидрофобном углублении , изолируя субстрат от воды. В образовании АКТ. Ц, участвуют боковые группы АК (12-20 АК), причём эти АК могут находиться на разных участках ПОЛИПЕПТИДНОЙ цепи, но при формировании пространственной конфигурации фермента они укладываются т.о., что располагаются в области активного центра. В образовании активного центра принимают участие следующие группы: NH2 (АРГ,ЛИЗ), СООН (АСП, ГЛУ), SH (ЦИС), ОН (СЕР,ТРЕ), ИМИДАЗОЛ (ГИС), ГУАНИДИНО-группа.. Контактный участок -это место в активном центре фермента, где происходит связывание субстрата с его активным центром. Контактный участок обеспечивает специфическое сродство субстрата к ферменту. Каталитический участок - место, где проходит сама каталитическая реакция. |