Экзаменационные вопросыответы на экзамен по биохимии для педиатрического факультета 2012 года
 Скачать 4.91 Mb. Скачать 4.91 Mb.
|
|
10. Коферменты и их функции в ферментативных реакциях. Витаминные коферменты. Примеры реакций с участием витаминных коферментов. КОФЕРМЕНТЫ - низкомолекулярные органические вещества не белковой природы. Они чаще всего содержат в своём составе различные витамины, следовательно, их делят на две группы: 1.Витаминные. 2.Невитаминные. 1.ТИАМИНОВЫЕ в составе витамин В1 (ТИАМИН) - ТМФ – ТИАМИНМОНОФОСФАТ, ТДФ- ТИАМИНДИФОСФАТ, ТТФ - ТИАМИНТРИФОСФАТ. ТПФ связана с ферментами ДЕКАРБОКСИЛАЗАМИ альфа КЕТОКИСЛОТ (ПВК, альфа КГК) 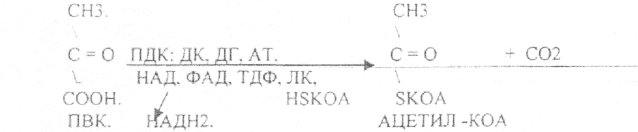 2.ФЛАВИНОВЫЕ содержат витамин В2 - ФМН – ФЛАВИНМОНОНУКЛЕОТИД, ФАД - ФЛАВИИАДЕНИНДИНУКЛЕОТИД. ФМН и ФАД связанны с ферментами ДЕГИДРОГЕНАЗАМИ. Участвуют в реакциях ДЕГИДРИРОВАНИЯ. 3. ПАНТОТЕИНОВЫЕ (витамин ВЗ) - KOF A (HS-KOA - HS КОЭНЗИМ А) - КОФЕРМЕНТ АЦИЛИРОВАНИЯ. 4. НИКОТИНАМИДНЫЕ содержат витамин РР (НИАЦИН)- НАД (НИКОТИНАМИДАДЕНИНДИНУКЛЕОТИД), НАДФ (НИКОТИНАМИДАДЕНИНДИНУКЛЕОТИДФОСФАТ). Связаны с ДЕГИДРОГЕНАЗАМИ:  5.ПИРИДОКСИНОВЫЕ содержат витамин В6. ПАФ – ПИРИДОКСАМИНОФОСФАТ, ПФ - ПИРИДОКСАЛЬФОСФАТ.: 1.Реакции ПЕРЕАМИНИРОВАНИЯ (ТРАНСАМИНИРОВАНИЕ). Связан с ферментами АМИНОТРАНСФЕРАЗАМИ. 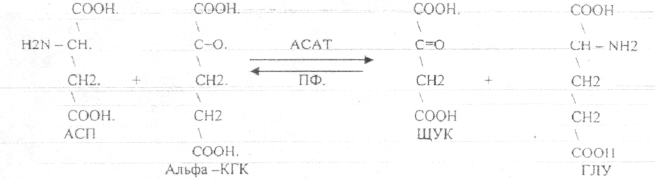 2.РЕАКЦИИ ДЕКАРБОКСИЛИРОВАНИЯ АК. 11. Номенклатура и классификация ферментов. Характеристика класса оксидоредуктаз. Примеры реакций с участием оксидоредуктаз 1. ОКСИДОРЕДУКТАЗЫ. 2. ТРАНСФЕРАЗЫ. 3. ГИДРОЛАЗЫ. 4. ЛИАЗЫ. 5. ИЗОМЕРАЗЫ. 6. ЛИГАЗЫ. Каждый класс делится на подклассы. Подклассы делятся на ПОДПОДКЛАССЫ. 1 .ОКСИДОРЕДУКТАЗЫ. Ферменты этого класса участвуют в ОВР. Это наиболее многочисленный класс ферментов (более 400 ОКСИДОРЕДУКТАЗ). 1.АЭРОБНЫЕ ДЕГИДРОГЕНАЗЫ. Они участвуют в реакциях ДЕГИДРИРОВАНИЯ. Некоторые АЭРОБНЫЕ ДЕГИДРОГЕНАЗЫ называют ОКСИДАЗАМИ. Например, ОКСИДАЗЫ АК. 2.АНАЭРОБНЫЕ ДГ. Эти ферменты также участвуют в реакциях ДЕГИДРИРОВАНИЯ, т.е. отнятия Н2 от окисляемого субстрата и транспортировка его на любой др. субстрат, кроме О2. 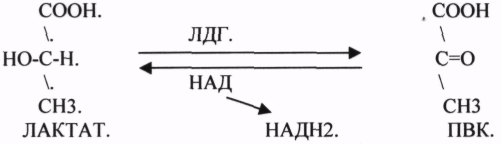  3.ПЕРОКСИДАЗЫ. Ферменты, которые отнимают Н2 от окисляемого субстрата и транспортируют его на ПЕРОКСИД. 4.ЦИТОХРОМЫ. Они содержат в своем составе ГЕМ. ЦИТОХРОМЫ участвуют в транспорте только электронов. 13. Характеристика класса лиаз, изомераз и лигаз (синтетаз), примеры реакций. Лиазы. 1 .ДЕКАРБОКСИЛАЗЫ участвуют в реакциях ДЕКАРБКСИЛИРОВАНИЯ. 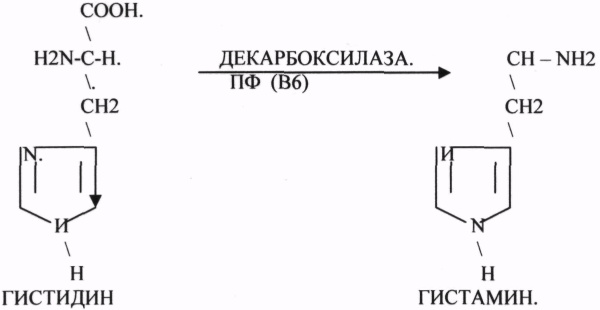 2.Ферменты, разрывающие связи между атомами углеводов не ГИДРОЛИТИЧЕСКИМ путём без участия воды (АЛЬДОЛАЗА). 3.Ферменты, участвующие в реакциях ГИДРАТАЦИИ и ДЕГИДРАТАЦИИ. 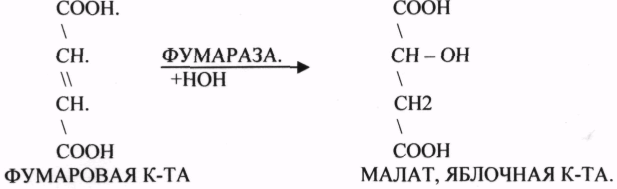 ИЗОМЕРАЗЫ. Ферменты этого класса участвуют в ИЗОМЕРИЧЕСКИХ превращениях. При этом один структурный изомер может превращаться в другой, за счёт внутри молекулярной перегруппировки атомов. 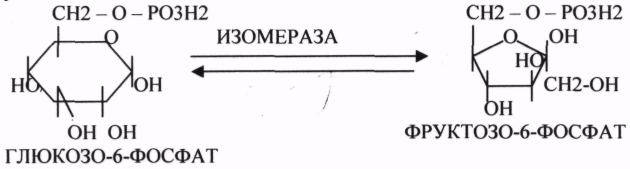 ЛИГАЗЫ. Ферменты этого класса участвуют в реакциях соединения двух и более простых веществ с образованием нового вещества. Эти реакции требуют затрат энергии извне в виде АТФ. 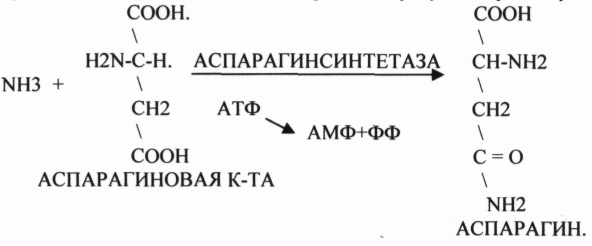 12. Характеристика классов ферментов трансфераз и гидролаз. Примеры реакций с участием данных ферментов. ТРАНСФЕРАЗЫ. Ферменты этого класса участвуют в транспорте атомных групп от донора к ацептору. В зависимости от переносимых групп, ТРАНСФЕРАЗЫ делятся на несколько подклассов: 1.АМИНОТРАНСФЕРАЗЫ. Они участвуют в реакциях ПЕРЕАМИНИРОВАНИЯ. 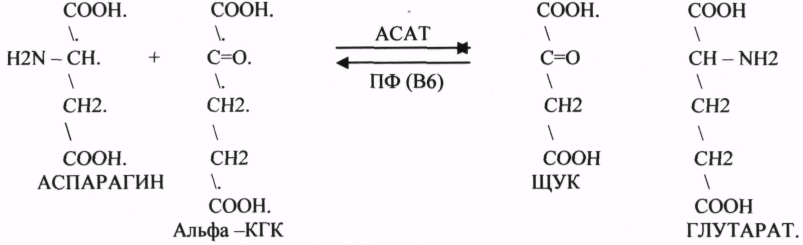 АСАТ - АСПАРАГИНОВАЯ АМИНОТРАНСФЕРАЗА. 2.МЕТИЛТРАНСФЕРАЗЫ (СНЗ группы). 3.ФОСФОТРАНСФЕРАЗЫ (ФОСФАТНЫЕ группировки). 4.АЦИЛТРАНСФЕРАЗЫ (кислотные остатки). ГИДРОЛАЗЫ. Ферменты этого класса участвуют в реакциях разрыва связей в молекулах субстратов при участии воды. 1.ЭСТЕР АЗЫ действуют на СЛОЖНО-ЭФИРНЫЕ связи. К ним относятся ЛИПАЗЫ, ФОСФОЛИПАЗЫ, ХОЛЕСТЕРАЗЫ. 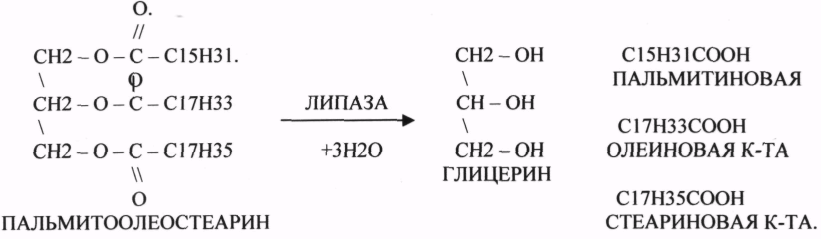 2.ГЛИКОЗИДАЗЫ - действует на ГЛИКОЗИДНУЮ связь, находящуюся в сложных углеводах. К ним относятся АМИЛАЗА, САХАРАЗА, МАЛЬТАЗА, ГЛИКОЗИДАЗЫ, ЛАКТАЗА. 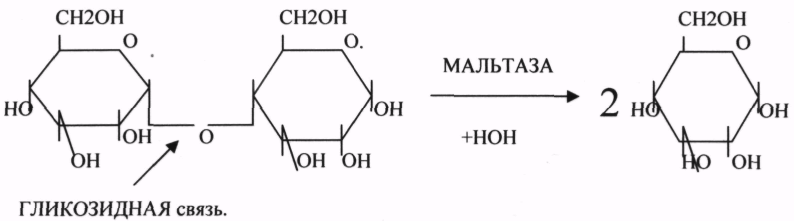 3.ПЕПТИДАЗЫ участвуют в разрыве ПЕПТИДНЫХ связей в белках. К ним относятся ПЕПСИН, ХИМОТРИПСИН, АМИНОПЕПТИДАЗА, КАРБОКСИПЕПТИДАЗА и т.д. 14. Современные представления о механизме действия ферментов. Стадии ферментативной реакции, молекулярные эффекты, примеры. МЕХАНИЗМ ДЕЙСТВИЯ ФЕРМЕНТОВ. С термодинамической точки зрения, действие любого фермента направлено на понижение энергии активации. Чем ниже энергия активации, тем выше скорость реакции. Теория действия ферментов была предложена БЕЙЛИСОМ и ВАНБУРГОМ. Согласно ей, фермент представляет собой "губку", которая адсорбирует на своей поверхности молекулы реагирующих веществ. Она как бы стабилизирует их, способствует взаимодействию. 70 лет назад была предложена др. теория МИХАЭЛИСОМ и МЕНТЕНОМ. Они выдвинули понятие о F-S комплексе. Фермент взаимодействует с субстратом, образуя нестойкий промежуточный F-S комплекс, который затем распадается с образованием продуктов реакции (Р) и освобождением фермента. В этом процессе выделяют несколько стадий: 1.Диффузия S к F и их СТЕРИЧЕСКОЕ взаимодействие с образованием F-S комплекса. Эта стадия не продолжительна. На этой стадии практически не происходит понижения энергии активации. 2.Преобразование F-S комплекса в один или несколько активированных комплексов. Эта стадия является наиболее продолжительна. При этом происходит разрыв связей в молекуле субстрата, образование новых связей. Е активации 3.Освобождение продуктов реакции от фермента и поступление их в окружающую среду. МОЛЕКУЛЯРНЫЕ ЭФФЕКТЫ ФЕРМЕНТАТИВНОГО ДЕЙСТВИЯ. 1. Эффект концентрации. Поэтому основная роль ферментов заключается в притяжении молекул реагирующих веществ на свою поверхность и концентрация этих молекул в области активного центра фермента. 2. Эффект, сближения и ориентации. Контактные участки активного центра фермента связывают специфически молекулы субстрата, сближают их и обеспечивают ориентацию так, чтобы это было выгодно для действия каталитических групп фермента. 3. Эффект натяжения ("дыбы"). До присоединения субстрата к активному центру фермента его молекула в расслабленном состоянии. После связывания молекула субстрата растягивается и принимает напряжённую деформированную конфигурацию. Понижается Е активации. 4. Кислотно-основной катализ. Группы кислотного типа отщепляют Н+ и имеют отрицательный заряд. Группы основного типа присоединяют Н+ и имеют положительный заряд. Это приводит к понижению энергии активации. 5.Эффект индуцированного соответствия. Он объясняет специфичность действия ферментов. По этому поводу имеется 2 точки зрения: А). Гипотеза ФИШЕРА. Согласно ей имеется строгое СТЕРИЧЕСКОЕ соответствие субстрата и активного центра фермента. В). Теория индуцированного соответствия КОШЛЕНДА. Согласно ей молекула фермента - это гибкая структура. После связывания фермента с субстратом, изменяется КОНФОРМАЦИЯактивного центра фермента и всей молекулы субстрата. Они находятся в состоянии индуцированного соответствия. Это происходит в момент взаимодействия. 15. Ингибирование ферментов. Конкурентное и неконкурентное ингибирование, примеры реакций. Лекарственные вещества как ингибиторы ферментов. ИНГИБИТОРЫ. Ферменты - это катализаторы с регулируемой активностью. Ею можно управлять с помощью различных веществ. Действие фермента можно ИНГИБИРОВАТЬ определёнными химическими веществами- ИНГИБИТОРАМИ. По характеру действия ингибиторы делятся на 2 большие группы: 1.Обратимые - это соединения, которые НЕКОВАЛЕНТНО взаимодействуют с ферментом, при этом образуется комплекс, способный к диссоциации. 2.Необратимые - это соединения, которые могут специфически связывать определенные функциональные группы активного центра фермента. Они образуют с ним прочные КОВАЛЕНТНЫЕ связи, поэтому такой комплекс трудно разрушить. ВИДЫ ИНГИБИРОВАНИЯ. По механизму действия выделяют следующие виды ИНГИБИРОВАНИЯ: 1. Конкурентное ингибирование - торможение ферментативной реакции, вызванное действием ингибиторов, структура которого очень близка к структуре S, поэтому и S, и ингибитор конкурируют за АЦ Ф. и связывается с ним то соединение. концентрация которого в окружающей среде больше. E+S — ES—EP Многие лекарственные препараты действуют по типу конкурентного ингибитора. Примером является применение СУЛЬФАНИЛА (СА). При различных инфекционных заболеваниях, которые вызываются бактериями, применяются СА препараты. Введение СА приводит к ИНГИБИРОВАНИЮ фермента бактерий, которые синтезируют ФОЛИЕВУЮ кислоту. Нарушение синтеза этой кислоты проводит к нарушению роста микроорганизмов и их гибели. 2.НЕКОНКУРЕНТНОЕ ИНГИБИРОВАНИЕ -ингибитор и субстрат не имеют структурного сходства; ингибитор не влияет на образование F-S-комплекса; образуется тройной ESI -комплекс. Такие ингибиторы влияют на каталитическое превращение субстрата. Они могут связываются как непосредственно с каталитическими группами AЦ Ф, так и вне АЦ Ф. Но в любом случае они влияют на конформацию активного центра. В качестве неконкурентного ингибитора выступают ЦИАНИДЫ. Они прочно связываются с ионами железа ЦИТОХРОМОКСИДАЗЫ. Этот фермент является одним из компонентов дыхательной цепи. Блокирование дыхательной цепи приводит к мгновенной гибели организме. Действие можно снять только с помощью РЕАКТИВАТОРОВ. 3.СУБСТРАТНОЕ ИНГИБИРОВАНИЕ - это торможение ферментативной реакции, вызванное избытком субстрата. При этом образуется F-S комплекс, но он не подвергается каталитическим превращениям, т.к. делает молекулу фермента неактивной. Действие субстратного ингибитора снимается путём уменьшения концентрации субстрата. 4.АЛЛОСТЕРИЧЕСКОЕ ИНГИБИРОВАНИЕ. АЛЛОСТЕРИЧЕСКИЕ ферменты могут иметь 2 и более единиц протомеров. При этом одна имеет каталитический центр и называется каталитической, а другая - АЛЛОСТЕРИЧЕСКИЙ центр и называется регуляторной. В отсутствии АЛЛОСТЕРИЧЕСКОГО ИНГИБИТОРА субстрат присоединяется к каталитическому центру, и идёт обычная каталитическая реакция. При появлении АЛЛОСТЕРИЧЕСКОГО ИНГИБИТОРА, он присоединяется к регуляторной единице и изменяет КОНФОРМАЦИЮ центра фермента, в результате этого активность фермента снижается. 16.Регуляция активности ферментов: белок – белковые взаимодействия, частичный протеолиз, фосфорилирование, дефосфорилирование, аллостерическая регуляция. Аллостерическая регуляци.Аллостерическими ферментами называют ферменты, активность которых регулируется не только количеством молекул субстрата, но и другими веществами, называемыми эффекторами. Участвующие в аллостерической регуляции эффекторы – клеточные метаболиты часто именно того пути, регуляцию которого они осуществляют.Роль аллостерических ферментов в метаболизме клетки. Аллостерические ферменты играют важную роль в метаболизме, так как они чрезвычайно быстро реагируют на малейшие изменения внутреннего состояния клетки. Аллостерическая регуляция имеет большое значение в следующих ситуациях:при анаболических процессах. Ингибирование конечным продуктом метаболического пути и активация начальными метаболитами позволяют осуществлять регуляцию синтеза этих соединений;при катаболических процессах. В случае накопления АТФ в клетке происходит ингибирование метаболических путей, обеспечивающих синтез энергии. Субстраты при этом расходуются на реакции запасания резервных питательных веществ;для координации анаболических и катаболических путей. АТФ и АДФ – аллостерические эффекторы, действующие как антагонисты;для координации параллельно протекающих и взаимосвязанных метаболических путей (например, синтез пуриновых и пиримидиновых нуклеотидов, используемых для синтеза нуклеиновых кислот). Таким образом, конечные продукты одного метаболического пути могут быть аллостерическими эффекторами другого метаболического пути.Особенности строения и функционирования аллостерических ферментов:обычно это олигомерные белки, состоящие из нескольких протомеров или имеющие доменное строение;они имеют аллостерический центр, пространственно удалённый от каталитического активного центра;эффекторы присоединяются к ферменту нековалентно в аллостерических (регуляторных) центрах;аллостерические центры, так же, как и каталитические, могут проявлять различную специфичность по отношению к лигандам: она может быть абсолютной и групповой. Некот. ферменты имеют несколько аллостерических центров, одни из которых специфичны к активаторам, другие – к ингибиторам;протомер, на котором находится аллостерический центр, - регуляторный протомер, в отличие от каталитического протомера, содержащего активный центр, в котором проходит химическая реакция;аллостерические ферменты обладают свойством кооперативности: взаимодействие аллостерического эффектора с аллостерическим центром вызывает последовательное кооперативное изменение конформации всех субъединиц, приводящее к изменению конформации активного центра и изменению сродства фермента к субстрату, что снижает или увеличивает каталитическую активность фермента;регуляция аллостерических ферментов обратима: отсоединение эффектора от регуляторной субъединицы восстанавливает исходную каталитическую активность фермента;аллостерические ферменты катализируют ключевые реакции данного метаболического пути.Регуляция каталитической активности ферментов белок-белковыми взаимодействиями.Некот. ферменты изменяют свою каталитическую активность в результате белок-белковых взаимодействий. Различают 2 механизма активации ферментов с помощью белок-белковых взаимодействий:активация ферментов в результате присоединения регуляторных белков;изменение каталитической активности ферментов вследствие ассоциации или диссоциации протомеров фермента.Регуляция каталитической активности ферментов путём фосфорилирования/дефосфорилирования.В биологических системах часто встречается механизм регуляции активности ферментов с помощью ковалентной модификации аминокислотных остатков. Быстрый и широко распространённый способ химической модификации ферментов – фосфорилирование/дефосфорилирование. Модификации подвергаются ОН-группы фермента. Фосфорилирование осуществляется ферментами протеинкиназами, а дефосфорилирование – фосфопротеинфосфатазами. Присоединение остатка фосфорной кислоты приводит к изменению конформации активного центра и его каталитической активности. При этом результат может быть двояким: одни ферменты при фосфорилировании активируются, другие, напротив, становятся менее активными.Регуляция каталитической активности ферментов частичным (ограниченным) протеолизом.Некот. ферменты, функционирующие вне клеток (в ЖКТ или в плазме крови), синтезируются в виде неактивных предшественников и активируются только в результате гидролиза одной или нескольких определённых пептидных связей, что приводит к отщеплению части белковой молекулы предшественника. В результате в оставшейся части белковой молекулы происходит конформационная перестройка и формируется активный центр фермента (трипсиноген – трипсин). 17. Обмен веществ и энергии. Этапы обмена веществ. Общий путь катаболизма. Катаболизм пирувата. Обмен веществ - необходимое условие жизни. Обмен веществ всегда связан с обменом энергии. Выделяют закрытые и открытые системы. Обмен веществ - это процессы взаимоотношения организма с внешней средой, представляющие совокупность химических реакций, которым подвергаются различные вещества с момента их поступления в организм до момента их выделения в виде конечных продуктов. Основные компоненты живых систем - белки, жиры, углеводы. В организм человека должно поступать: Белков - 100 г. в сутки, Жиров - 100 г. в сутки, Углеводов - 400 г. в сутки. За сутки при обмене этих веществ образуется 2000-3000 ккал энергии. ЭТАПЫ ОБМЕНА ВЕЩЕСТВ. 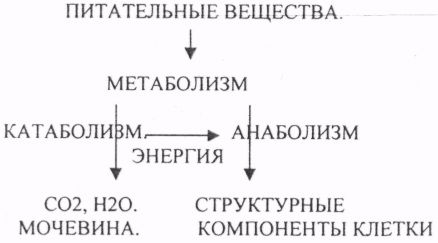 1.Поступление веществ из внешней среды посредством питания и дыхания. 2.Превращение веществ в организме - МЕЖУТОЧНЫЙ обмен 3.Выделение конечных продуктов. 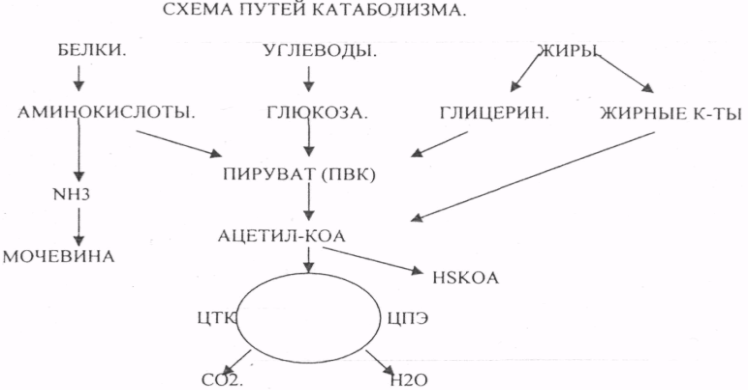 Распад БЖУ до ПИРУВАТА идёт индивидуально для каждой группы органических соединений и носит название специфического пути катаболизма. С образованием ПИРУВАТА начинается общий путь катаболизма, идентичный для обмена всех питательных веществ. 18.Современные представления о биологическом окислении. Компоненты дыхательной цепи и их характеристика В цикле КРЕБСА АЦЕТИЛ-КОА распадается до СО2 с образованием восстановленных КОФЕРМЕНТОВ - НАДН  АТФ в реакции не участвует, а используется энергия макроэргической связи АЦЕТИЛ-КОА ЦИТРИЛ-КОА не устойчив и очень быстро распадается под влиянием воды.  Цитрат превращается в свой изомер (ИЗОЦИТРАТ) под влиянием фермента АКОНИТАЗЫ.  ИЗОЦИТРАТ подвергается далее ДЕГИДРИРОВАНИЮ под влиянием -ИЗОЦИТРАТДЕГИДРОГЕНАЗЫ.  ЩЯВЕЛЕВО-ЯНТАРНАЯ К-ТА подвергается прямому ДЕКАРБОКСИЛИРОВАНИЮ.  -КГК подвергается реакции ОКИСЛИТЕЛЬНОГО ДЕКАРБОКСИЛИРОВАНИЯ, катализируемой комплексом ферментов (КЕТОГЛУТАРАТДЕГИДРОГЕНАЗНЫЙ комплекс), включающий 3 фермента и 5 КОФЕРМЕНТОВ.  СУКЦИНИЛ-КОА подвергается реакции субстратного ФОСФОРИЛИРОВАНИЯ.   Т.о. происходит распад АЦЕТИЛ-КОА до СО2 и восстановленного HSKOA. ФУНКЦИИ ЦТК. 1.Катаболическая - распад АЦЕТИЛА. 2.Анаболическая. Компоненты ЦТК могут использоваться для синтеза др. соединений. ЩУК - синтез АСП. 3.Интегративная. Взаимосвязь обмена БЖУ. 4.Энергетическая. Образование 1 молекулы АТФ. Если ЦТК работает вместе с дыхательной цепью, то образуется ещё 1 АТФ. 5.ВОДОРОДГЕНЕРИРУЮЩАЯ - в результате ЦТК образуется 3 молекулы НАДН2 и 1 молекула ФАДН2. Они транспортируются в ЦТЭ. |
