Экзаменационные вопросыответы на экзамен по биохимии для педиатрического факультета 2012 года
 Скачать 4.91 Mb. Скачать 4.91 Mb.
|
|
19)Молекулярные механизмы окислительного фосфорилирования (теория Митчелла). МЕХАНИЗМ ОКИСЛИТЕЛЬНОГО ФОСФОРИЛИРОВАНИЯ.Теория ОКИСЛИТЕЛЬНОГО ФОСФОРИЛИРОВАНИЯ выдвинута английским учёным П. МИТЧЕЛОМ в 1961 г. и названа ХЕМИООСМОТИЧЕСКОЙ ТЕОРИЕЙ ОКИСЛИТЕЛЬНОГО ФОСФОРИЛИРОВАНИЯ. Он объяснил процесс синтеза АТФ с биохимической позиции, но его взгляды не получили признания. Однако в последующем его теория подтвердилась, и через 17 лет он был удостоен Нобелевской премии.Основные положения теории:1.Мембрана МИТОХОНДРИЙ не проницаема для протонов.2.Образуется протонный потенциал в процессе транспорта электронов и протонов.3.Обратный транспорт протонов в МАТРИКС сопряжен с образованием АТФ.Процесс транспорта электронов происходит во внутренней мембране. Первые реакции окисления происходят в матрице. Протоны переносятся в межмембранное пространство, а электроны продвигаются по дыхательной цепи. В процессе работы дыхательной цепи внутренняя мембрана со стороны матрицы заряжается отрицательно, а со стороны межмембранного пространства положительно. Следовательно, возникает разность потенциалов, градиент концентрации ионов, и, соответственно, градиент РН. Т.о. РН со стороны матрицы будет менее кислая. Во время дыхания создаётся ЭЛЕКТРО-ХИМИЧЕСКИЙ градиент: концентрационный и разности потенциалов. Электрический и концентрационный градиент составляет ПРОТОНДВИЖУЩУЮ силу, которая даёт силу для синтеза АТФ. На определённых участках внутренней мембраны есть протонные каналы, образованные АТФ-СИНТЕТАЗОЙ. Протоны могут проходить обратно в матрицу, при этом образующаяся энергия идёт на синтез АТФ.УСЛОВИЯ ОБРАЗОВАНИЯ АТФ.1. Целостность мембраны - непроницаемость её для протонов.2. Наличие специальных каналов.3. Движение протонов в матрицу сопровождается выделением энергии, используемой для синтеза АТФ.Вопрос о том, что позволяет протонам переходить в межмембранное пространство остаётся не вполне ясным.Основные компоненты ЭТЦ представляют собой интегральные белки и фиксированные в мембране: 1.НАДН-ДГ.2.QН2-ДГ.3.ЦИТОХРОМОКСИДАЗА.4.KOQ не связан с белками.5.ЦИТОХРОМ с - не фиксирован к мембране.Выдвигается теория Q-цикла транспорта протонов.2Н + 2е + KOQ KOQ*H2 KOQ*H2 KOQ + 2Н + 2е - на наружной поверхности внутренней мембраны.Т.о. в соответствии с ХЕМООСМОТИЧЕСКОЙ теорией МИТЧЕЛА окисление НАДН2 и ФАДН2 в дыхательной цепи создаёт сначала ЭЛЕКТРОНО-ХИМИЧЕСКИЙ протонный потенциал, градиент концентрации ионов на внутренней мембране, а обратный транспорт протонов через мембрану сопряжен с ФОСФОРИЛИРОВАНИЕМ, т.е. образованием АТФ. 21.Роль белков в питании. Превращение белков в органах пищеварительной системы. Роль соляной кислоты в переваривании белков. Характеристика протеолитических ферментов желудочного и кишечного соков. В нашем организме идёт постоянный синтез и распад белков. Ежесуточно распадается 400гр. белка и столько же синтезируется. Из общей массы организма белка приходится 15кг. Синтез обновленного белка происходит из аминокислот, которые образуются при распаде. Все АК можно разделить на 4 группы: 1 .Заменимые - синтезируются в организме: АЛА, АСП, АСН, ГЛУ, ГЛН, ГЛИ, ПРО, СЕР. 2.Незаменимые - не синтезируются в организме и поступают с пищей: ВАЛ, ЛЕЙ, ИЛЕ. ЛИЗ. ТРЕ, МЕТ, ФЕН, ТРИ. 3.Частично заменимые - синтезируются в организме, но очень медленно и не покрывают всех потребностей организма: ГИС, АРГ. 4.Условно заменимые - синтезируются из незаменимых аминокислот: ЦИС (МЕТ), ТИР (ФЕН). Полноценность белкового питания определяется: 1. Наличием всех незаменимых аминокислот. Отсутствие даже одной незаменимой аминокислоты нарушает биосинтез белка, т.е. каждая незаменимая АК может быть лимитирующей в процессе синтеза белка. 2. Аминокислотным составом белка. Все АК могут содержаться в продуктах как животного, так и растительного происхождения. Суточная потребность человека в белках составляет 100гр. БЕЛКИ, ИХ БИОЛОГИЧЕСКАЯ РОЛЬ. Белки - это высокомолекулярные азотсодержащие органические вещества, состоящие из АК. соединённых ПЕПТИДНЫМИ связями в ПОЛИПЕПТИДНУЮ цепь, и имеющие сложную структурную организацию. Роль в питании:
Пищевые белки подвергаются гидролитическому расщеплению под действием ПРОТЕОЛИТИЧЕСКИХ ФЕРМЕНТОВ (ПЕПТИДАЗЫ). Большинство этих ферментов вырабатывается в неактивной форме, а затем активируется путём ЧАСТИЧНОГО ПРОТЕОЛиЗА. Это предохраняет стенки органов ЖКТ от самопереваривания. Поверхность желудка и кишечника покрыта слизью, в составе которой содержатся ГЕТЕРОПОЛИСАХАРИДЫ. Проферменты вырабатываются слизистой желудка или кишечника и поступают в полость этих органов, где происходит их активация. В пристеночном слое вырабатываются БИКАРБОНАТЫ, которые создают среду близкую к нейтральной (рН=5-6). В ротовой полости происходит лишь механическая переработка пищи. В желудке начинается химическое превращение белков. Здесь действуют два основных фермента: ПЕПСИН и ГАСТРИКСИН. ПЕПСИН вырабатывается главными клетками слизистой желудка в неактивной форме -ПЕПСИНОГЕН, который под действием соляной кислоты активируется и превращается в пепсин. Процесс активации является АУТОКАТАЛИТИЧЕСКИМ путём ЧАСТИЧНОГО ПРОТЕОЛИЗА. Соляная кислота вырабатывается обкладочными клетками слизистой желудка и играет очень важную роль в переваривании белков: -активирует ПЕПСИНОГЕН, превращая его в пепсин, - создаёт оптимум рН для действия пепсина (1,5 - 2), -обладает бактерицидным действием, -денатурирует белки, которые потом гидролизуются. Внутренние ПЕПТИДНЫЕ связи становятся доступными для действия пепсина, способствует продвижению желудочного содержимого далее в кишечник. Пепсин - это фермент, который является ЭНДОПЕПТИДАЗОЙ, т.е. действует на внутренние ПЕПТИДНЫЕ связи, в образовании которых участвуют ароматические аминокислоты (ФЕН, ТИР, ТРИ) своими АМИДНЫМИ группами. ГАСТРИКСИН по действию аналогичен пепсину. Это тоже ЭНДОПЕПТИДАЗА. Его оптимум рН = 3 - 3,5. Действует на ПЕПТИДНЫЕ связи. В желудке под действием ПЕПСИНА и ГАСТРИКСИНА сложные белковые молекулы распадаются на высокомолекулярные ПОЛИПЕПТИДЫ. Ими являются так называемые АЛЬБУМОЗЫ, ПЕПТОНЫ, которые поступают в тонкий кишечник. В тонком кишечнике эти ПОЛИПЕПТИДЫ подвергаются действию целого ряда протеолитических ферментов ПЖЖ: ТРИПСИНОГЕН, ХИМОТРИПСИНОГЕН, ПРОЭЛАСТАЗА, ПРОКАРБОКСИПЕПТИДАЗА. Механизм активации всех этих ферментов - ЧАСТИЧНЫЙ ПРОТЕОЛИЗ по каскадному механизму. 22. Гниение белков и аминокислот в кишечнике. Примеры реакций дезаминирования, декарбоксили-рования, десульфирования. Распад углеводородных цепей на примере тирозина и триптофана Механизм активации всех этих ферментов - ЧАСТИЧНЫЙ ПРОТЕОЛИЗ по каскадному механизму. 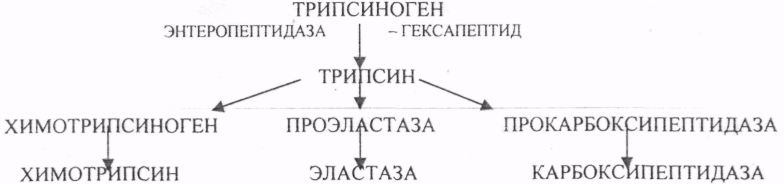 ТРИПСИН, ХИМОТРИПСИН, ЭЛАСТАЗА - ЭНДОПЕПТИДАЗЫ. ТРИПСИН разрушает внутренние ПЕПТИДНЫЕ связи, в образовании которых принимают участие ЛИЗ и АРГ. ХИМОТРИПСИН разрушает внутренние связи, в образовании которых принимают участие ароматические аминокислоты (ТИР, ТРИ, ФЕН). ЭЛАСТАЗА разрушает внутренние ПЕПТИДНЫЕ связи, в образовании которых принимают участие АЛА, ГЛИ, ПРО, ЦИС. В результате действия ПЕПСИНА, ХИМОТРИПСИНА и ЭЛАСТАЗЫ высокомолекулярные ПЕПТИДЫ расщепляются до низкомолекулярных, которые подвергаются действию ЭКЗОПЕПТИДАЗ, действующих на крайние связи, отщепляя отдельные концевые аминокислоты. КАРБОКСИПЕПТИДАЗА разрушает крайние связи, отщепляя аминокислоты с С-конца. АМИНОПЕПТИДАЗА действует на крайние ПЕПТИДНЫЕ связи со стороны N-конца, отщепляя отдельные аминокислоты. ДИПЕПТИДЫ подвергаются действию ДИПЕПТИДАЗ, продуцирующихся слизистой кишечника сразу в активной форме. Т.о. в результате действия всей этой группы ферментов в ЖКТ белки пищи расщепляются до аминокислот. Образующиеся аминокислоты всасываются стенкой кишечника в кровь и поступают во все органы и ткани. Не всосавшиеся аминокислоты поступают в толстую кишку, где подвергаются процессам гниения. Это процесс бактериального распада веществ под действием микрофлоры или ферментов, вырабатывающихся этой микрофлорой. В норме в толстой кишке подвергаются аминокислоты, а при патологии - белки. Это происходит и в других отделах ЖКТ: в желудке (при понижении кислотности), ротовой полости (при кариесе). 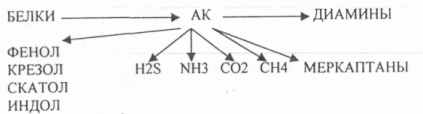 Не всосавшиеся аминокислоты поступают в толстую кишку, где подвергаются процессам гниения. Это процесс бактериального распада веществ под действием микрофлоры иди ферментов, вырабатывающихся этой микрофлорой, В норме в толстой кишке подвергаются аминокислоты, а при патологии - белки. Это происходит и в других отделах ЖКТ. 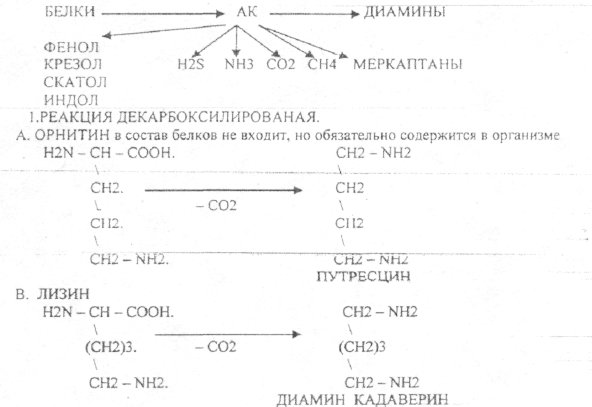 ПУТРЕСЦИН и КАДАВЕРИН являются токсическими веществами, входят в состав трупных ядов. 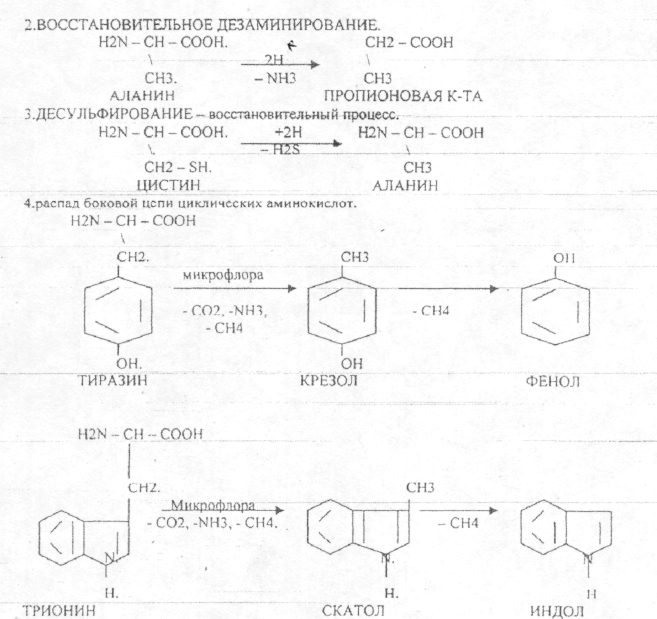 23. Переаминирование и декарбоксилирование аминокислот. Химизм процессов, характеристика ферментов и коферментов. Образование амидов. 1). Основной путь превращения аминокислот в тканях - это реакции ПЕРЕАМИНИРОВАНИЯ -реакции между АМИНО- и КЕТОКИСЛОТАМИ. Эти реакции катализирует фермент - АМИНОТРАНСФЕРАЗА. ТРАНСАМИНИРОВАНИЮ могут подвергаться все аминокислоты кроме ЛИЗ и ТРЕ. Наибольшее значение имеют AT, донорами аминогрупп которых являются АЛА, АСП, ГЛУ. 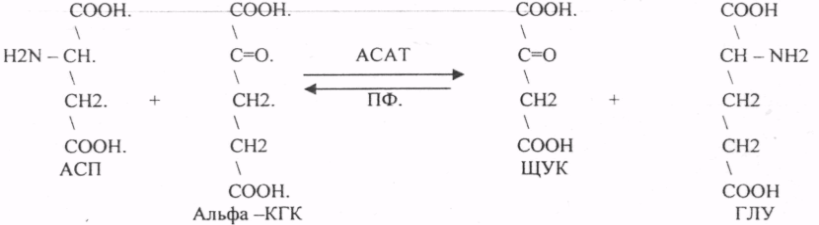 Роль реакций ТРАНСАМИНИРОВАНИЯ: 1. используются для синтеза заменимых аминокислот. 2. Является начальным этапом катаболизма аминокислот 3. В результате ТРАНСАМИНИРОВАНИЯ образуются альфа -КЕТОКИСЛОТЫ, которые включаются в гЛЮКОНЕОГЕНЕЗ. 4. Протекают в разных тканях, но более всего в печени. Определение активности AT имеет диагностическое значение в клинике. При избытке АЛАНИНА или недостатке АСПАРАГИНОВОЙ К-ТЫ: 1. АЛА + альфа-КГК ↔ ГЛУ + ПВК 2. ГЛУ + ЩУК ↔АСП + альфа-КГК 2).Реакции ДЕКАРБОКСИЛИРОВАНИЯ - разрушение СООН-группы с выделением СО2. При этом аминокислоты в тканях образуют биогенные амины, которые являются биологически активными веществами (БАВ): 1. НЕЙРОМЕДИАТОРОВ (СЕРЕТОНИН, ДОФАМИН, ГАМК), 2. Гормоны (АДРЕНАЛИН, НОРАДРЕНАЛИН), 3. Регуляторы местного действия ( ГИСТАМИН). 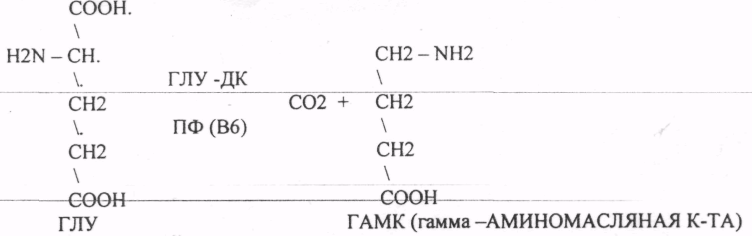 ГАМК является НЕИРОМЕДИАТОРОМ тормозного действия. ДОФАМИН является НЕИРОМЕДИАТОРОМ возбуждающего действия. Он является основой для синтеза АДРЕНАЛИНА и НОР АДРЕНАЛИНА. 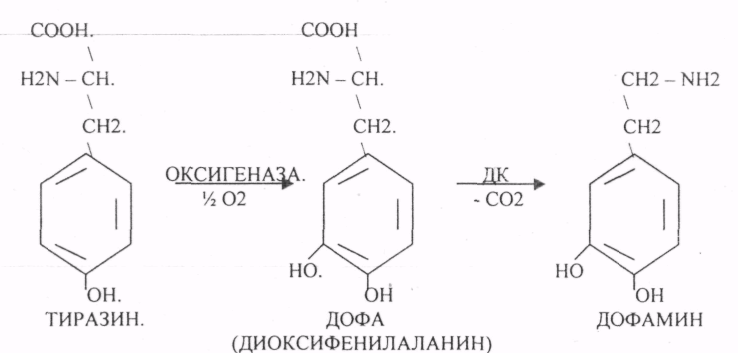 ГИСТАМИН повышает секрецию желудочного сока, поэтому применяется в клинической практике при зондировании. Обладает сосудорасширяющим действием, понижает АД. 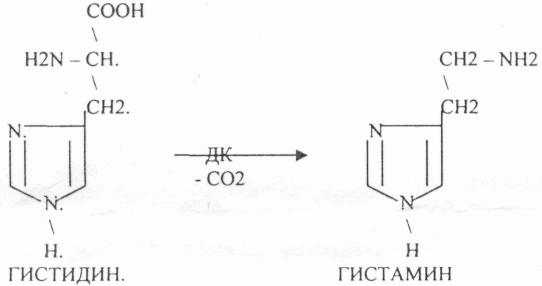 24. Дезаминирование аминокислот. Виды дезаминирования. Окислительное дезаминирование. Непрямое дезаминирование аминокислот на примере тирозина. ДЕЗАМИНИРОВАНИе - разрушение NН2-группы с выделением аммиака. В организме возможны следующие виды: 1. Восстановительное 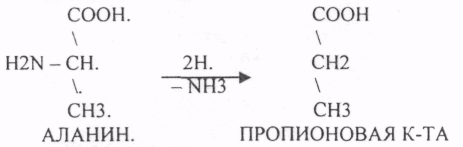 2.ГИДРОЛИТЙЧЕСКОЕ: 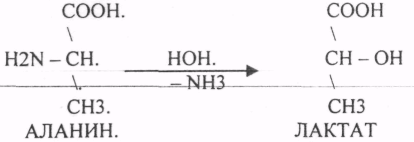 3. Внутримолекулярное: 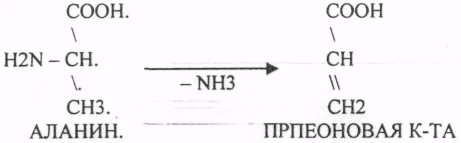 Эти три вида ДЕЗАМИНИРОВАНИЯ имеют место при гниении. 4. Окислительное. ОКИСЛИТЕЛЬНОМУ ДЕЗАМИНИРОВАНИЮ подвергается только ГЛУ. 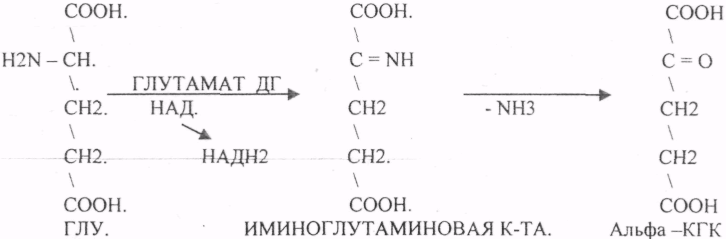 ОКИСЛИТЕЛЬНОМУ ДЕЗАМИНИРОВАНИЮ подвергаются и другие аминокислоты, но этот путь является непрямым. Он идёт через ГЛУ и называется процессом НЕПРЯМОГО ОКИСЛИТЕЛЬНОГО ДЕЗАМИНИРОВАНИЯ. 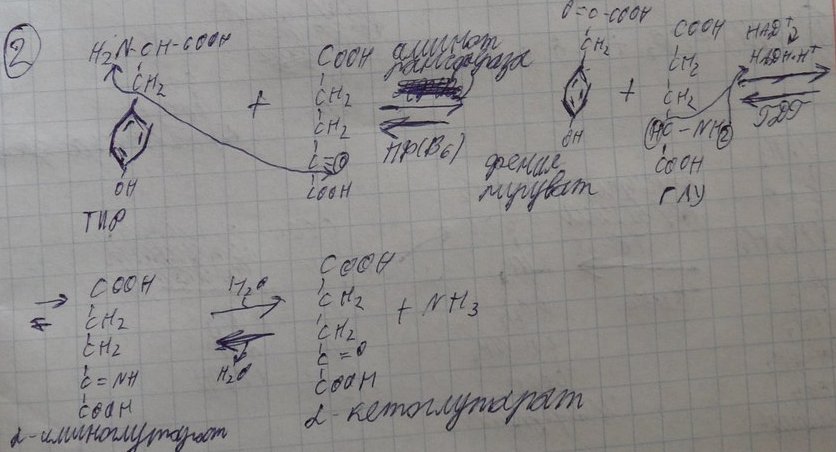 25. Синтез мочевины (орнитиновый цикл), последовательность реакций. Биологическая роль. Синтез мочевины - основной путь обезвреживания аммиака - ОРНИТИНОВЫЙ ЦИКЛ. КАРБОМОИЛФОСФАТ 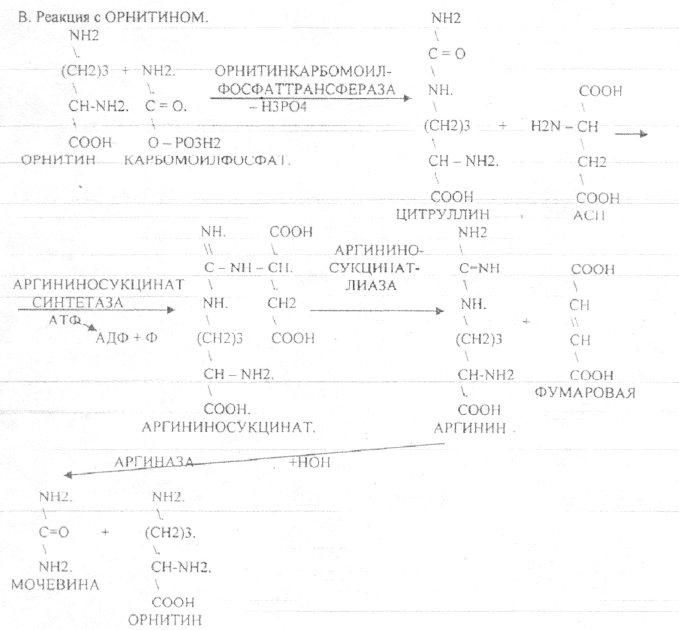 Образование мочевины идёт только в печени. Две первые реакции цикла (образование ЦИТРУЛЛИНА и АРГИНИНОСУКЦИНАТА) идут в МИТОХОНДРИЯХ, остальные в цитоплазме. В организме в сутки образуется 25гр мочевины. Этот показатель характеризует мочевино- образующую функцию печени. Мочевина из печени поступает в почки, где и выводится из организма как конечный продукт азотистого обмена. 26. Обмен нуклеотидов. Образование мочевой кислоты. Образование креатинина. Нуклеотидами называются соединения, состоящие из азотистого основания, углевода-пентозы и фосфорной кислоты. Примером может служить уридиловая кислота:В типичном нуклеотиде связь между атомом "N" цикла и первым атомом углерода пентоза - b-N-гликозидная, а связь между остатков фосфорной кислоты и пятым атомом углерода пентозы - сложноэфирная. 1. НУКЛЕОТИДЫ и АЗОТИСТЫЕ ОСНОВАНИЯ (АО), поступающие с пищей, не включаются в НУКЛЕОТИДЫ и НУКЛЕИНОВЫЕ К-ТЫ организма.2. Клетки организма человека синтезируют предшественники НУКЛЕОТИДОВ. Исходя из этого, доказательств опасности употребления в пищу генно-инженерных продуктов в настоящий момент нет.3. Помимо синтеза включаются механизмы реутилизации ПУРИНОВЫХ и ПИРИМИДИНОВЫХ оснований, образующихся при деградации нуклеиновых кислот.4. Можно использовать аналоги ПУРИНОВ и ПИРИМИДИНОВ как антиканцерогенные вещества путём включения их в ДНК и РНК.Мочевая кислота явл. конечным продуктом распада ПУРИНОВЫХ НУКЛ. Уровень мочевой кислоты свидетельствует об интенсивности распада ПУРИНОВЫХ оснований тканей организма и пищи. НАРУШЕНИЕ ОБМЕНА НУКЛЕОТИДОВ. ГИПЕРУРИКЕМИЯ - повышение уровня мочевой кислоты в крови указывает на повышенный распад нуклеиновых кислот или пуриновых нуклеотидов.(подагру). Заболевание генетически детерминировано и носит семейный характер. При подагре кристаллы мочевой кислоты откладываются в суставных хрящах, синовиальной оболочке, клетчатке. Развивается тяжелый острый механический подагрический артрит и нефропатии. КРЕАТИНИН образуется из креатина, который в свою очередь синтезируется в печени из аминокислот, затем транспортируется в мышечную ткань, где взаимодействует с АТФ. Окисление мочевой кислоты - окисление ПУРИНОВЫХ НУКЛЕОЗИДОВ. 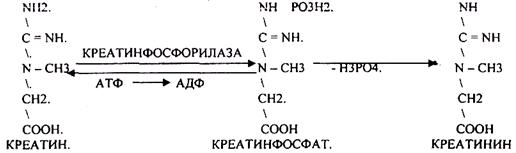 КРЕАТИНИН является конечным продуктом распада креатина. Он поступает в кровь и выделяется с мочой. КРЕАТИНИН не подвергается обратному всасыванию и является показателем фильтрационной способности почек. При её нарушении уровень КРЕАТИНИНА в моче будет понижаться, а в крови - повышаться,._ КРЕАТИНИН является конечным продуктом распада креатина. Он поступает в кровь и выделяется с мочой. КРЕАТИНИН не подвергается обратному всасыванию и является показателем фильтрационной способности почек. При её нарушении уровень КРЕАТИНИНА в моче будет понижаться, а в крови - повышаться,._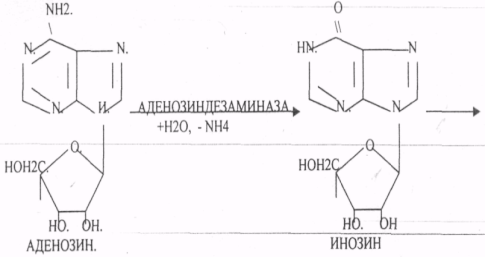 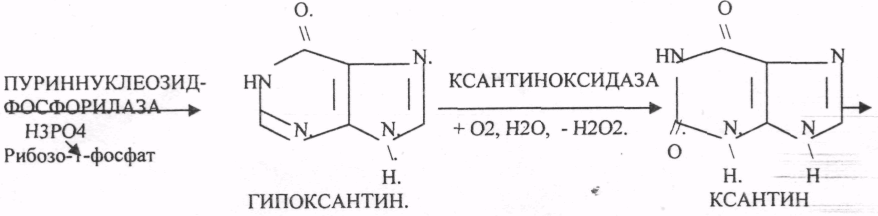 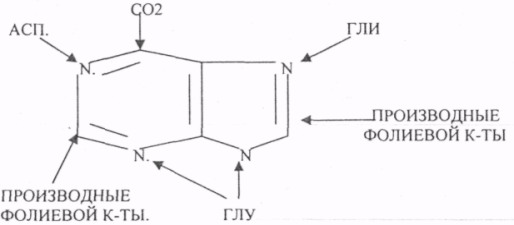 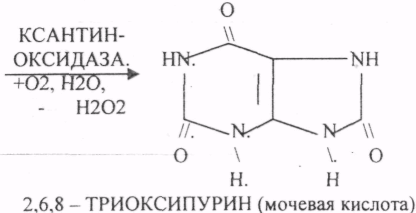 Мочевая кислота является конечным продуктом распада ПУРИНОВЫХ НУКЛ. 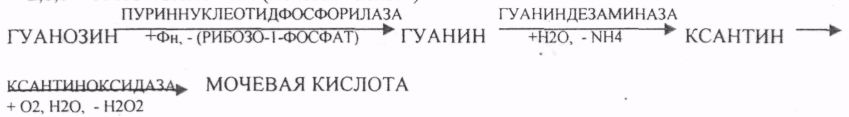 Уровень мочевой кислоты свидетельствует об интенсивности распада ПУРИНОВЫХ оснований тканей организма и пищи. НАРУШЕНИЕ ОБМЕНА НУКЛЕОТИДОВ. ГИПЕРУРИКЕМИЯ - повышение уровня мочевой кислоты в крови указывает на повышенный распад нуклеиновых кислот или пуриновых нуклеотидов.(подагру). Заболевание генетически детерминировано и носит семейный характер. При подагре кристаллы мочевой кислоты откладываются в суставных хрящах, синовиальной оболочке, клетчатке. Развивается тяжелый острый механический подагрический артрит и нефропатии. 27. Генетические дефекты обмена фенилаланина и тирозина. Нарушение МЕЖУТОЧНОГО обмена - нарушение обмена аминокислот в тканях. A) Приобретенные - часто связаны с отсутствием витаминов (г.о. В6), следовательно, нарушение процессов ПЕРЕАМИНИРОВАНИЯ, ДЕЗАМИНИРОВАНИЯ. Это приводит к ГИПЕРАЦИДОАМИНЕМИИ, АМИНОАЦИДУРИИ. B) Наследственные. Чаще всего встречаются нарушения обмена ФЕНИЛАЛАНИНА. В норме ФЕН трансформируется в ТИР.  Отсутствие ФАГ приводит к так называемому метаболическому блоку. Эти соединения накапливаются в тканях, повышаются в крови, появляются в моче - ФЕНИЛКЕТОНУРИЯ (ФКУ). Они токсичны, особенно для тканей мозга. Ребёнок отстаёт в умственном развитии ФЕНИЛПИРОВИНОГРАДНАЯ ОЛИГОФРЕНИЯ. Назначается специальная диета, исключающая ФЕНИЛАЛАНИН. При нарушении метаболизма ТИРОЗИНА не синтезируется МЕЛАНИН, нарушается пигментация кожи, радужки. Моча окрашивается в бурый цвет, а затем в чёрный - АЛКАПТОНУРИЯ. Нарушение на стадии ОРНИТИНОВОГО ЦИКЛА - накопление промежуточных продуктов (ЦИТРУЛИНА, АРГИНИНСУКЦИНАТА) ЦИТРУЛЛИНУРИЯ, АРГИНИНСУКЦИНАТНОЕ СЛАБОУМИЕ. Нарушение на уровне выведения конечных продуктов. ЦИСТИНОЗ - нарушение РЕАБСОРБЦИИ АК и повышение их экскреции в 10 раз (ЦИСТИН, ЦИСТЕИН). 95% ДНК человека представляет негенная часть. 5% - собственно гены. ФУНКЦИОНАЛЬНЫЕ ЭЛЕМЕНТЫ ГЕНОМА: 1. СТРУКТУРНЫЕ ГЕНЫ 2. РЕГУЛЯТОРНЫЕ ЭЛЕМЕНТЫ Структурные гены кодируют синтез МРНК, ТРНК, РРНК. Регуляторные элементы не кодируют РНК и, соответственно, белков; влияют на работу структурных генов. Не генная часть представлена: 1. ТАНДЕМНЫЕ ПОВТОРЫ монотонные повторы НУКЛЕОТИДОВ, не имеющие смысла. Это так называемые «пустынные участки» ДНК. В настоящее время смысл этих участков: выполнение структурной функции и площадки для образования генов в эволюции (эволюционный резерв). 2. ПСЕВДОГЕНЫ - неактивные, но стабильные генетические элементы, возникающие в результате мутации в ранее работавших генах (гены, выключенные мутацией). Это побочный продукт и генетический резерв эволюции. Составляют 20 - 30% не генной части ДНК. 3. Мобильные генетические элементы: -ТРАНСПОЗОНЫ - участки ДНК, способные вырезаться и встраиваться в другие области ДНК. Это так называемые «странники генов». -РЕТРОТРАНСПОЗОНЫ - участки ДНК, копирующиеся в пределах генома, как внутри хромосомы, так и между ними. Могут изменять смысл структурных генов человека, приводят к мутациям. Геном человека изменяется в течении жизни на 10 - 30%. - поврежденные неактивные, мобильные генетические элементы. Не могут ни вырезаться, ни встраиваться из-за отсутствия в клетке ОБРАТНОЙ ТРАНСФЕРАЗЫ. Если фрагмент поступает в клетку с вирусом, то тогда эти гены начинают транскрибироваться. Основные направления молекулярной биологии: ГЕНОМИКА - отрасль молекулярной биологии, изучающая структуру и механизмы работы гена. Транскриптомика – изуение и идентификация всех мРНК, кодирующих белки, изучение их количества и закономерностей экспрессии структурных генов. РН-омика – раздел молекулярной биологии, занимающийся изучением и идентификацией всех некодирующих РНК |
