ОТВЕТЫ ПО БХ НА ЭКЗ. Экзаменационные вопросыответы на экзамен по биохимии для стоматологического факультета 2012 года
 Скачать 5.81 Mb. Скачать 5.81 Mb.
|
Фолдинг белка. Шапероны.Аминокислотная последовательность не является единственным фактором, определяющим форму белковой молекулы. В клетке существуют специальные молекулы, которые активно участвуют в фолдинге белков. В совокупности молекулы, участвующие в фолдинге белков, называют регуляторами фолдинга, среди которых выделяют несколько типов. Молекулы, ускоряющие фолдинг, называются катализаторами фолдинга. Молекулы, служащие для изменения формы белка, — шаперонами фолдинга. Существует четыре типа молекул, которые играют роль таких шаперонов. 1. Молекулы, обеспечивающие правильный фолдинг белков (фолдинг-шапероны — folding chaperones). 2. Молекулы, созданные для удержания частично свернутой молекулы белка в определенном положении. Это необходимо, чтобы система имела возможность закончить фолдинг (удерживающие шапероны — holding chaperones). 3. Шапероны, разворачивающие белки с неправильной формой (дезагрегирующие шапероны— disaggregating chaperones). 4. Шапероны, сопровождающие белки, транспортируемые через клеточную мембрану (секреторные шапероны — secretory chaperons). 4. Электро-химические свойства белков как основа методов их исследования. Электрофорез белков крови. 1.Молекулярная масса белков определяет многие свойства белков: седиментация, диффузия, плотность белковых растворов, коллоидные свойства белков и др. характеристики. Молекулярную массу белка можно определить по скорости седиментации (осаждения) при УЛЬТРАЦЕНТРИФУГИРОВАНИИ. На основании этого определяют коэффициент седиментации. Др. методом определения молекулярной массы является метод ГЕЛЬФИЛЬТРАЦИИ (молекулярное просеивание). 2.Способность белков связываться с ЛИГАНДАМИ. Белки способны связываться с определенными веществами. Белки специфично узнают свои ЛИГАНДЫ. ИЗБИРАТЕЛЬНОСТЬ обеспечивается белковой частью гемоглобина. Центр связывания ЛИГАНДА называется активным центром. Это свойство лежит в основе АФФИНой ХРОМОТОГРАФИи. 3.Электрохимические свойства белков. А. АМФОТЕРНОСТЬ. Белки - АМФОТЕРНЫЕ ЭЛЕКТРОЛИТЫ.Проявляют как основные так и кислотные свойства. Б. Буферные свойства - способность поддерживать РН среды. Наиболее мощным буфером крови является ГЕМОГЛОБИНОВЫЙ буфер, т.к. в большом количестве содержит ГИСТИДИН. B. Белки содержат заряд, который зависит от соотношения кислотных и основных групп, а оно в свою очередь зависит от их диссоциации, определяющейся РН среды. Изоэлектрическое состояние - это состояние молекулы белка, при котором её заряд равен 0. В изоэлектрическом состоянии белок менее устойчив. Это свойство белков используется при их ФРАКЦИВАНИИ: 1.ИОНООБМЕННАЯ ХРОМАТОГРАФИЯ. Для неё используется ИОНООБМЕННИКИ, которые изготавливаются из чистой целлюлозы: ДЭАЭ - целлюлоза (содержит катионные группы); КМ - целлюлоза (содержит анионные группы). 2.Разделение белков на основании величины заряда - электрофорез белков. С помощью электрофореза в сыворотке крови выделяют как минимум 5 фракций: АЛЬБУМИНЫ, альфа, альфа-2, гамма, бета - глобулины. Коллоидные свойства белков. Гидратация. Растворимость. Денатурация, роль шаперонов. 1) Коллоидные свойства A. Оптические свойства:- ОПАЛЕСЦЕНЦИЯ. Рассеивание света ( конус ТИНДАЛЯ). Б. Высокая вязкость растворов белка. B. Малая скорость диффузии. Г. Неспособность белков проникать через полупроницаемые мембраны. Диализ - очистка белковых растворов от низкомолекулярных веществ. В клинике используется ГЕМОДИАЛИЗ - очистка крови от азотистых компонентов. Д. Способность белковых растворов переходить из состояния золя в гель. 2). Гидратация белков - способность белков связывать воду. Она осуществляется за счёт полярных групп и ПЕПТИДНЫХ связей. 100 г. белка связывает 30-35 г. воды. Вода может проникать в молекулы и связываться с внутренними структурами белка с образованием раствора воды в белке. Вода может связываться с наружными структурами с образованием ГИДРАТНОЙ оболочки. 3) Растворимость белков в воде (устойчивость белков в водном растворе). Многие белки хорошо растворимы в воде, что определяется количеством полярных групп. Факторы, определяющие стабильность белковых растворов: - наличие зарядов в белковой молекуле. Одноименные заряды способствуют растворимости белка. - Наличие ГИДРАТНОЙ оболочки, препятствующей объединению белковых молекул. 4) ЛАБИЛЬНОСТЬ пространственной структуры белка. Под действием внешних факторов может происходить нарушение высших уровней организации белковой молекулы при сохранении первичной структуры. При этом белок теряет свои свойства. Это денатурация. Ее вызывают физические факторы ( повышение температуры, давления, механическое воздействие, УЗ, ионизирующее излучение), химические факторы ( кислоты, щелочи, спирт, фенол; соли тяжёлых металлов). В некоторых случаях возможна РЕНАТУРАЦИЯ. ШАПЕРОНЫ - класс белков, защищающий в условиях клетки др. белки от денатурации. Они облегчают формирование пространственной конфигурации белков. К ним относятся белки теплового шока или белки стресса. ШАПЕРОНЫ - над молекулярные комплексы белковой природы, способствующие быстрому и правильному ФОЛДИНГУ. В большом числе представлены белками теплового шока. Неудачный ФОЛДИНГ заканчивается появлением аномальных белков, которые должны быть элиминированы. (О бщая)Принципы классификации белков. Простые и сложные белки. Фосфопротеины и металлопротеины, их роль в клетке. В состав многих белков помимо пептидных цепей входят и неаминокислотные фрагменты, по этому критерию белки делят на две большие группы — простые и сложные белки (протеиды). Простые белки содержат только аминокислотные цепи, сложные белки содержат также неаминокислотные фрагменты. Эти фрагменты в составе сложных белков называются «простетическими группами». В зависимости от химической природы простетических групп среди сложных белков выделяют следующие классы:
5. Принципы классификации белков. Характеристика простых белков. Характеристика гистонов и протаминов. Альбумины и глобулины крови, их физико-химические свойства, функции. 1 .По функции выделяют: 1. Транспортные белки (гемоглобин О2, альбумин жирные кислоты). 2. Каталитические (ферменты), 3. Регуляторные (гормоны). 4. Структурные (белки соединительной ткани, мембранные белки). 5. Защитные (антитела). 6. Сократительные (актин, миозин). 7. Рецепторные участвуют в образовании рецепторов. 2. По форме выделяют: 1. Глобулярные.
Просты́е белки́ — белки, которые построены из остатков α-аминокислот и при гидролизе распадаются только на аминокислоты. Простые белки по растворимости и пространственному строению разделяют на глобулярные и фибриллярные. Глобулярные белки отличаются шарообразной формой молекулы, растворимы в воде. К этой группе относятся все ферменты и БАВ. Среди глобулярных белков можно выделить:
Фибриллярные белки характеризуются волокнистой структурой, практически нерастворимы в воде и солевых растворах. Полипептидные цепи в молекулах расположены параллельно одна другой. Участвуют в образовании структурных элементов соединительной ткани (коллагены, кератины, эластины). сложные белки содержат также неаминокислотные фрагменты. Эти фрагменты в составе сложных белков называются «простетическими группами». 6. Хромопротеины. Строение и функции гемоглобина. Типы гемоглобинов. Миоглобин. Хромопротеиды. К ним относится множество белков с металлсодержащей порфириновой простетической группой, выполняющие разнообразные функции — гемопротеины, хлорофиллы. Гемоглобин — это гемопротеин, с молекулярной массой около 60 тыс.дальтон, окрашивающий эритроцит в красный цвет после связывания молекулы O2 с ионом железа (Fe++). У мужчин в 1 л крови содержится 157 (140—175) г, у женщин — 138 (123—153) г. Молекула гемоглобина состоит из четырех субъединиц гема, связанных с белковой частью молекулы — глобином, сформированной из полипептидных цепей. Главная функция гемоглобина состоит в переносе кислорода. У плода содержится фетальный гемоглобин. Соединение гемоглобина с молекулой 02 называется оксигемоглобином. Оксигемоглобин, отдавший кислород, называется дезоксигемоглобином. Гемоглобин способен связывать в тканях небольшое количество CO2 и освобождать его в лёгких. Монооксид углерода (CO) связывается с гемоглобином крови намного сильнее, чем кислород, образуя карбоксигемоглобин (HbCO). Некоторые процессы приводят к окислению иона железа в геме до степени окисления +3 и образуется метгемоглобин (HbOH). Миоглоби́н — кислород-связывающий белок скелетных мышц и мышцы сердца. Миоглобин отвечает за транспорт кислорода в скелетных мышцах и в мышце сердца. Этот факт используется для определения диагноза инфаркта миокарда по появлению специфического «сердечного» изотипа миоглобина. 7. Углевод-белковые комплексы. Строение углеводных компонентов. Гликопротеины и их протеоглиганы.
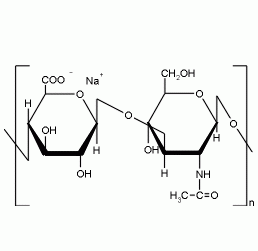
Классификация:
Это ВМС, состоящие из белка и ГАГ. Они образуют основное вещество межклеточного матрикса. В матриксе представлены крупные и малые протеогликаны. Крупные: агрекан и версикан. Агрекан - основной протеогликан хрящевого матрикса. Белковый компонент агрекана – коровый белок + ГАГ. Функции:
Синтез этих соединений состоит из этапов:
Катаболизм происходит при обновлении клеток. Коровый белок расщепляется протеиназами. Цепи ГАГ разрушаются эндо и экзогликозидазами. Расщепление необходимых фрагментов до моносахаридов осуществляется лизосомальными гидролазами 8. Современные представления о структуре и функциях нуклеиновых кислот. Первичная и вторичная структуры ДНК. Строение мономеров нуклеиновых кислот Нуклеи́новая кисло́та — высокомолекулярное органическое соединение, биополимер, образованный остатками нуклеотидов. Нуклеиновые кислоты ДНК и РНК присутствуют в клетках всех живых организмов и выполняют важнейшие функции по хранению, передаче и реализации наследственной информации. Генетическая догма: информация записана в ДНК и передаётся на дочерние молекулы ДНК из поколения в поколение с помощью процесса репликации. ДНК РНК белок РЕПЛИКАЦИЯ - процесс самоудвоения ДНК Строение Полимерные формы нуклеиновых кислот называют полинуклеотидами. Цепочки из нуклеотидов соединяются через остаток фосфорной кислоты(фосфодиэфирная связь). Поскольку в нуклеотидах существует только рибоза и дезоксирибоза, то и имеется лишь дезоксирибонуклеиновая (ДНК) и рибонуклеиновая (РНК). Мономерные формы также встречаются в клетках и играют важную роль в процессах передачи сигналов или запасании энергии. Наиболее известный мономер РНК — АТФ, важнейший аккумулятор энергии в клетке.
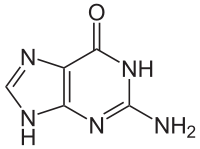 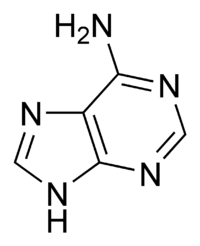 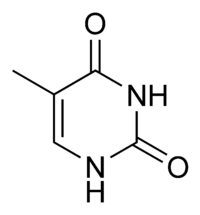 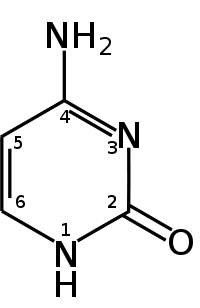 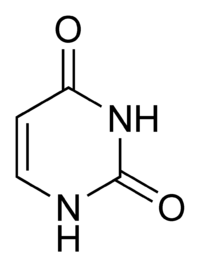 Гуанин аденин тимин цитозин урацил 9. Ферменты, их химическая природа, структурная организация. Активный центр ферментов, его строение. Роль металлов в ферментативном катализе, примеры. Ферменты - это биологические катализаторы белковой природы. Ферменты начинают своё каталитическое действие в ЖКТ, продолжают его в тканях, на этапе выведения и образования конечных продуктов. Все реакции в организме ферментативные. 1. Повышают скорость реакции. 2. В реакциях они не расходуются. 3. Для обратимых процессов и прямая, и обратная реакция катализируется одним и тем же ферментом. ОТЛИЧИТЕЛЬНЫЕ ПРИЗНАКИ. 1 .Ферменты обладают более высокой эффективностью действия. 2.Ферменты чувствительны к температуре (ТЕРМОЛАБИЛЬНЫ) 3.Ферменты чувствительны к значениям РН среды. 4.Ферменты обладают высокой специфичностью действия. 5.Ферменты - это катализаторы с регулируемой активностью. Ферменты, как и все функциональные белки, могут быть простыми и сложными. Простые ферменты представлены только белковой частью (состоят из АК) - ПЕПСИН, ТРИПСИН, ФОСФАТАЗЫ. В структурном отношении имеют 3 уровня организации. Сложные ферменты представлены: 1 .Белковой частью (состоит из АК) - АПОФЕРМЕНТ; 2.Небелковой частью - КОФАКТОР. Выделяют 2 основных КОФАКТОРА: А. Ионы металлов (К, Na, Ca, Mg, Mn) большинство всех ферментов являются МЕТАЛЛОФЕРМЕНТАМИ. В продуктах питания должны обязательно содержаться микроэлементы. |