ОТВЕТЫ ПО БХ НА ЭКЗ. Экзаменационные вопросыответы на экзамен по биохимии для стоматологического факультета 2012 года
 Скачать 5.81 Mb. Скачать 5.81 Mb.
|
|
22. Сопряжение реакций цикла трикарбоновых кислот с дыхательной цепью ферментов. Написать эти реакции. ИЗОЦИТРАТ подвергается далее ДЕГИДРИРОВАНИЮ под влиянием фермента -ИЗОЦИТРАТДЕГИДРОГЕНАЗЫ. 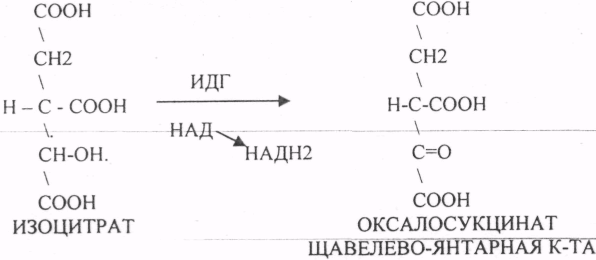 -КГК подвергается реакции ОКИСЛИТЕЛЬНОГО ДЕКАРБОКСИЛИРОВАНИЯ, катализируемой комплексом ферментов (КЕТОГЛУТАРАТДЕГИДРОГЕНАЗНЫЙ комплекс), включающий 3 фермента и 5 КОФЕРМЕНТОВ.  СУКЦИНАТ превращается в фумарат, малат в ЩУК 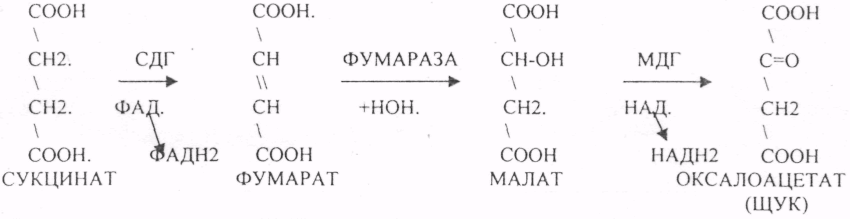
ЩЯВЕЛЕВО-ЯНТАРНАЯ К-ТА подвергается ДЕКАРБОКСИЛИРОВАНИЮ достаточно легко и не требует участия дополнительных ферментов - ПРЯМОЕ ДЕКАРБОКСИЛИРОВАНИЕ. 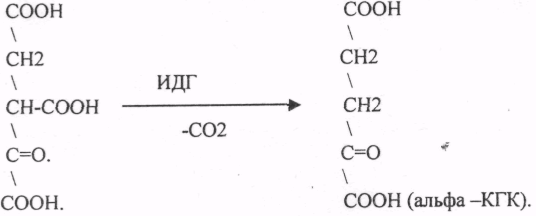 -КГК подвергается реакции ОКИСЛИТЕЛЬНОГО ДЕКАРБОКСИЛИРОВАНИЯ, катализируемой комплексом ферментов (КЕТОГЛУТАРАТДЕГИДРОГЕНАЗНЫЙ комплекс), включающий 3 фермента и 5 КОФЕРМЕНТОВ.  17.Современные представления о биологическом окислении. НАД-зависимые дегидрогеназы. Строение окисленной и восстановленной форм НАД. 1. Биологическое окисление есть процесс переноса электронов. То вещество, что отдаёт электроны, окисляется, то, что принимает, восстанавливается. Биологическое окисление предполагает ДЕГИДРИРОВАНИЕ с образованием воды. Если водород взаимодействует с кислородом с образованием воды вне организма, то это сопровождается взрывом. 2. Биологическое окисление - это процесс многоступенчатый - многоступенчатая передача электронов с постепенным выделением энергии, что исключает взрыв. 3. Биологическое окисление - это процесс, требующий много ферментов. Этот комплекс ферментов называется ЦЕПЬЮ ПЕРЕНОСА ЭЛЕКТРОНОВ (ЦПЭ), или дыхательной цепью. ЦПЕ - своеобразный КОНВЕЕР по переносу электронов и протонов от субстрата к кислороду. НАД-зависимые дегидрогеназы. В качестве кофермента содержат НАД и НАДФ. Пиридиновое кольцо никотинамида способно присоединять электроны и протоны водорода. СТРОЕНИЕ КОМПОНЕНТОВ ДЫХАТЕЛЬНОЙ ЦЕПИ. НАД НАДФ. 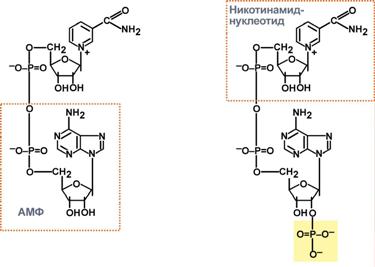 Рабочей частью является витамин РР - НИКОТИНАМИД (ДОПОЛНИТЕЛНЬО) Альтернативные пути биологического окисления, оксигеназный путь. Микросомальные монооксигеназы. В организме возможен и ОКСИГЕНАЗНЫЙ путь биологического окисления. Он не снабжает клетку энергией. Ферменты этого пути включают кислород и субстрат. Стадии ОКСИГЕНАЗНОГО ПУТИ: 1.Связывание кислорода с активным центром фермента. 2.Восстановление кислорода и перенос его на субстрат. Выделяют 2 типа ОКСИГЕНАЗ: 1.ДИОКСИГЕНАЗЫ - ферменты, включающие в субстрат молекулу кислорода. А + О2 = АО2 В живых тканях этот процесс практически не встречается. 2.МОНООКСИГЕНАЗЫ - они катализируют включение в субстрат 1 атома кислорода, др. атом кислорода восстанавливается до воды. Для реакций катализируемых МОНООКСИГЕНАЗАМИ необходим КОСУБСТРАТ - донор электронов. А-Н + О2 + ZH2 А-ОН + Z + Н2О, где А-Н – субстрат, ZH2 – КОСУБСТРАТ, А-ОН - окисленный субстрат. В организме есть несколько видов МОНООКСИГЕНАЗ и прежде всего МИКРОСОМАЛЬНЫЕ МОНООКСИГЕНАЗЫ, содержащие ЦИТОХРОМ Р-450.Т.к. образуется -ОН группа, то это реакции ГИДРОКСИЛИРОВАНИЯ. МИКРОСОМАЛЬНАЯ система участвует в деградации многих умеренно токсических соединений, лекарственных веществ. Восстановленным КОСУБСТРАТОМ в этих реакциях является НАДФ*Н2. Этот путь окисления иногда называют ГИДРОКСИЛАЗНЫМ ЦИКЛОМ. (ДОПОЛНИТЕЛЬНО)Свободнорадикальное окисление. Токсичность кислорода. Активные формы кислорода. Антиокислительная защита. Роль СРО в патологии. Свободные радикалы - это молекулярные частицы, у которых на внешней оболочке имеется неспаренный электрон. Они могут образовываться: при окислении (отрывании атома водорода) при восстановлении О2 + е О2- Атомарный кислород имеет на внешнем электронном уровне 2 неспареных электрона. Он не слишком активный, но может образовывать высоко активные формы. О2+4е + 4Н 2Н2О О2 + е = 02- - СУПЕРОКСИДНЫЙ АНИОН 2-02 + 2е = 022- - ПЕРОКСИДНЫЙ АНИОН НО, - ГИДРОКСИЛ РАДИКАЛ Н2О2, О2-, О22-, ОН, - активные формы кислорода (АФК). Они образуются в организме при различных физиологических и патологических процессах. Все свободные радикалы в организме классифицируют: 1. Первичные радикалы (О2, N,O). Они образуются в результате ферментативных реакций. Они являются физиологическими. Способствуют образованию вторичных радикалов. 2. Вторичные радикалы (ОН, ЛИПИДНЫЕ радикалы – L,, LO,, LOO,). Это патологические продукты. 3. Третичные радикалы (АНТИОКСИДАНТЫ) - образуются под влиянием вторичных радикалов. СУПЕРОКСИДНЫЙ АНИОН легко присоединяет Н+, е. Он хорошо растворяется в жирах, легко взаимодействует с ЛИПИДАМИ мембран, и с ПОЛИНЕНАСЫЩЕННЫМИ ЖИРНЫМИ КИСЛОТАМИ, отнимая у них водород. Этот процесс называется ПЕРЕКИСНЫМ ОКИСЛЕНИЕМ ЛИПИДОВ (ПОЛ). Это патологическое явление, приводящее к нарушению целостности мембран клеток. Поэтому в организме есть система, которая предотвращает ПОЛ - АНТИОКИСЛИТЕЛЬНАЯ СИСТЕМА (АОС), препятствующая образованию свободных радикалов. Она включает: 1 .Фермент - СУПЕРОКСИДДИСМУТАЗА (СОД), ГЛУТАТИОНПЕРОКСИДАЗА. 2.Альфа- ТОКОФЕРРОЛ (вит. Е) - основной не ферментный АНТИОКСИДАНТ. 3.УБИХИНОН. 4.МОЧЕВАЯ К-ТА. 5.БИЛИРУБИН. 6.ГЛУТАТИОН. 7.КОМПЛЕКСОНЫ ЖЕЛЕЗА. Активные формы кислорода повреждают структуру ДНК, белков и различные мембранные структуры клеток. В результате появления в гидрофобном слое мембран гидрофильных зон в клетки могут проникать вода, ионы натрия, кальция, что приводит к набуханию клеток, органелл и их разрушению. Активация ПОЛ характерна для многих заболеваний: дистрофии мышц (болезнь Дюшенна), болезни Паркинсона, при которых ПОЛ разрушает нервные клетки в стволовой части мозга, при атеросклерозе, развитии опухолей, старении, ишемии. 18. Компоненты дыхательной цепи и их характеристика. ФМН и ФАД-зависимые дегидрогеназы. Строение окисленной и восстановленной форм ФМН. Компоненты ДЦ 1 .НИКОТИНЗАВИСИМЫЕ ДГ, т.е. содержащие КОФЕРМЕНТЫ - НАД, НАДФ 2.ФЛАВИНЗАВИСИМЫЕ ДГ, т.е. содержащие КОФЕРМЕНТЫ - ФМН, ФАД. З.УБИХИНОН (Ko-Q). 4.ЦИТОХРОМЫ: в, с, c1., а, а3. Почти все эти компоненты, за исключением первого, встроены во внутреннюю мембрану МИТОХОНДРИЙ. ФАД и ФМН-зависимые дегидрогеназы содержат в качестве кофермента фосфорный эфир витамина В2 (ФАД). СТРОЕНИЕ КОМПОНЕНТОВ ДЫХАТЕЛЬНОЙ ЦЕПИ. 1 .В НАД и НАДФ рабочей частью является витамин РР - НИКОТИНАМИД. 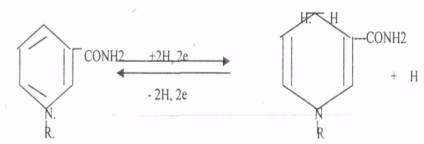 НАД*2Н + 2е = НАДН+Н 2.В ФАД и ФМН рабочей частью является ФЛАВИИ (компонент витамина В2) 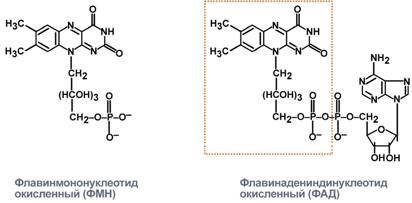 3.УБИХИНОН легко переходит в восстановленную форму KOQ +2Н +2е =KOQ*H2 4.ЦИТОХРОМЫ - это ГЕТЕРОПРОТЕИНЫ. Их белковой частью является ГЕМ. Белки хромопротеиды, способные присоединять электроны, благодаря наличию в своем составе в качестве простетических групп железопорфиринов. Они принимают электрон от вещества, являющегося немного боле сильным восстановителем, и передают его более сильному окислителю. Цитохромы электронтранспортной цепи. Их функционирование. Образование воды как конечного продукта обмена. ЦИТОХРОМЫ - это ГЕТЕРОПРОТЕИНЫ. Их белковой частью является ГЕМ, структура которого представляет собой 4 ПИРРОЛЬНЫХ кольца и атом железа, который легко меняет валентность. Также могут включать медь. 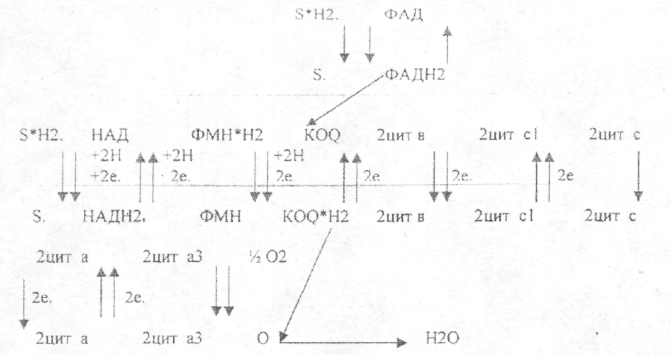 20. Пути синтеза АТФ. Субстратное фосфорилирование (примеры). Молекулярные механизмы окислительного фосфорилирования (теория Митчелла). Разобщение окисления и фосфорилирования. Процесс образования АТФ в дыхательной цепи – окислительное фосфорилирование. За счет энергии транспорта электронов в ДЦ из АДФ и неорганического фосфата образуется АТФ. Субстратное фосфорилирование – процесс синтеза АТФ из АДФ и фосфата за счет энергии окисленного субстрата в цитоплазме клетки. Примером субстратного фосфорилирования могут служить реакции:  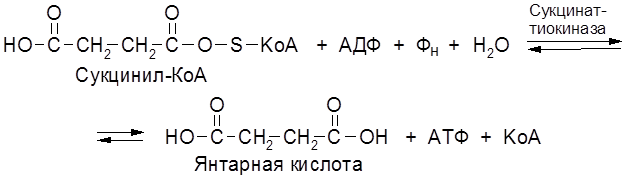 Основные положения теории Митчела: 1.Мембрана МИТОХОНДРИЙ не проницаема для протонов. 2.Образуется протонный потенциал в процессе транспорта электронов и протонов. 3.Обратный транспорт протонов в МАТРИКС сопряжен с образованием АТФ. Процесс транспорта электронов происходит во внутренней мембране. Протоны переносятся в межмембранное пространство, а электроны продвигаются по дыхательной цепи. Внутренняя мембрана со стороны матрикса заряжается отрицательно, а со стороны межмембранного пространства - положительно. Во время дыхания создается ЭЛЕКТРО-ХИМИЧЕСКИЙ градиент; концентрационный и разности потенциалов. Электрический и концентрационный градиент составляет ПРОТОНДВИЖУЩУЮ силу, которая дает силу для синтеза АТФ. На определенных участках внутренней мембраны есть протонные каналы. Протоны могут проходить обратно в матрицу, при этом образующаяся энергия идёт на синтез АТФ. Разобщение дыхания и фосфорилирования Некоторые химические вещества (протонофоры) могут переносить протоны или другие ионы (ионофоры) из межмембранного пространства через мембрану в матрикс, минуя протонные каналы АТФ-синтазы. В результате этого исчезает электрохимический потенциал и прекращается синтез АТФ. Это разобщение дыхания и фосфорилирования. В результате разобщения количество АТФ снижается, а АДФ увеличивается. Разобщители - липофильные вещества, легко проходящие через липидный слой мембраны. Это 2,4-динитрофенол, присоединяющий протон в межмембранном пространстве и перенося его в матрикс. 21. Потребность человека в белках. Незаменимые аминокислоты. Биологическая ценность белков. Роль белков в питании. В нашем организме идёт постоянный синтез и распад белков. Ежесуточно распадается 400гр. белка и столько же синтезируется. Из общей массы организма белка приходится 15кг. Синтез обновленного белка происходит из аминокислот, которые образуются при распаде. Все АК можно разделить на 4 группы: 1 .Заменимые - синтезируются в организме: АЛА, АСП, АСН, ГЛУ, ГЛН, ГЛИ, ПРО, СЕР. 2.Незаменимые - не синтезируются в организме и поступают с пищей: ВАЛ, ЛЕЙ, ИЛЕ. ЛИЗ. ТРЕ, МЕТ, ФЕН, ТРИ. 3.Частично заменимые - синтезируются в организме, но очень медленно и не покрывают всех потребностей организма: ГИС, АРГ. 4.Условно заменимые - синтезируются из незаменимых аминокислот: ЦИС (МЕТ), ТИР (ФЕН). Полноценность белкового питания определяется: 1. Наличием всех незаменимых аминокислот. Отсутствие даже одной незаменимой аминокислоты нарушает биосинтез белка, т.е. каждая незаменимая АК может быть лимитирующей в процессе синтеза белка. 2. Аминокислотным составом белка. Все АК могут содержаться в продуктах как животного, так и растительного происхождения. Суточная потребность человека в белках составляет 100гр. БЕЛКИ, ИХ БИОЛОГИЧЕСКАЯ РОЛЬ. Белки - это высокомолекулярные азотсодержащие органические вещества, состоящие из АК. соединённых ПЕПТИДНЫМИ связями в ПОЛИПЕПТИДНУЮ цепь, и имеющие сложную структурную организацию. Роль в питании:
22.Превращение белков в органах пищеварительной системы. Превращение белков в желудке. Роль соляной кислоты в переваривании белков. Показать действие пептидгидролаз. Качественный и количественный анализ желудочного содержимого. Пищевые белки подвергаются гидролитическому расщеплению под действием ПРОТЕОЛИТИЧЕСКИХ ФЕРМЕНТОВ (ПЕПТИДАЗЫ). Большинство этих ферментов вырабатывается в неактивной форме, а затем активируется путём ЧАСТИЧНОГО ПРОТЕОЛиЗА. Это предохраняет стенки органов ЖКТ от самопереваривания. Поверхность желудка и кишечника покрыта слизью, в составе которой содержатся ГЕТЕРОПОЛИСАХАРИДЫ. Проферменты вырабатываются слизистой желудка или кишечника и поступают в полость этих органов, где происходит их активация. В пристеночном слое вырабатываются БИКАРБОНАТЫ, которые создают среду близкую к нейтральной (рН=5-6). 1)В ротовой полости происходит лишь механическая переработка пищи. 2)В желудке начинается химическое превращение белков. Здесь действуют два основных фермента: ПЕПСИН и ГАСТРИКСИН. ПЕПСИН вырабатывается главными клетками слизистой желудка в неактивной форме -ПЕПСИНОГЕН, который под действием соляной кислоты активируется и превращается в пепсин. Процесс активации является АУТОКАТАЛИТИЧЕСКИМ путём ЧАСТИЧНОГО ПРОТЕОЛИЗА. Соляная кислота вырабатывается обкладочными клетками слизистой желудка и играет очень важную роль в переваривании белков: -активирует ПЕПСИНОГЕН, превращая его в пепсин, - создаёт оптимум рН для действия пепсина (1,5 - 2), -обладает бактерицидным действием, -денатурирует белки, которые потом гидролизуются. Внутренние ПЕПТИДНЫЕ связи становятся доступными для действия пепсина, способствует продвижению желудочного содержимого далее в кишечник. Пепсин - это фермент, который является ЭНДОПЕПТИДАЗОЙ, т.е. действует на внутренние ПЕПТИДНЫЕ связи, в образовании которых участвуют ароматические аминокислоты (ФЕН, ТИР, ТРИ) своими АМИДНЫМИ группами. ГАСТРИКСИН по действию аналогичен пепсину. Это тоже ЭНДОПЕПТИДАЗА. Его оптимум рН = 3 - 3,5. Действует на ПЕПТИДНЫЕ связи. В желудке под действием ПЕПСИНА и ГАСТРИКСИНА сложные белковые молекулы распадаются на высокомолекулярные ПОЛИПЕПТИДЫ. Ими являются так называемые АЛЬБУМОЗЫ, ПЕПТОНЫ, которые поступают в тонкий кишечник. В тонком кишечнике эти ПОЛИПЕПТИДЫ подвергаются действию целого ряда протеолитических ферментов ПЖЖ: ТРИПСИНОГЕН, ХИМОТРИПСИНОГЕН, ПРОЭЛАСТАЗА, ПРОКАРБОКСИПЕПТИДАЗА. Механизм активации всех этих ферментов - ЧАСТИЧНЫЙ ПРОТЕОЛИЗ по каскадному механизму. Переваривание белков в кишечнике. Покажите действие трипсина и химотрипсина на конкретных примерах. Механизм активации всех этих ферментов - ЧАСТИЧНЫЙ ПРОТЕОЛИЗ по каскадному механизму. 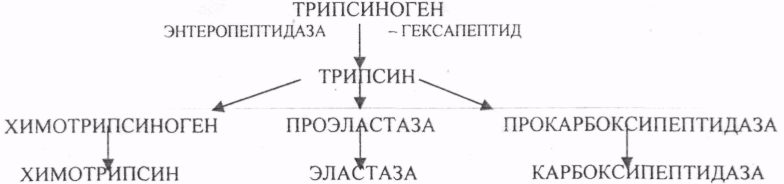 ТРИПСИН, ХИМОТРИПСИН, ЭЛАСТАЗА - ЭНДОПЕПТИДАЗЫ. ТРИПСИН разрушает внутренние ПЕПТИДНЫЕ связи, в образовании которых принимают участие ЛИЗ и АРГ. ХИМОТРИПСИН разрушает внутренние связи, в образовании которых принимают участие ароматические аминокислоты (ТИР, ТРИ, ФЕН). ЭЛАСТАЗА разрушает внутренние ПЕПТИДНЫЕ связи, в образовании которых принимают участие АЛА, ГЛИ, ПРО, ЦИС. В результате действия ПЕПСИНА, ХИМОТРИПСИНА и ЭЛАСТАЗЫ высокомолекулярные ПЕПТИДЫ расщепляются до низкомолекулярных, которые подвергаются действию ЭКЗОПЕПТИДАЗ, действующих на крайние связи, отщепляя отдельные концевые аминокислоты. КАРБОКСИПЕПТИДАЗА разрушает крайние связи, отщепляя аминокислоты с С-конца. АМИНОПЕПТИДАЗА действует на крайние ПЕПТИДНЫЕ связи со стороны N-конца, отщепляя отдельные аминокислоты. ДИПЕПТИДЫ подвергаются действию ДИПЕПТИДАЗ, продуцирующихся слизистой кишечника сразу в активной форме. Т.о. в результате действия всей этой группы ферментов в ЖКТ белки пищи расщепляются до аминокислот. Образующиеся аминокислоты всасываются стенкой кишечника в кровь и поступают во все органы и ткани. Не всосавшиеся аминокислоты поступают в толстую кишку, где подвергаются процессам гниения. Это процесс бактериального распада веществ под действием микрофлоры или ферментов, вырабатывающихся этой микрофлорой. В норме в толстой кишке подвергаются аминокислоты, а при патологии - белки. Это происходит и в других отделах ЖКТ: в желудке (при понижении кислотности), ротовой полости (при кариесе). 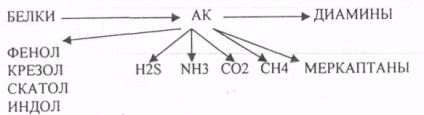 23. Гниение белков и аминокислот в кишечнике. Пути образования продуктов гниения. Примеры. Не всосавшиеся аминокислоты поступают в толстую кишку, где подвергаются процессам гниения. Это процесс бактериального распада веществ под действием микрофлоры иди ферментов, вырабатывающихся этой микрофлорой, В норме в толстой кишке подвергаются аминокислоты, а при патологии - белки. Это происходит и в других отделах ЖКТ. 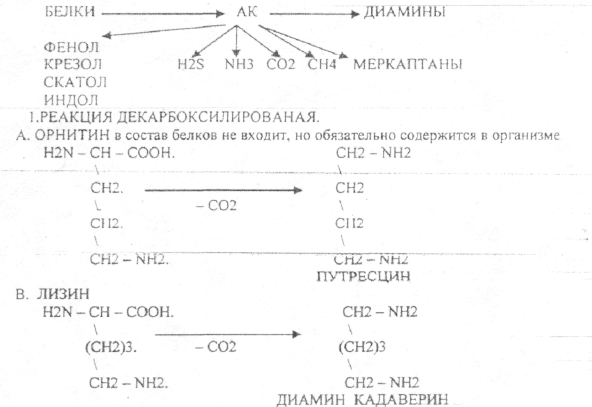 ПУТРЕСЦИН и КАДАВЕРИН являются токсическими веществами, входят в состав трупных ядов. 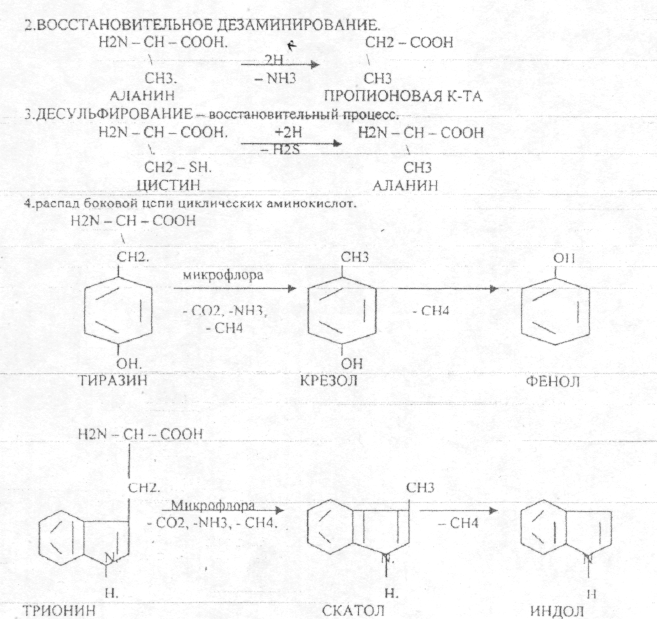 24. Механизм обезвреживания продуктов гниения белков. Роль ФАФС и УДФ-ГК в этом процессе (конкретные примеры). Все токсические вещества (индол, скатол, фенол), образующиеся при гниении, поступают в печень, где и происходит их обезвреживание. В печени имеется две системы, участвующие в обезвреживании этих веществ: 1. УДФГК - УРИДИНДИФОСФОГЛЮКУРОНОВАЯ К-ТА. 2. ФАФС - ФОСФОАДЕНОЗИНФОСФОСУЛЬФАТ. |
