ОТВЕТЫ ПО БХ НА ЭКЗ. Экзаменационные вопросыответы на экзамен по биохимии для стоматологического факультета 2012 года
 Скачать 5.81 Mb. Скачать 5.81 Mb.
|
|
Посттрансляционный процессинг. Виды химической модификации, фолдинг и адресование белков. Шапероны, прионы. ПРОЦЕССИНГ включает в себя наивысшую точку - ФОЛДИНГ - сворачивание, обретение белком высших уровней пространственно-структурной организации, заканчивающееся формированием структурно и функционально зрелой молекулы. ШАПЕРОНЫ - над молекулярные комплексы белковой природы, способствующие быстрому и правильному ФОЛДИНГУ. ШАПЕРОНЫ препятствуют приобретению белком неправильной конформации. Неудачный ФОЛДИНГ заканчивается появлением аномальных белков, которые должны быть элиминированы. УБИКВИТИН белок, присутствующий в каждой клетке организма. Это «билет» на уничтожение аномального белка. Белок, меченый УБИКВИТИНОМ, разрушается в ПРОТЕОСОМАХ. В норме обеспечивается гомеостаз структуры белка, сохранение его нативной структуры. При заболеваниях образуются аномальные белки, которые не утилизируются - ПРИОНЫ -ПРОТЕИНОГЕННЫЕ, информативные частицы. Это продукты неправильного ФОЛДИНГА, которые, попадая в организм извне, трансформируют нормальные белки данного организма в виде цепной реакции. ПРИОННЫЕ белки не расщепляются в ЖКТ, а всасываются в неизменённом виде. КОМПАРТМЕНТАЛИЗАЦИЯ БЕЛКОВ (механизмы адресования). Белки должны быть правильно распределены в клетке или выделены из неё на экспорт. За этот процесс отвечает сигнальный участок - фрагмент аминокислотной последовательности синтезированного ПОЛИПЕПТИДА, содержащего условный адрес размещения белка. Преобладание гидрофильных аминокислот в сигнальном участке способствует проникновению белка в цитоплазму и выделение на экспорт. Синтезированные белки могут быть в виде над молекулярных комплексов (ШАПЕРОНЫ, ПРОТЕОСОМЫ, белки мокро трубочек). 35. Строение оперона. Регуляция биосинтеза белка у прокариотов. Функционирование лактозного и гистидиновых оперонов. Регуляция биосинтеза белка у ПРОКАРИОТ: 1. Регуляция происходит только на уровне транскрипции. Первичные транскрипты генов у них транслируются до завершения транскрипции. 2. Неоднородность ГЕНОМОВ. В геноме есть структурные гены и есть регуляторные области, которые могут включать регуляторные элементы и регуляторные гены. Структурные гены кодируют синтез структурных и функциональных белков. Регуляторные элементы не кодируют синтез белков вообще, но влияют на процесс транскрипции. Регуляторными элементами являются: - ПРОМОТОР - место прикрепления к ДНК РНК-ПОЛИМЕР АЗЫ, ОПЕРАТОР - место взаимодействия регуляторных белков с ДНК. Регуляторные гены кодируют синтез регуляторных белков. К ним относится белок -РЕПРЕССОР, который Может блокировать считывание информации, связываясь с оператором. Фрагмент ДНК, подверженный транскрипции называется ОПЕРОН (ПРОМОТОР, ОПЕРАТОР, структурный ген). За пределами ОПЕРОНА находятся гены-регуляторы, кодирующие синтез белка - РЕПРЕССОРА. 3. Регуляция биосинтеза белков у ПРОКАРИОТ протекает альтернативно путём репрессии и индукции. ПРИМЕР: ЛАКТОЗНЫЙ ОПЕРОН. В микробной клетке лактоза с помощью лактазы расщепляется до галактозы и глюкозы. Лактозный ОПЕРОН регулирует синтез лактазы. Если в среде присутствует лактоза, то БЕЛОК-РЕПРЕССОР вытесняется из связи с оператором и гены лактазы транскрибируются. Лактоза выступает индуктором. Гистидиновый оперон. В отсутствие гистидина белок-репрессор не имеет сродства к оператору, РНК-полимераза присоединяется к промотору, и происходит транскрипция 10 структурных генов, кодирующих строение ферментов, участвующих в синтезе гистидина; в присутствии гистидина в среде комплекс белка-репрессора с Гис, связывается с оператором, препятствует присоединению РНК-полимеразы к промотору и останавливает транскрипцию. 36. Особенности и уровни регуляции биосинтеза белка у эукариотов. Амплификация генов, энхансерные и сайленсерные элементы. Регуляция биосинтеза белка у ЭУКАРИОТ происходит на всех уровнях матричных биосинтезов. 1. На уровне транскрипции - групповая репрессия гистонами. У человека 90% ДНК репрессировано. 2. Амплификация генов - повышение числа копий гена в геноме (повышается площадь транскрипции). 3. Регуляция транскрипции сигналами-регуляторами (усилителями и душителями). Для сигналов усилителей принят термин ЭНХАЙСЕР. Они не кодируют синтез белка, чрезвычайно эффективны, может наблюдаться 200-кратное усиление транскрипции. Действие не специфично (одновременно может влиять на группу генов). Значительно удалён от ПРОМОТОРА гена-мишени. Подвержен влиянию регуляторных факторов (гормонов). Сигналы-душители называются САЙЛЕНСЕРЫ - угнетатели транскрипции. Особенности действия подобны ЭНХАЙСЕРАМ, только действие противоположное. 4. Регуляция на уровне процессинга МРНК разрешение или запрещение процессинга дифференциальный процессинг включает альтернативный СПЛАЙСИНГ - сборка РНК из разных экзонов, и редактирование МРНК - замена одного из нуклеотидов с изменением генетической информации, приводящее к образованию изменённых белков 5. На уровне стабильности и активности МРНК. МРНК в клетке образует комплекс с белками, который называется ИНФОРМОСОМА. В их составе МРНК не разрушается ферментами, сохранения в активном, стабильном состоянии. При необходимости она высвобождается из комплекса и транслируется. Процесс образования и распада ИНФОРМОСОМ регулируется гормонами. С одной молекулы РНК транслируется большое количество белков. 6. Регуляция на уровне трансляции: Тотальная регуляция может быть в виде тотальной репрессии или индукции за счёт изменения концентрации белковых факторов трансляции Избирательная дискриминация. Определённые виды МРНК избирательно не транслируются. С них не синтезируется белок. Трансляция с альтернативных стартовых участков. Т.о. образом может происходить выбор исходной стартовой точки трансляции. 38. Виды молекулярных мутаций и их метаболические последствия. ДЕПУРИНИЗАЦИЯ - потеря или замена пуриновых оснований. За 70 лет теряется до 40%. С меньшей скоростью происходит ДЕЗАМИНИРОВАНИЕ и ДЕПИРИМИДИРОВАНИЕ. Белок Р-53 метит повреждённый участок ДНК. Если он работает, то включаются механизмы репарации. Если этого белка нет, то наступают мутации (хромосомные, геномные). Генные мутации затрагивают небольшой участок ДНК в пределах гена. Виды генных мутаций: 1. замена: а) одного нуклеотида на другой без изменения смысла кода ААГ = ААА (ЛИЗИН) (квазидуплетность) б) замена одного нуклеотида на другой с изменением смысла кодона - МИССЕНС-МУТАЦИЯ в) замена с образованием терминирующего кодона- НОНСЕНС-МУТАЦИЯ. 2. вставка: а) вставка одного или нескольких кодонов без сдвига рамки считывания. В результате образуется белок, удлинённый на одну или несколько аминокислот. б) вставка не кратного 3 нуклеотидов. Происходит сдвиг рамки считывания. В результате синтезируется белок со случайной аминокислотной последовательностью. 3. ДЕЛЕЦИЯ (выпадение): а) выпадение одного или нескольких кодонов без сдвига рамки считывания. Образуется укороченный белок. б) выпадение одного или нескольких (но не кратное 3) нуклеотидов со сдвигом рамки считывания. Образуется белок со случайной последовательностью аминокислот . По биологическим последствиям все мутации делятся на:
39. Основные углеводы организма человека, их строение и классификация, биологическая роль. Углеводы - это ПОЛИОКСИКАРБОНИЛЬНЫЕ соединения и их производные. МОНОСАХАРИДЫ: ТРИОЗЫ (ГЛИЦЕРАЛЬДЕГИД, ДИОКСИАЦЕТОН), ТЕТРОЗЫ (ЭРИТРУЛОЗА), ПЕНТОЗЫ (РИБОЗА, ДЕЗОКСИРИБОЗА, КСИЛУЛОЗА), ГЕКСОЗЫ (ГЛЮКОЗА, ГАЛАКТОЗА, ФРУКТОЗА). ОЛИГОСАХАРИДЫ: МАЛЬТОЗА, ЛАКТОЗА, САХАРОЗА. ПОЛИСАХАРИДЫ делятся на ГОМОПОЛИСАХАРИДЫ и ГЕТЕРОПОЛИСАХАРИДЫ. ГОМОПОЛИСАХАРИДЫ - КРАХМАЛ, ГЛИКОГЕН. ГЕТЕРОПОЛИСАХАРИДЫ ХОНРОЭТИНСЕРНАЯ К-ТА, ГИАЛУРОНОВАЯ К-ТА, НЕЙРАМИНОВАЯ К-ТА, ГЕПАРИН. БИОЛОГИЧЕСКАЯ РОЛЬ УВ. 1. ЭНЕРГЕТИЧЕСКАЯ. При окислении 1 гр. УВ до конечных продуктов (СО2 и Н2О) выделяется 4,1-ккал-60-70 % всей калорийности пищи. 2. Структурная. УВ используется как строительный материал для образования структурных компонентов клеток (ГЛИКОЛИПИДЫ, ГЛИКОПРОТЕИНЫ, ГЕТЕРОПОЛИСАХАРИДЫ межклеточного вещества). 3. Резервная. УВ в виде гликогена могут откладываться в запас. 4. Защитная. ГЛИКОПРОТЕИНЫ принимают участие в образовании антител. ГИАЛУРОНОВАЯ К-ТА препятствует проникновению чужеродных веществ. ГЕТЕРОПОЛИСАХАРИДЫ участвуют в образовании слизи слизистых оболочек дыхательных путей, ЖКТ. 5. Регуляторная. Некоторые гормоны являются ГЛИКОПРОТЕИНАМИ (ТИРИОГЛОБУЛИН) 6. Участвуют в процессах распознавания клеток (СИАЛОВАЯ и НЕЙРОЛИНОВАЯ К-ТЫ). 7. Входя в состав оболочек эритроцитов, определяют группы крови. 8. Участвуют в процессах свёртывания крови, входя в состав ФИБРИНОГЕНА и ПРОТРОМБИНА. Препятствуют свёртыванию крови, входя в состав ГЕПАРИНА. 40. Роль углеводов в питании. Переваривание и всасывание углеводов в органах пищеварительной системы. Написать реакции. Непереносимость дисахаридов. Основными УВ для организма человека являются УВ пищи: крахмал, сахароза, лактоза. Поступивший с пищей крахмал в ротовой полости будет подвергаться гидролизу под действием альфа -АМИЛАЗЫ слюны. Она расщепляет альфа (1,4)-ГЛИКОЗИДНЫЕ связи. Поскольку пища в ротовой полости задерживается недолго, то крахмал здесь переваривается лишь частично. Гидролиз крахмала завершается образованием АМИЛОДЕКСТРИНОВ. Далее пища поступает в желудок. В желудке действие альфа -АМИЛАЗЫ прекращается. Однако в более глубоких слоях действие фермента, крахмал проходит следующую стадию гидролиза- ЭРИТРОДЕКСТРИНОВ. Основным местом переваривания крахмала служит тонкий отдел кишечника. В 12 п.к. открываются протоки ПЖЖ. Под действием фермента в её секрете будет идти гидролиз крахмала. Выделяющийся панкреатический сок содержит БИКАРБОНАТЫ, которые нейтрализуют желудочное кислое содержимое. Альфа -АМИЛАЗА завершает разрыв внутренних альфа(1,4)-ГЛИКОЗИДНЫХ связей с образованием ДИСАХАРИДОВ (МАЛЬТОЗ). Образованная МАЛЬТОЗА - быстро гидролизуется под действием МАЛЬТАЗ. Из тех же остатков, которые в молекулах крахмала были соединены альфа(1,6)-ГЛИКОЗИДНЫМИ связями, образуются ДИСАХАРИДЫ -ИЗОМАЛЬТОЗЫ. Они будут гидролизоваться ИЗОМАЛЬТАЗАМИ. ФОСФОРИЛИРОВАНИЕ в присутствии АТФ и фермента -ГЕКСОКИНАЗЫ. Глюкоза превращается в глюкозо-6-фосфат. Теперь он будет использоваться в АНАБОЛИЧЕСКИХ и КАТАБОЛИЧЕСКИХ реакциях. Глюкоза из клетки может выйти, если в реакции гидролиза при участии глюкозо-6-фосфатазы освободится от остатка фосфорной кислоты. Этот фермент находится в печени, почках, эпителии кишечника. Проникновение глюкозы в клетки этих органов и тканей необратимы. Процесс биосинтеза: 1) Сахароза глюкоза 2) 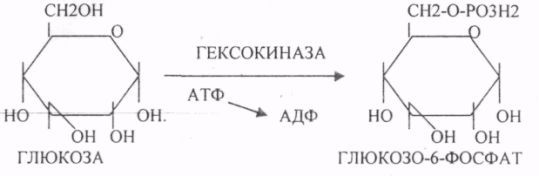 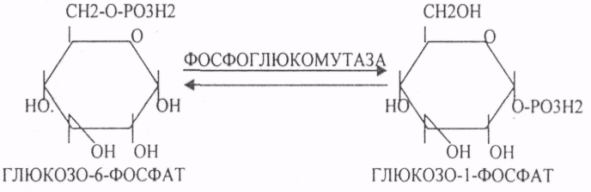 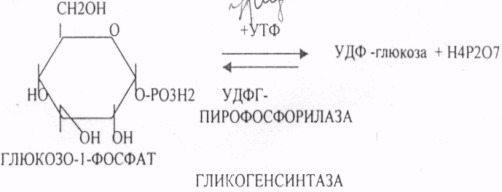 3) ГЛИКОГЕНСИНТАЗА - ТРАНСФЕРАЗА, которая переносит остатки глюкозы, входящие в УДФ- глюкозу, на ГЛИКОЗИДНУЮ связь остаточного в клетке гликогена. Образование альфа(1,6)-ГЛИКОЗИДНЫХ связей в точках ветвления гликогена катализирует ГЛИКОГЕН-ВЕТВЯЩИЙ фермент. На каждую молекулу глюкозы, включающуюся в структуру гликогена, расходуется 2 молекулы АТФ. Гликоген в клетках накапливается во время пищеварения и рассматривается как резервная форма глюкозы, которая используется клетками в промежутках между приёмами пищи. 41. Биосинтез и распад гликогена в тканях. Биологическая роль этих процессов. Гликогеновые болезни. Гликоген может синтезироваться практически во всех органах и тканях. Большая часть гликогена содержится в мышцах. Глюкоза из крови легко проникает в клетки органов и тканей, проходя через биологические мембраны клеток. Как только глюкоза заходит в клетку, она превращается в глюкозо-6-фосфат. Процесс биосинтеза протекает в 4 стадии: 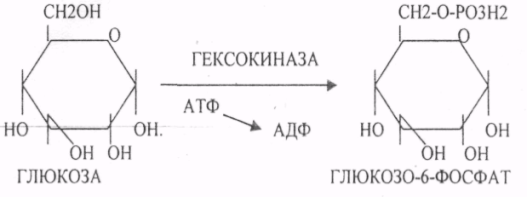 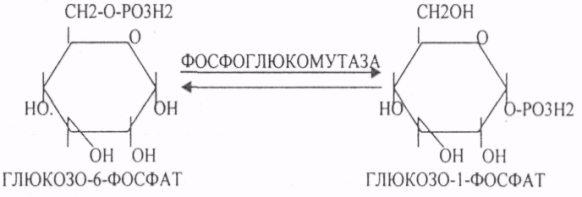 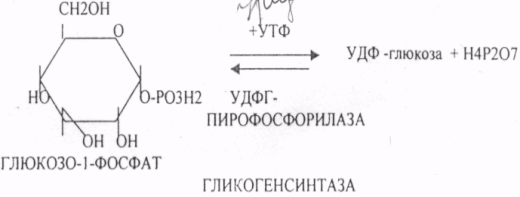 ГЛИКОГЕНСИНТАЗА - ТРАНСФЕРАЗА, которая переносит остатки глюкозы, входящие в УДФ- глюкозу, на ГЛИКОЗИДНУЮ связь остаточного в клетке гликогена. Образование альфа(1,6)-ГЛИКОЗИДНЫХ связей катализирует специальный ГЛИКОГЕН-ВЕТВЯЩИЙ фермент. Образовавшийся в последней реакции УДФ, превращается в УТФ, при этом поглощается I молекула АТФ. Гликоген в клетках накапливается во время пищеварения и рассматривается как резервная форма глюкозы, которая используется клетками в промежутках между приёмами пищи. РАСПАД ГЛИКОГЕНА. Может идти 2 путями: 1. ОСНОВНОЙ ФОСФОРОЛИТИЧЕСКИЙ ПУТЬ Он протекает в печени, почках, эпителии кишечника. Схематично можно записать в виде 3 реакций. 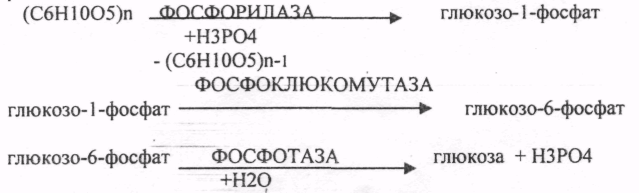 2.НЕОСНОВНОЙ АМИЛОЛИТИЧЕСКИЙ. Его доля незначительна. Протекает в печени при участии 3 ферментов: альфа - АМИЛАЗА, АМИЛО-1,6-ГЛИКОЗИДАЗА, гамма -АМИЛАЗА. ГЛИКОГЕНОВЫЕ БОЛЕЗНИ. Это наследственное нарушение обмена гликогена, которое связано с недостатком какого-либо из ферментов, участвующих в синтезе или распаде гликогена. ГЛИКОГЕНОЗЫ - болезни, связанные с нарушением процессов распада гликогена. Клинически проявляются увеличением печени, мышечной слабостью, ГИПОГЛЮКОЗЭМИЕЙ натощак. Наиболее часто встречаются: 1.болезнь ФЕРСА - ФОСФОРИЛАЗА ПЕЧЕНИ. 2. Болезнь МАК-АРДЛЯ - ФОСФОРИЛАЗА МЫШЦ. 3. Болезнь ПОМПЕ- альфа- 1,4-ГЛИКОЗИДАЗА. 4. Болезнь КОРИ - АМИЛО-1.6-ГЛИКОЗИДАЗА. 5. Болезнь ГИРКЕ - ГЛЮКОЗО-6-ФОСФОТАЗА. АГЛИКОГЕНОЗЫ характеризуются признаками нарушения синтеза. Клинически проявляются резкой ГИПОГЛЮКОЗЭМИЕЙ натощак, рвотой, судорогами, потерей сознания. Наиболее часто встречаются: 1. болезнь ЛЬЮИСА - ГЛИКОГЕНСИНТЕТАЗА. 2. Болезнь АНДЕРСЕНА - ГЛИКОГЕН-ВЕТВЯЩИЙ фермент. 42. Катаболизм глюкозы в анаэробных условиях. Химизм процесса, биологическая роль. АНАЭРОБНЫЙ ГЛИКОЛИЗ протекает в цитоплазме клеток. Окисление глюкозы или глюкозного остатка гликогена всегда завершается образованием конечного продукта этого процесса- лактата. Окисление глюкозы и глюкозного остатка гликогена в тканях отличается начальных стадиях превращения, до образования глюкозо-6-фосфата. Дальнейшее окисление с этого этапа в тканях как в АНА-, так и в АЭРОБНЫХ условиях полностью совпадает до стадии образования ПИРУВАТА. Процесс АНАЭРОБНОГО ГЛИКОЛИЗА сложный и многоступенчатый: -первая стадия заканчивается образованием из ГЕКСОЗЫ двух ТРИОЗ -ДИОКСИАЦЕТОНФОСФАТА и ГЛИЦЕРАЛЬДЕГИД-3-ФОСФАТА. -Вторая стадия - ГЛИКОЛИТИЧЕСКОЙ ОКСИДОРЕДУКЦИИ. Она сопряжена с образованием АТФ за счёт реакций СУБСТРАТНОГО ФОСФОРИЛИРОВАНИЯ, окислением ГЛИЦРАЛЬДЕГИД -3-ФОСФАТА, восстановлением ПИРУВАТА до ЛАКТАТА. 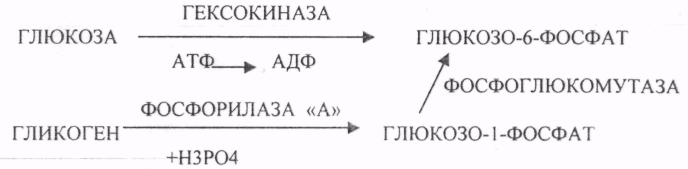 .В процессе превращения глюкозы было израсходовано 2 молекулы АТФ (ГЕКСОКИНАЗНАЯ и ФОСФОФРУКТОКИНАЗНАЯ реакции). С этапа образования ТРИОЗ идёт одновременное их окисление. В результате этих реакций образуется энергия в виде АТФ за счёт реакций СУБСТРАТНОГО ФОСФОРИЛИРОВАНИЯ (ГЛИЦЕРАТКИНАЗНАЯ и ПИРУВАТКИНАЗНАЯ). 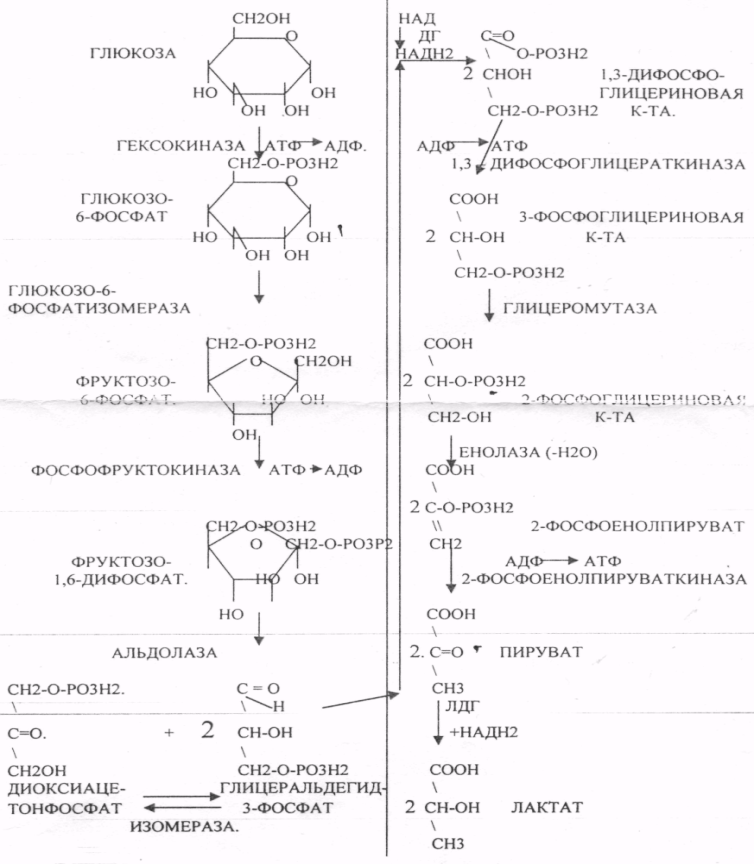 На этапе ГЛИКОЛИТИЧЕСКОЙ ОКСИДОРЕДУКЦИИ идёт окисление ГЛИЦЕРАЛЬДЕГИД-3-ФОСФАТА в присутствии НЗРО4 и НАД- зависимой ДГ. ПВК, принимая НАДН2, восстанавливается с образованием ЛАКТАТА. 43. Катаболизм глюкозы в тканях в аэробных условиях. Гексозодифосфатный путь превращения глюкозы и его биологическая роль. Эффект Пастера. ГЕКСОЗОДИФОСФАТНЫЙ ПУТЬ - это аэробное превращение глюкозы в тканях. При поступлении кислорода в клетки происходит подавление анаэробного ГЛИКОЛИЗА. При этом понижается потребление глюкозы, блокируется образование ЛАКТАТА. Эффект торможения анаэробного гликолиза дыханием получил название эффекта ПАСТЕРА. Процесс окисления начинается в цитоплазме до стадии образования ПИРУВАТА. Затем ПВК поступает в МИТОХОНДРИИ, где в матрице подвергается ОКИСЛИТЕЛЬНОМУ ДЕКАРБОКСИЛИРОВАНИЮ Образующийся АЦЕТИЛ-КОА поступает для дальнейшего окисления в основной метаболический ЦТК КРЕБСА. С участием ферментов ЦТК и сопряженных с ним ферментов дыхательной цепи происходит образование конечных продуктов (СО2 и Н2О) И выделяется 38 АТФ, а при окислении глюкозного остатка гликогена - 39 АТФ. Н2О образуется на этапе превращения:
СО2 образуется на этапе превращения;
АТФ образуется: А. За счет реакций субстратного ФОСФОРИЛИРОВАНИЯ на этапе превращения:
В. За счёт реакций ОКИСЛИТЕЛЬНОГО ФОСФОРИЛИРОВАНИЯ на этапе превращения:
44. Гексозомонофосфатный путь превращения глюкозы в тканях и его биологическая роль. Реакции окислительной стадии образования пентоз. ГЕКСОЗОМОНОФОСФАТНЫЙ ПУТЬ протекает в цитоплазме клетки и представлен 2 ветвями: окислительной и неокислительной. Особенно активно этот путь протекает в тех органах и тканях, в которых активно синтезируются жиры. Биологическая роль этого пути окисления глюкозы анаболическая и связывается прежде всего с производством двух веществ: 1. НАДФ*Н2, который поступает в клетку для реакций синтеза и восстановления веществ. 2. РИБОЗО-5-ФОСФАТА и др. ПЕНТОЗ, которые используются в клетке для синтеза важнейших биологических молекул: ДНК, РНК, НТФ (АТФ, ГТФ, ЦТФ, ТТФ),Н5КОА, НАД, ФАД. Неокислительная стадия ПЕНТОЗНОГО ПУТИ окисления глюкозы даёт субстраты, которые в анаэробных условиях поддерживают ГЛИКОЛИЗ (ФРУКТОЗО-6-ФОСФАТ, ГЛИЦЕРАЛЬДЕГИД-3-ФОСФАТ). Окислительная стадия представляет 5 реакций и предусматривает образование ПЕНТОЗ. ГЕКСОЗОМОНОФОСФАТНЫЙ путь отличается от ГЕКСОЗОДИФОСФАТНОГО пути с этапа превращения глюкозо-6-фосфата. 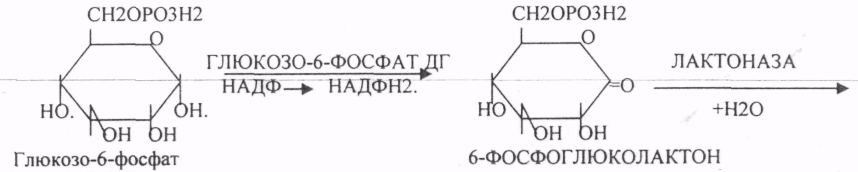 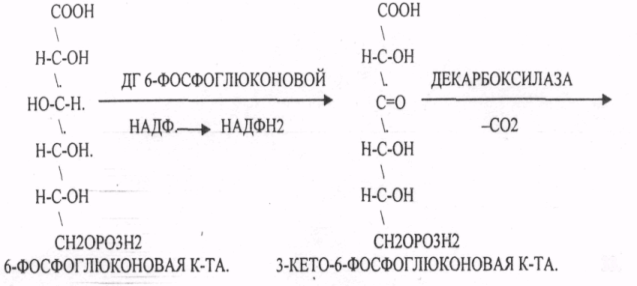  При определенных условиях на этом заканчивается окислительная стадия. Между ПЕНТОЗАМИ устанавливается подвижное равновесие.  45. Пути образования глюкозы в организме. Глюконеогенез. Возможные предшественники, последовательность реакций, биологическая роль. ГЛЮКОНЕОГЕНЕЗ - это биосинтез глюкозы из неуглеводных предшественников, главными из которых являются ПИРУВАТ, ЛАКТАТ, ГЛИЦЕРИН, ряд АК, тем или иным путем превращающиеся в ФУМАРАТ, который в дальнейшем превращается в ЩУК. Другие АК превращаются в ПИРУВАТ. Главным местом синтеза глюкозы является печень. ГЛЮКОНЕОГЕНЕЗ обеспечивает синтез глюкозы, а также возврат ЛАКТАТА, образованного в реакциях анаэробного ГЛИКОЛИЗА, в клеточный фонд углеводов. За счет этого процесса поддерживается уровень глюкозы при углеводном голодании, сахарном диабете. Большинство реакций ГЛЮКОНЕОГЕНЕЗА представляют собой обратные реакции ГЛИКОЛИЗУ, за исключением трёх (ГЕКСОКИНАЗНОЙ, ФОСФОФРУКТОКИНАЗНОЙ, ПИРУВАТКИНАЗНОЙ), которые при ГЛюКОНЕОГЕНЕЗЕ имеют обходные пути. Первая обходная реакция ГЛЮКОНЕОГЕНЕЗА связана с образованием 2-ФОСФОЕНОЛ ПВК и протекает в две стадии:   Вторая обходная реакция связана с образованием фруктозо-6-фосфата. 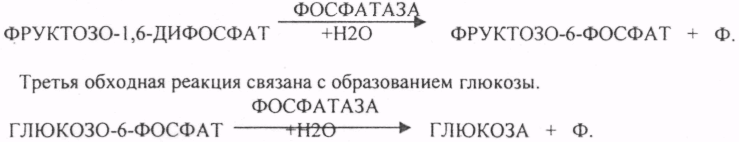 Образовавшаяся глюкоза может вновь использоваться клетками как пластический и энергетический материал, откладываться про запас в виде гликогена. В организме взрослого человека за сутки может быть образованно 80 гр. глюкозы. |
