история. 1. понятие биотрансформации. Виды биокатализаторов
 Скачать 4.48 Mb. Скачать 4.48 Mb.
|
|
ЛЕКЦИИ МИКРОБИОЛОГИЧЕСКАЯ ТРАНСФОРМАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ 25.10.2021 1.ПОНЯТИЕ БИОТРАНСФОРМАЦИИ. ВИДЫ БИОКАТАЛИЗАТОРОВ.Биотрансформация представляет собой процесс химической модификации субстрата в присутствии биологического объекта – биокатализатора. 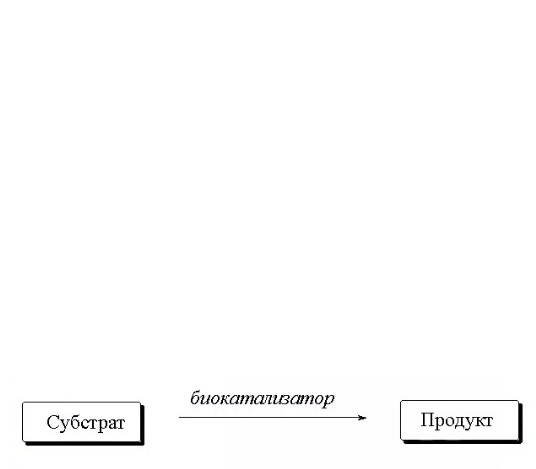 Субстратами в процессах биотрасформации могут выступать различные органические и неорганические соединения. В отличие от процессов биосинтеза, также осуществляемых с помощью биологических объектов, в которых субстрат претерпевает значительные структурные изменения, превращаясь сначала в один из углеродных предшественников и лишь затем в практически важный продукт. В процессах биотрансформации субстрат подвергается лишь небольшим изменениям. Например, практически важная яблочная кислота может быть получена биотрансформацией фумаровой кислоты, в ходе которой к субстрату присоединяется молекула воды. 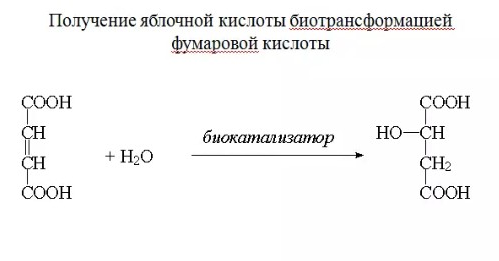 В качестве биокатализаторов используются клетки живых организмов, а также их компоненты, обладающие каталитической активностью. 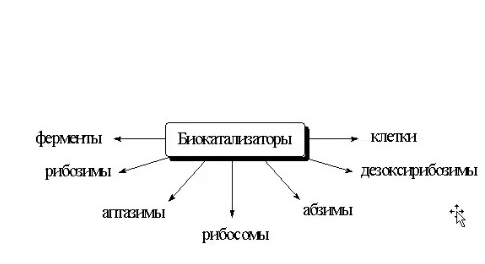 Каталитически активным компонентом клетки, прежде всего, относятся ферменты, имеющие белковую природу. Кроме того, каталитической активностью обладают некоторые молекулы РНК и ДНК, называемые рибозимами и дезоксирибозимами. Рибозимы – это небольшие молекулы РНК, способные осуществляться сплайсинг, в ходе которого из субстрата молекулы РНК вырезается целый фрагмент. При этом не требуется участие какого-либо фермента, поскольку рибозимы сами катализируют этот процесс. Дезоксирибозимы – это небольшие одноцепочечные молекулы ДНК, которые также могут участвовать в модификации молекулы РНК. В качестве биокатализаторов могут участвовать клеточные комплексы, например, рибосомы, осуществляющие внеклеточный синтез белка. Кроме того, на основе клеточных компонентов могут быть созданы искусственные комплексы и молекулы, обладающие каталитической активностью. К ним относятся аптазимы и абзимы. Абзимы – это комплексы, состоящие из моноклонального антитела и фермента. Благодаря антителу, фермент приобретает свойство работать с молекулой субстрата, узнаваемым антителом. 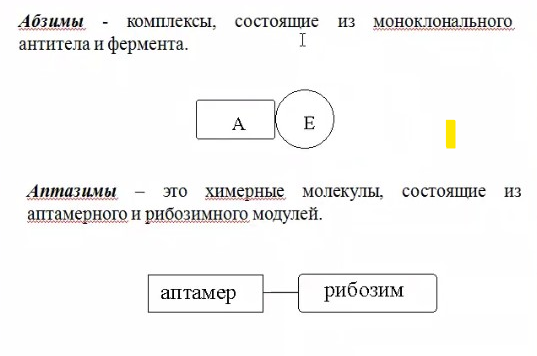 Аптазимы – это химерные молекулы, состоящие из аптамерного и рибозимного модулей.  Аптамеры представляют собой молекулы одноцепочечных нуклеиновых кислот, чьи свойства сравнимы с моноклональными антителами, имеющими белковую природу. Они также могут узнавать определенные молекулы, в связи с чем, каталитическая активность рибозима может регулироваться с помощью небольших молекул: олигонуклеотидов или пептидов, присоединяющихся к регуляторному участку. В настоящее время, наиболее широко в процессах биотрансформации используются препараты ферментов или клетки микроорганизмов. В клеточных катализаторах также работают ферменты, локализованные на поверхности или внутри клетки. В случае грибов и актиномицетов для трансформации могут быть использованы не только вегетативные клетки, но и споры. Многие биотрансформации доведены до промышленного уровня. 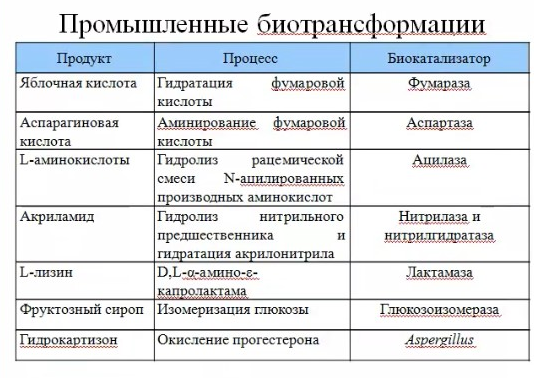 2.ДОСТОИНСТВА И НЕДОСТАТКИ БИОКАТАЛИЗАТОРОВЕсли сравнивать биокатализаторы с катализаторами традиоционно-использующимися в химических синтезах, можно выделить несколько наиболее существенных преимуществ биологических объектов: Во-первых, биокатализаторы могут проявлять высокую избирательность: - субстратную селективность - хемоселективность - региоселективность - энантиселективность Напротив, традиционные катализаторы вообще не проявляют или отличаются неудовлетворительной избирательностью. Субстратная специфичность биокатализатора обусловлена его способностью трансформировать определенные соединения, смеси различных, в том числе, химически родственных соединений. Триозофосфатизомераза изомеризует 3-ФГА в соответствующий кетон, но не превращает гомологичную молекулу рибозо-5-фосфата в рибулозо-5-фосфат. 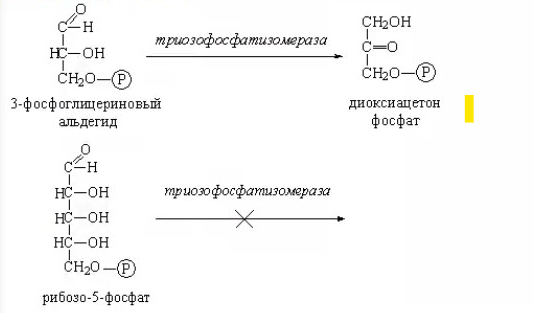 Хемоселективность или функциональная селективность биокатализатора заключается в его способности выборочно воздействовать на одну функциональную группу в присутствии в молекуле другой одинаково или даже более реактивной группы. Например, оксидоредуктазы могут окислять оксиметильную группу субстрата, но не затрагивать его вторичную окси группу. В результате окисления образуется соответствующий альдегид. 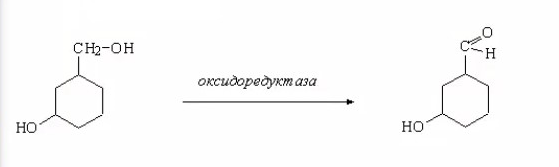 Региоселективность субстрата проявляется в его способности избирательно модифицировать одну из двух или нескольких одинаковых функциональны групп, расположенных в разных местах молекулы. Например, при трансформации адипонитрила, нитрилгидратаза может восстанавливать только одну из двух имеющихся одинаковых нитрильных групп. 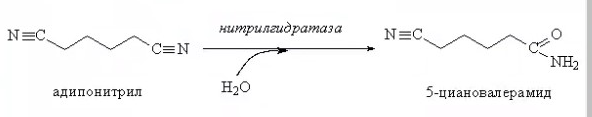 (в результате реакции выделяется аммиак) Энантиоселективность биокатализатора связана с его способностью избирательно трансформировать только один из двух возможных энантиомеров субстрата. Энантиоселективные свойства проявляются в отношении хиральных соединений, у которых имеется хиральных атом углерода, взаимодействующий с четырьмя различными заместителями. Например, аминокислоты и их n-ацилированные производные содержат хиральные центры и могут существовать в виде двух энентиомеров, а именно D и L по старой номенклатуре, или S и R по современной номенклатуре. 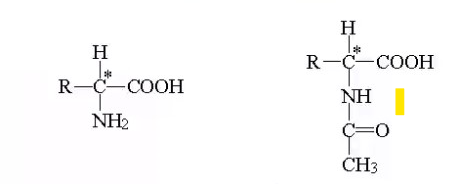 Некоторые ацилазы могут гидролизовать L- энантиомеры эфиров, с образованием L аминокислот. Но практически не работают с D изомерами. 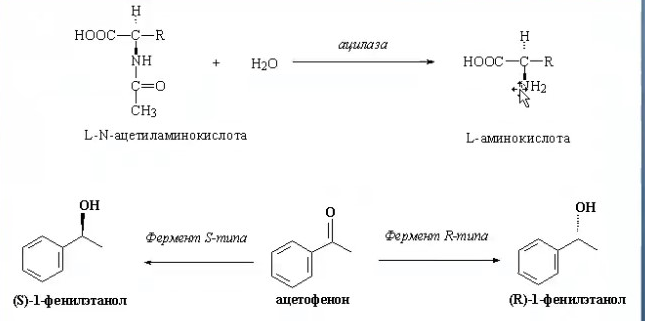 При работе с прохиральными субстратами энантиоселективные биокатализаторы образуют только один из энантиомеров хирального продукта. Например, при восстановлении ацетофенона с помощью энантиоселективных карбонилредуктазами может получиться либо R, либо S энантиомер 1-фениоэтанола в зависимости от типа фермента.  Во-вторых, достоинством биокатализаторов является также то, что они обычно работают при умеренных температурах и давлениях. Это предотвращает протекание нежелательных сопутствующих процессов таких, как спонтанное разложение продуктов реакции, полимеризация веществ. Данные процессы зачастую имеют место в органическом синтезе, выполняющимися более экстремальных условиях. Они не только существенно снижают выход целевого продукта, но и создают серьезные проблемы при его выделении. В-третьих, благодаря высокой субстратной специфичности биокатализаторов, их способности работать в одинаковых условиях можно осуществлять в политрансформации субстрата в одном реакторе. Это весьма важно, поскольку удается осуществить многостадийный синтез без выделения промежуточных продуктов. 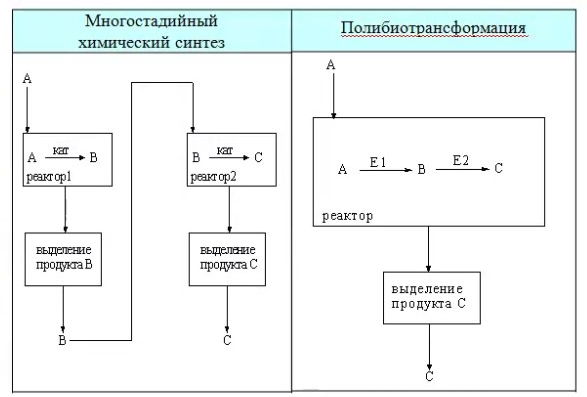 В-четвертых, в отличие от катализаторов на основе тяжелых металлов, биокатализаторы являются биодеградабельными веществами и, следовательно, не накапливаются в окружающей среде, т.е. являются экологически безопасными. В-пятых, биокатализаторы в отличие, например, от металлокомплексных катализаторов имеют более низкую себестоимость, могут быть многократно использованы, а иногда, могут быть даже регенерированы. К существенным недостаткам многих биокатализаторов относятся их низкая стабильность в органических растворителях. Это ограничивает их применение в процессах, которые можно реализовать исключительно в таких условиях. Вместе с тем, известны биокатализаторы, которые могут достаточно эффективность работать не только в неполярных, но и в ряде полярных растворителей. При этом, в органических растворителя некоторые биокатализаторы начинают осуществлять новые превращения, которые нехарактерны для них в естественных водных системах. В частности, к ферментам работающим в органических растворителях относятся липазы. Природными субстратами этих ферментов являются 3-ацилглицириды, однако многие липазы проявляют широкую субстратную специфичность и могут гидролизовать в водных растворах весь разнообразные сложные эфиры. 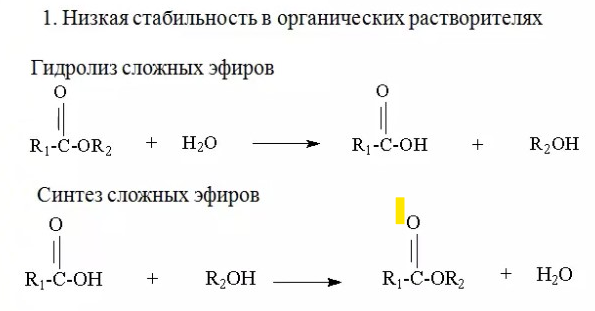 Безводных органических растворителях эти ферменты катализируют обратный процесс, то есть синтез эфиров.  Более того, в органических растворителях у липаз появляются дополнительные возможности синтезировать эфиры в реакциях ацедолиза, алкоголиза, переэтерификации, аминолиза и аммонолиза исходных эфиров. В ходе ацедолиза эфир синтезируется путем взаимодействия с карбоновой кислотой другого исходного эфира под действием липазы. 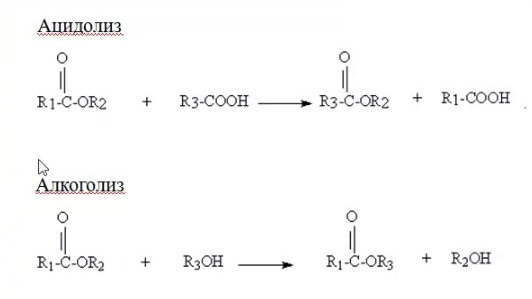 Напротив, при алкоголизе эфир образуется в присутствии спирта.  В случае аминолиза и аммонолиза, вместо спирта используется амин или аммиак. 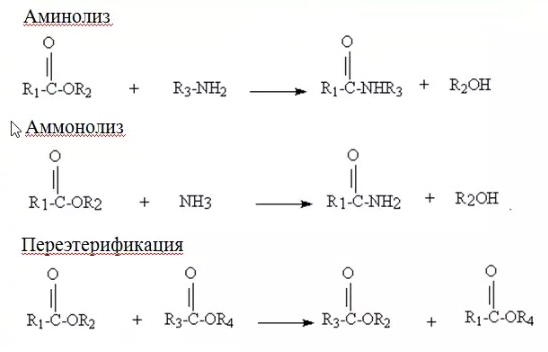 При переэтерификации эфир синтезируется в обменной реакции между двумя исходными эфирами.  В качестве растворителей в процессе этерификации субстратов растворимых гидрофобных неполярных растворителях могут быть использованы такие органические растворители, как гексан, гептан, изооктан. Для субстратов нерастворимых в этих растворителях приходится использовать более полярные растворители, например, хлороформ, толуол, трепбутонол. Однако активность большинства липаз в этих растворителях значительно подавляются. В сильно полярных растворителях таких, как ацетон, диметилформалид, диметилсульфоксид большинство липаз не работает. Стабильность некоторых биокатализаторов в органических растворителях может быть увеличено путем их модификации. Следующим недостатком биокатализаторов, является их способность ингибироваться токсичными продуктами или субстратами реакции. Это ограничивает возможность проведения трансформации в условиях высоких концентраций субстрата и существенно снижает выход целевого продукта. Однако и в этом случае, существуют разнообразные способы защиты биокатализаторов от токсичных соединений. Например, токсичный продукт можно непрерывно выводить из реакционной смечи в ходе трансформации. Также к недостаткам биокатализаторов по сравнению с неорганическими катализаторами можно отнести необходимость более строго контролировать параметры процесса такие, как рН, температура, концентрация солей и другие. Поскольку ферменты наиболее активно работают в довольно узком диапазоне оптимальных условий. |
