история. 1. понятие биотрансформации. Виды биокатализаторов
 Скачать 4.48 Mb. Скачать 4.48 Mb.
|
3.ПОТЕНЦИАЛ ФЕРМЕНТАТИВНЫХ И КЛЕТОЧНЫХ БИОКАТАЛИЗАТОРОВМногие коммерческие биокатализаторы представляют собой очищенные препараты внеклеточных или внутриклеточных ферментов микроорганизмов. Такие биокатализаторы катализируют только одну реакцию и позволяют получать целевой продукт без примесей сопутствующих соединений. Однако очистка ферментов до гомогенного состояния значительно увеличивают себестоимость биокатализатора. Более экономичными являются частично очищенные препараты, но они могут использоваться только в том случае, если в них отсутствуют примеси других ферментов, также трансформирующих субстрат или ферментов, разрушающих целевой продукт. Если же указанные ферменты присутствуют в ферментном препарате, то будут протекать побочные реакции, что приведет к снижению выхода целевого продукта и осложнит последующие его выделения из реакционной смеси. Например, внеклеточные липазы микроорганизмов могут быть представлены изоформами, отличающимися своей энантионаправленностью. Один изофермент гидролизует R энентиомер сложного эфира тогда, как второй изофермент трансформирует S энантиомер. Раздельное применение этих ферментов в процессах гидролиза рацемических эфиров позволяет получать энентиомерные продукты высокой чистоты. Однако совместное использование этих ферментов должно привести к рацемической смеси вторичных спиртов. Рацемическая смесь – это химические вещества, представляющие собой эквимолярную смесь двух энантиомеров (т. е. изомеров, один из которых является зеркальным изображением другого), каждый из которых обладает оптической активностью; другими словами — это химические вещества, представляющие собой эквимолярную смесь оптических антиподов.  При отсутствии мешающих ферментов вместо чистого внеклеточного фермента можно использовать непосредственно культуральную жидкость, из которой удалены клетки. А вместо чистого внутриклеточного фермента можно применять грубый клеточный экстракт , полученный дезинтеграцией клетки.  Более того, зачастую клеточные ферменты не обязательно выделят из биомассы, поскольку они могут активно работать как внутри клетки, так и на ее поверхности. В этом случае, целесообразно использовать в качестве биокатализатора саму клетку. Поскольку при этом существенно снижается себестоимость биокатализатора.  27.10.2021 Использование клеток в качестве биокатализатора имеет дополнительные преимущества. Во-первых, в ряде случае возможно совмещение процессов получения биокатализатора и осуществления биотрансформации в одном реакторе. Так, субстрат можно вводить непосредственно в растущую периодическую культуру микроорганизмов, достигшую определенной фазы роста, в которой проявляется ее максимальная трансформирующая активность. 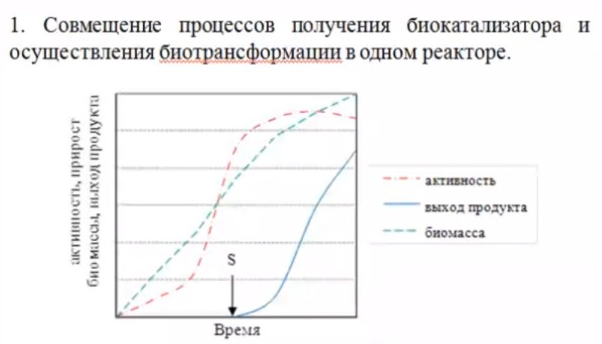 Например, с помощью растущей культуры Micobacterium globiforme можно трансформировать стероид гидрокартизон в преднизолон. 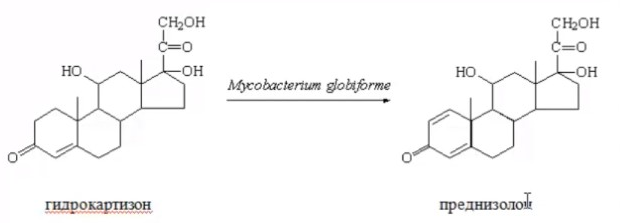 Во-вторых, при использовании клеточных катализаторов отпадает необходимость вводить в реакционную смесь дорогостоящие экзогенные коферменты такие, как NAD, NADF, СоА и другие, поскольку они имеются в клетках. В случае же использования ферментных препаратор без экзогенных препаратор трансформация становится невозможной. Так, с помощью клеточных биокатализаторов целесообразно осуществлять реакции восстановления карбонил содержащих соединений, с помощью NADF-зависимых карбонилредуктаз. 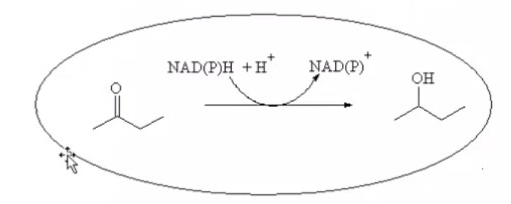 В-третьих, внутри клеток ферменты находятся в нативном (естественном) микроокружении, благоприятном для проявления их максимальной активности. В-четвертых, в клетках фермент защищен от действия агрессивной среды ЦПМ и клеточной стенкой, что делает клеточные биокатализаторы более стабильными, например в органических растворителя по сравнению с очищенным ферментным препаратом. В-пятых, клеточные катализаторы могут бить легко отделены от реакционной массы после окончания трансформации центрифугированием, сепарацией или фильтрованием и возвращены вновь в реактор для повторного использования. Для выделения же ферментов из реакционной смеси с целью возврата в цикл требуется более длительный и затратные операции такие, как осаждение, ультрофильтрация и другие. Для облегчения задачи повторного использования ферментов может понадобиться их иммобилизация на твердых носителях. 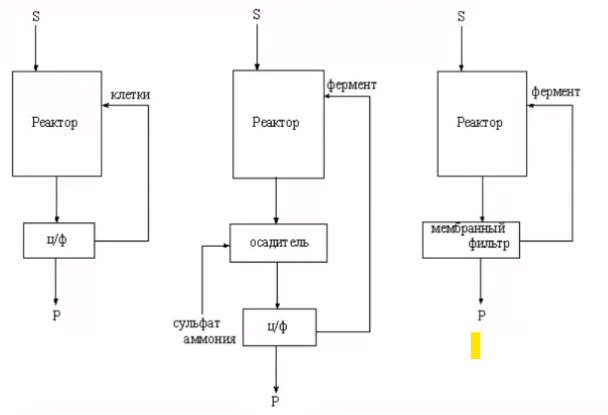 В-шестых, при использовании ферментов в процессах требующих введение экзогенных коферментов сложно или почти невозможно осуществить регенерацию и рецикл этих дорогостоящих компонентов. в настоящее время в системах invitro удается регенерировать только никотинамидинуклеотиды. Например, восстановленная форма этих коферментов можно регенерировать с помощью химических восстановителей, например, флавинмононуклеотид, феназинметасульфат, метилвиологен, дитиотреитол и др. однако стоимость этих восстановителей достаточно высокая. 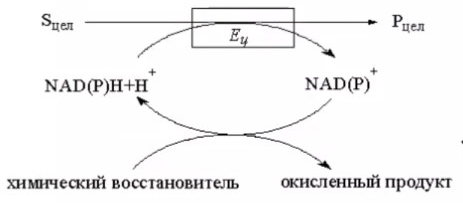 Альтернативным способом является ферментативная регенерация этих коферментов с использованием сопряженного, то есть вспомогательного субстрата, который вводит в реакционную смесь наряду с основным субстратом. Основной субстрат восстанавливается за счет NADFH, а сопряженный субстрат окисляется за счет NADF. В идеальном случае один и тот же целевой фермент может работать с обоими субстратами. 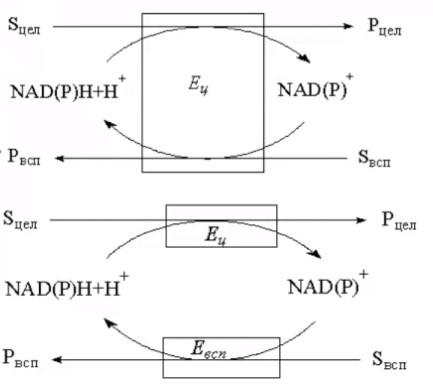 В противном случае приходится вводить второй сопряженный фермент для катализа вспомогательной реакции.  В качестве сопряженного фермента может быть использовано формиатдегидрогеназа, регенерирующая NADH за счет окисления муравьиной кислоты. 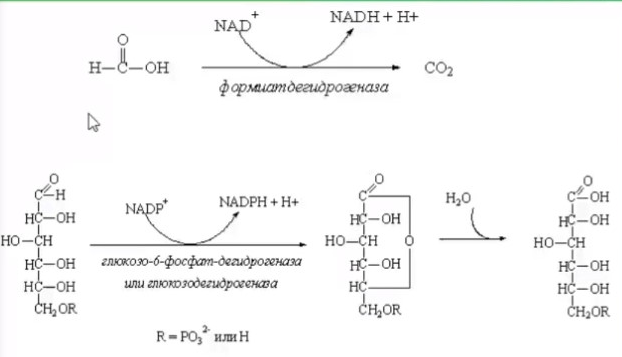 В качестве продукта в этой необратимой реакции образуется СО2, который легко удаляется из реакционной смеси и не создает трудности при выделении целевого продукта. Однако формиатдегидрогеназа не может регенерировать NADFH. Для это наиболее часто используют глюкозо-6-форсфатдегидроеназу или глюкозодегидрогеназу, окисляющий глюокозо-6-фосфат или глюкозу соответственно с образованием нестабильных лактонов, который спонтанной гидролизуются до кислот, что делает ферментативную реакцию необратимой.  Но в этом случае, в среде накапливаются 6-фосфоглюконат или глюконат, которые могут осложнять выделение целевых продуктов трансформации. При использовании клеточных катализаторов отпадает необходимость вводить в реакционную смесь сопряженный фермент, поскольку он имеется в клетке. При наличии вспомогательного субстрата, например этанола, изопропанола, уиклогексанола, глюкозы и других клетки сами будут регенерировать кофермент. 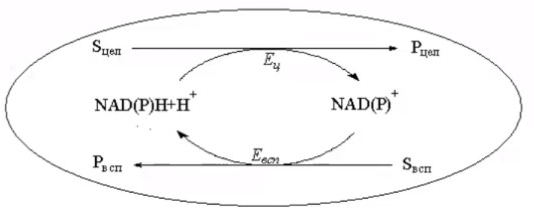 Аналогичные подходы могут быть использованы для регенерации окисленных форм NADF. Клеточные катализаторы самостоятельно могут решать проблемы регенерации и ряда других коферментов. Кроме того, при использовании клеточного биокатализатора отпадает проблема возврата кофермента в реактор, так как она легко решается одновременно с возвратом самого биокатализатора. В случае же ферментных биотрансформаций кофермент необходимо сначала выделить из реакционной смеси и лишь затем можно его использовать повторно. Это не рентабельно. В-седьмых, дополнительным преимуществом некоторых клеточных катализаторов перед ферментными препаратами является легкость регенерации. В процессе работы любого биокатализатора происходит его старение, что выражается снижением его трансформирующей активности. Как правило, после падания активности на 50% биокатализатор следует либо регенерировать, либо заменить новым частично или полностью. Инактивация ферментов может быть вызвана следующими причинами: агрегацией ферментов, сорбцией на стенках реактора, необратимой денатурацией без изменения первичной структуры, изменением первичной структуру. То есть происходит образование S-S связей или наоборот их расщепление, гидролиз пептидных связей, дезаминирование аминокислот и другие изменения. Принципиально возможно регенерация агрегированных и сорбированных белков, а также белков с измененной первичной структурой, в которых образовались ненужные S-S связи, а нужные разрушились. При регенерации такие белки обрабатывают реагентами такими, как β-меркаптоэтанолом, глутотионом, цистеином или дитиотриитолом, которые восстанавливают S-S связи до SH групп в белке, после чего создают условия для их избирательного окисления с образованием S-S мостиков в нужных местах белковой молекулы. Например, окисление воздухом при определенной рН среды. Иногда для разрушения S-S мостиков используют дополнительно хаотропные агенты: гуанидинхлорид или мочевину. Однако в большинстве случаев регенерация ферментных биокатализаторов экономически нецелесообразно. Старение клеточных катализаторов может быть обусловлено как элиминированием целевых ферментов, так и истощением пула нужных коферментов в клетке. Исходный уровень нужного кофермента можно восстановить путем инкубирования клеточного катализатора в присутствии вспомогательного субстрата. Исходный уровень целевого фермента в клетке также легко восстановить в том случае, если клеточный катализатором не утратил свою жизнеспособность. Для регенерации клетки помещают на некоторое время в питательную среду, поддерживающую их рост, а следовательно, обеспечивающую синтез белка. Таким образом, у клеточный катализаторов масса достоинств. Вместе с тем, использование целых клеток может сопровождаться определенными проблемами. |
