ферменты1_razdel_1-23. Понятие фермент. Свойства ферментов. Отличие ферментов от неорганических катализаторов. Ферменты
 Скачать 1.94 Mb. Скачать 1.94 Mb.
|
|
Понятие «фермент». Свойства ферментов. Отличие ферментов от неорганических катализаторов. Ферменты (энзимы) – это биокатализаторы преимущественно белковой природы (иРНК тоже имеют ферментативную активность), которые принимают участие в химических реакциях в организме. Слово «фермент» происходит от слова «fermentatio» - брожение, а энзим – от «enzyme», что означает закваска в дрожжах. Наука, изучающая ферменты, называется энзимологией или ферментологией. Принятые обозначения в энзимологии: Е – фермент, энзим (“еnzуме”). S – субстрат – вещество, на которое действует фермент. Р – продукт реакции – вещество, образовавшееся в результате ферментативной реакции Значение ферментов: ферменты принимают участие в большинстве процессов происходящих в организме – 1) реакциях синтеза и распада веществ, 2) процессах переваривания и всасывания, 3) освобождения энергии, 4) обеспечивают координацию биохимических реакций. Нарушение синтеза или активности ферментов приводит к возникновению болезней. Ферменты располагаются в субклеточных структурах (органеллах) соответственно их функциям. Например: а) в ядре содержатся ферменты преобразования нуклеиновых кислот; б) во внутренней мембране митохондрий – ферменты дыхательной цепи; в) в лизосомах – гидролазы; г) в цитоплазме – ферменты гликолиза, синтеза жирных кислот; д) в матриксе митохондрий – ферменты ЦТК, окислительного декарбоксилирования α-кетокислот, β– окисления жирных кислот; е) плазматическая мембрана содержит ферменты транслоказы, которые переносят через мембрану ионы Nа+ , К+ , глюкозу, аминокислоты и т.д. Свойства ферментов как биокатализаторов: 1) Специфичность (избирательность) действия. а) абсолютная специфичность – фермент катализирует превращение только одного субстрата (один фермент – один субстрат). Пример – уреаза, аргиназа, сахараза, лактаза и др. б) стереоструктурная – фермент катализирует превращение определенного стереоизомера (лактатдегидрогеназа превращает только L-лактат) в) относительная – фермент катализирует превращение группы веществ с одним типом химической связи (один фермент – одна связь). Пример - пептидазы, эстеразы, гликозидазы. 2) Зависимость скорости ферментативной реакции от температуры. Ферментативные реакции, как и все химические реакции, ускоряются при повышении температуры (в 2-4 раза на каждые 10оС). Однако скорость ферментативной реакции имеет свой температурный оптимум, превышение которого приводит к понижению активности ферментов из-за тепловой денатурации их молекул. Для большинства ферментативных реакций температурный оптимум - 38-40оС, а при 50-60оС и выше скорость ферментативных реакций сильно уменьшается из-за разрушения молекул фермента (искл. - миокиназа не инактивируется даже при 100 оС). Зависимость активности ферментов от температуры называется термолабильностью. Ферменты лучше сохраняются при низких температурах – их активность снижается, но денатурации не происходит. Это свойство используется в медицине для производства препаратов ферментов. При некоторых операциях необходимо снизить скорость обмена веществ. Тогда используют охлаждение органов (например, при пересадке почек, сердца и др. органов). 3) Зависимость ферментативной активности от рН среды. Каждый фермент имеет свой рН– оптимум - значение рН, при котором его активность максимальна. Фермент, как и любой белок, имеет в своей структуре ионогенные группы (например, карбоксильные группы или аминогруппы в боковых цепях), а от концентрация ионов водорода зависит их диссоциация и соотношение между положительно и отрицательно заряженными группами. Соотношение между этими группами определяет и пространственное строение молекулы фермента (его конформацию), а следовательно, и его активность. Большинство ферментов наиболее активны при рН=6-8. Исключения - пепсин (рНопт=1,5-2), аргиназа (рНопт=10-11). 4) Ферменты ускоряют как прямую так и обратную реакции (например, лактатдегидрогеназа) 5) Активность ферментов может изменяться под влиянием различных веществ, которые могут повышать (активаторы) или снижать (ингибиторы) скорость катализируемой реакции. 6) Ферменты в отличие от небиологических катализаторов проявляют более высокую активность и проявляют свою способность ускорять реакции в очень маленьких концентрациях (например, одна молекула карбангидразы способна расщепить 36 млн. молекул Н2СO3). 7) Ферменты, как и небиологические катализаторы, катализируют только те реакции, которые подчиняются II закону термодинамики и являются энергетически возможными. Ферменты не входят в состав конечных продуктов реакции, не влияют на константу равновесия реакции, а только увеличивают скорость ее достижения. 1. Скорость ферментативных реакций выше, чем реакций, катализируемых неорганическими катализаторами. 2. Ферменты обладают высокой специфичностью к субстрату. 3. Ферменты по своей химической природе белки, катализаторы - неорганика. 4. Ферменты подвержены регуляции (есть активаторы и ингибиторы ферментов), неорганические катализаторы работают нерегулируемо. 5. Ферменты обладают конформационной лабильностью - способностью к небольшим изменениям своей структуры за счет разрыва и образования новых слабых связей. 6. Ферментативные реакции протекают только в физиологических условиях, т. к. работают внутри клеток, тканей и организма (это определенные значения температуры, давления и рН). Какие вещества называются ферментами? Их химическая природа и строение? Свойства ферментов. Ферменты (энзимы) – это биокатализаторы преимущественно белковой природы (иРНК тоже имеют ферментативную активность), которые принимают участие в химических реакциях в организме. Слово «фермент» происходит от слова «fermentatio» - брожение, а энзим – от «enzyme», что означает закваска в дрожжах. Наука, изучающая ферменты, называется энзимологией или ферментологией. Принятые обозначения в энзимологии: Е – фермент, энзим (“еnzуме”). S – субстрат – вещество, на которое действует фермент. Р – продукт реакции – вещество, образовавшееся в результате ферментативной реакции Значение ферментов: ферменты принимают участие в большинстве процессов происходящих в организме – 1) реакциях синтеза и распада веществ, 2) процессах переваривания и всасывания, 3) освобождения энергии, 4) обеспечивают координацию биохимических реакций. Нарушение синтеза или активности ферментов приводит к возникновению болезней. Молекула фермента взаимодействует с субстратом не всей своей по- верхностью, а определенными участками. На поверхности фермента различают: Активный центр – это участок фермента, который взаимодействует с субстратом. Активных центров может быть 2, 4, 6, 8, в каждый входят 7-15 аминокислот. Наиболее часто в состав активных центров ферментов входят функциональные группы таких аминокислот: - ОН – группы серина, треонина, тирозина; - SН – группы цистеина; - NН – группа гистидина; -СООН – группы глутамата и аспартата; -NН2 – группы аргинина и лизина. В сложных ферментах в активный центр входят кофакторы (небелковые компоненты): простетические группы, коферменты, ионы металлов. Активный центр является комплементарным к строению S, имеется соответствие (комплементарность) Е и S как “ключа и замка”. В структуре активного центра выделяют: • участок, который связывается с субстратом: контактный (“якорный”) участок; • каталитический участок, в состав которого входят химические группы, принимающие непосредственное участие в преобразовании субстрата (-ОН, -SH, =N, -NH3 + , СООН). Кроме активного центра, некоторые ферменты имеют дополнительный, регуляторный, аллостерический (allos – другой, steros – пространственный) центр, с которым взаимодейст- вуют аллостерические регуляторы (эффекторы, модуляторы). Аллостерические эффекторы могут быть позитивными (активаторами), которые повышают каталитическую активность фермента или негативными (ингибиторами), которые ее снижают. Активный и аллостерический центры локализуются на разных субъединицах фермента. При взаимодействии аллостерического центра с эффекторами происходят конформационные изменения активного центра фермента, что приводит к увеличению или снижению его активности. Ферменты, имеющие аллостерический центр, называются регуляторными. Химическая природа и структура ферментов. Большинство ферментов имеют белковую природу, но ферментативной активностью обладает также иРНК (работы Томаса Чека). Доказательства белковой природы ферментов таковы: а) потеря активности при кипя- чении; б) денатурация при УФ и рентгеновском облучении, действии ультразвука, кислот, щелочей, тяжелых металлов; в) гидролиз до аминокислот; г) осаждение под действием солей (высаливание) без потери каталитических свойств; д) высокая молекулярная масса, амфотерные свойства, способность к электрофорезу; е) возможность искусственного синтеза из аминокислот (впервые так была синтезирована рибонуклеаза). Структура ферментов. Ферменты делятся на простые и сложные. Простые ферменты являются белками и состоят только из аминокислот (например, ферменты 3 класса - гидролазы). Сложные ферменты состоят из белкового компонента (апофермента) и небелкового (кофак- тора). Кофактор может быть неорганической (металлы) и органической природы и в зависимости от прочности связи с апоферментом делятся на простетические группы (прочно, ко- валентно связаны с апоферментом) и коферменты (слабо, нековалентно связаны с апоферментом). В целом сложный фермент (апофермент + кофактор) называется холоферментом. Свойства ферментов как биокатализаторов: 1) Специфичность (избирательность) действия. а) абсолютная специфичность – фермент катализирует превращение только одного субстрата (один фермент – один субстрат). Пример – уреаза, аргиназа, сахараза, лактаза и др. б) стереоструктурная – фермент катализирует превращение определенного стереоизомера (лактатдегидрогеназа превращает только L-лактат) в) относительная – фермент катализирует превращение группы веществ с одним типом химической связи (один фермент – одна связь). Пример - пептидазы, эстеразы, гликозидазы. 2) Зависимость скорости ферментативной реакции от температуры. Ферментативные реакции, как и все химические реакции, ускоряются при повышении температуры (в 2-4 раза на каждые 10оС). Однако скорость ферментативной реакции имеет свой температурный оптимум, превышение которого приводит к понижению активности ферментов из-за тепловой денатурации их молекул. Для большинства ферментативных реакций температурный оптимум - 38-40оС, а при 50-60оС и выше скорость ферментативных реакций сильно уменьшается из-за разрушения молекул фермента (искл. - миокиназа не инактивируется даже при 100 оС). Зависимость активности ферментов от температуры называется термолабильностью. Ферменты лучше сохраняются при низких температурах – их активность снижается, но денатурации не происходит. Это свойство используется в медицине для производства препаратов ферментов. При некоторых операциях необходимо снизить скорость обмена веществ. Тогда используют охлаждение органов (например, при пересадке почек, сердца и др. органов). 3) Зависимость ферментативной активности от рН среды. Каждый фермент имеет свой рН– оптимум - значение рН, при котором его активность максимальна. Фермент, как и любой белок, имеет в своей структуре ионогенные группы (например, карбоксильные группы или аминогруппы в боковых цепях), а от концентрация ионов водорода зависит их диссоциация и соотношение между положительно и отрицательно заряженными группами. Соотношение между этими группами определяет и пространственное строение молекулы фермента (его конформацию), а следовательно, и его активность. Большинство ферментов наиболее активны при рН=6-8. Исключения - пепсин (рНопт=1,5-2), аргиназа (рНопт=10-11). 4) Ферменты ускоряют как прямую так и обратную реакции (например, лактатдегидрогеназа) 5) Активность ферментов может изменяться под влиянием различных веществ, которые могут повышать (активаторы) или снижать (ингибиторы) скорость катализируемой реакции. 6) Ферменты в отличие от небиологических катализаторов проявляют более высокую активность и проявляют свою способность ускорять реакции в очень маленьких концентрациях (например, одна молекула карбангидразы способна расщепить 36 млн. молекул Н2СO3). 7) Ферменты, как и небиологические катализаторы, катализируют только те реакции, которые подчиняются II закону термодинамики и являются энергетически возможными. Ферменты не входят в состав конечных продуктов реакции, не влияют на константу равновесия реакции, а только увеличивают скорость ее достижения. Структура и свойства ферментов. Чем обусловлено разнообразие ферментов? Охарактеризуйте специфичность действия ферментов, приведите примеры. Химическая природа и структура ферментов. Большинство ферментов имеют белковую природу, но ферментативной активностью обладает также иРНК (работы Томаса Чека). Доказательства белковой природы ферментов таковы: а) потеря активности при кипя- чении; б) денатурация при УФ и рентгеновском облучении, действии ультразвука, кислот, щелочей, тяжелых металлов; в) гидролиз до аминокислот; г) осаждение под действием солей (высаливание) без потери каталитических свойств; д) высокая молекулярная масса, амфотерные свойства, способность к электрофорезу; е) возможность искусственного синтеза из аминокислот (впервые так была синтезирована рибонуклеаза). Структура ферментов. Ферменты делятся на простые и сложные. Простые ферменты являются белками и состоят только из аминокислот (например, ферменты 3 класса - гидролазы). Сложные ферменты состоят из белкового компонента (апофермента) и небелкового (кофак- тора). Кофактор может быть неорганической (металлы) и органической природы и в зависимости от прочности связи с апоферментом делятся на простетические группы (прочно, ко- валентно связаны с апоферментом) и коферменты (слабо, нековалентно связаны с апоферментом). В целом сложный фермент (апофермент + кофактор) называется холоферментом. Свойства ферментов как биокатализаторов: 1) Специфичность (избирательность) действия. а) абсолютная специфичность – фермент катализирует превращение только одного субстрата (один фермент – один субстрат). Пример – уреаза, аргиназа, сахараза, лактаза и др. б) стереоструктурная – фермент катализирует превращение определенного стереоизомера (лактатдегидрогеназа превращает только L-лактат) в) относительная – фермент катализирует превращение группы веществ с одним типом химической связи (один фермент – одна связь). Пример - пептидазы, эстеразы, гликозидазы. 2) Зависимость скорости ферментативной реакции от температуры. Ферментативные реакции, как и все химические реакции, ускоряются при повышении температуры (в 2-4 раза на каждые 10оС). Однако скорость ферментативной реакции имеет свой температурный оптимум, превышение которого приводит к понижению активности ферментов из-за тепловой денатурации их молекул. Для большинства ферментативных реакций температурный оптимум - 38-40оС, а при 50-60оС и выше скорость ферментативных реакций сильно уменьшается из-за разрушения молекул фермента (искл. - миокиназа не инактивируется даже при 100 оС). Зависимость активности ферментов от температуры называется термолабильностью. Ферменты лучше сохраняются при низких температурах – их активность снижается, но денатурации не происходит. Это свойство используется в медицине для производства препаратов ферментов. При некоторых операциях необходимо снизить скорость обмена веществ. Тогда используют охлаждение органов (например, при пересадке почек, сердца и др. органов). 3) Зависимость ферментативной активности от рН среды. Каждый фермент имеет свой рН– оптимум - значение рН, при котором его активность максимальна. Фермент, как и любой белок, имеет в своей структуре ионогенные группы (например, карбоксильные группы или аминогруппы в боковых цепях), а от концентрация ионов водорода зависит их диссоциация и соотношение между положительно и отрицательно заряженными группами. Соотношение между этими группами определяет и пространственное строение молекулы фермента (его конформацию), а следовательно, и его активность. Большинство ферментов наиболее активны при рН=6-8. Исключения - пепсин (рНопт=1,5-2), аргиназа (рНопт=10-11). 4) Ферменты ускоряют как прямую так и обратную реакции (например, лактатдегидрогеназа) 5) Активность ферментов может изменяться под влиянием различных веществ, которые могут повышать (активаторы) или снижать (ингибиторы) скорость катализируемой реакции. 6) Ферменты в отличие от небиологических катализаторов проявляют более высокую активность и проявляют свою способность ускорять реакции в очень маленьких концентрациях (например, одна молекула карбангидразы способна расщепить 36 млн. молекул Н2СO3). 7) Ферменты, как и небиологические катализаторы, катализируют только те реакции, которые подчиняются II закону термодинамики и являются энергетически возможными. Ферменты не входят в состав конечных продуктов реакции, не влияют на константу равновесия реакции, а только увеличивают скорость ее достижения. Специфичностьферментов. Ферменты обладают высокой специфичностью действия. Это свойство часто существенно отличает их от неорганических катализаторов. Так, мелкоизмельченные платина и палладий могут катализировать восстановление (с участием молекулярного водорода) десятков тысяч химических соединенийразличной структуры. Высокая специфичность ферментов обусловлена, как было отмечено, конфор-мационной и электростатической комплементарностью между молекулами субстрата и фермента и уникальной структурной организацией активного центра, обеспечивающими «узнавание», высокое сродство и избирательность протекания одной какой-либо реакции из тысячи других химических реакций, осуществляющихся одновременно в живых клетках. В зависимости от механизма действия различают ферменты с относительной (или групповой) и абсолютной специфичностью. Так, для действия некоторых гидролитических ферментов наибольшее значение имеет тип химической связи в молекуле субстрата. Например, пепсин в одинаковой степени расщепляет белки животного и растительного происхождения, несмотря на то что эти белки существенно отличаются друг от друга как по химическому строению и аминокислотному составу, так и по физико-химическим свойствам. Однако пепсин не расщепляет ни углеводы, ни жиры. Объясняется это тем, что точкой приложения, местом действия пепсина является пептидная —СО—NH-связь. Для действия липазы, катализирующей гидролиз жиров на глицерин и жирные кислоты, подобным местом является сложноэфирная связь. Аналогичной групповой специфичностью обладают трипсин, химотрипсин, пептидазы, ферменты, гидроли-зующие α-гликозидные связи (но не β-гликозидные связи, имеющиеся в целлюлозе) в полисахаридах, и др. Обычно эти ферменты участвуют в процессе пищеварения, и их групповая специфичность, вероятнее всего, имеет определенный биологический смысл. Относительной специфичностьюнаделены также некоторые внутриклеточные ферменты, например гексокиназа, катализирующая в присутствии АТФфосфорилиро-вание почти всех гексоз, хотя одновременно в клетках имеются и специфические для каждой гексозыферменты, выполняющие такое же фос-форилирование (см. главу 10). Абсолютной специфичностью действия называют способность фермента катализировать превращение только единственного субстрата. Любые изменения (модификации) в структуре субстрата делают его недоступным для действия фермента. Примерами таких ферментов могут служить аргиназа, расщепляющая в естественных условиях (в организме) аргинин, уреаза, катализирующая распад мочевины, и др. Имеются экспериментальные доказательства существования так называемой стереохимической специфичности, обусловленной существованием оптически изомерных L- и D-форм или геометрических (цис-и транс-) изомеровхимических веществ. Так, известны оксидазы L- и D-аминокислот, хотя в природных белках обнаружены только L-ами-нокислоты. Каждый из видов оксидаз действует только на свой специфический стереоизомер. Наглядным примером стереохимической специфичности является бактериальная аспартатдекарбоксилаза, катализирующая отщепление СО2 только от L-аспарагиновой кислоты с превращением ее в L-аланин. Сте-реоспецифичность проявляют ферменты, катализирующие и синтетические реакции. Так, из аммиака и α-кетоглутарата во всех живых организмах синтезируется L-изомер глутаминовой кислоты, входящей в состав природных белков. Если какое-либо соединение существует в форме цис-и транс-изомеров с различным расположением групп атомов вокруг двойной связи, то, как правило, только один из этих геометрических изомеровможет служить в качестве субстрата для действия фермента. Например, фумараза катализирует превращение только фумаровой кислоты (трансизомер), но не действует на малеиновую кислоту (цис-изомер):  Таким образом, благодаря высокой специфичности действия ферменты обеспечивают протекание с большой скоростью лишь определенных химических реакций из огромного разнообразия возможных превращений в микропространстве клеток и целостном организме, регулируя тем самым интенсивность обмена веществ. Химическая природа ферментов. Строение ферментов. Активные центры ферментов. Множественные формы ферментов. В настоящее время получены неопровержимые экспериментальные доказательства белковой природы ферментов. О белковой природе ферментов свидетельствует факт инактивирования (потеря активности) ферментов броженияпри кипячении, установленный еще Л. Пастером. При кипячении наступает необратимая денатурация белка-фермента. Фермент при этом теряет присущее ему свойство катализировать химическую реакцию. Точно так же белкипри кипячении денатурируются и теряют свои биологические свойства (антигенные, гормональные, каталитические). Под влиянием различных физических и химических факторов (воздействие УФ- и рентгеновского излучения, ультразвука, осаждение минеральными кислотами, щелочами, алкалоидными реактивами, солями тяжелых металлови др.) происходит денатурация ферментов, так же как и белков. Ферменты при гидролизе, как и белки, распадаются на аминокислоты, что, бесспорно, служит веским доказательством белковой природы ферментов. Интересные данные, указывающие на белковую природу ферментов, были получены в лаборатории И.П. Павлова. При определении переваривающей способности желудочного сока была обнаружена прямая зависимость между этой способностью и количеством белка в соке. В связи с этим было сделано заключение, что пепсин желудочного сока является белком. Вескими доказательствами белковой природы фермента являются его получение в чистом виде и выделение в форме кристаллов белка. К настоящему времени получено более 1000 кристаллических ферментов. Структура многих из них изучена детально при помощи современных методов химии белков и молекулярной физики [методами рентгеноструктурного анализа, ядерного магнитного резонанса (ЯМР), электронного парамагнитного резонанса (ЭПР) и др.]. Ферменты, как и все белки, обладают рядом свойств, характерных для высокомолекулярных соединений: амфотерностью (могут существовать в растворе в виде анионов, катионов и амфионов); электрофоретической подвижностью благодаря наличию в них положительных и отрицательных зарядов, а в изоэлектрической точке не обнаруживают подвижности в электрическом поле. Ферменты неспособны к диализу через полупроницаемые мембраны. При помощи диализа их растворы можно освободить от низкомолекулярных примесей. Как и белки, они легко осаждаются из водных растворов при низких температурах методами высаливания или осторожным добавлением ацетона, этанола и других веществ и при этом не теряют своих каталитических свойств. Подобно белкам, ферменты имеют большую молекулярную массу – от десятков тысяч до нескольких миллионов (табл. 4.1). 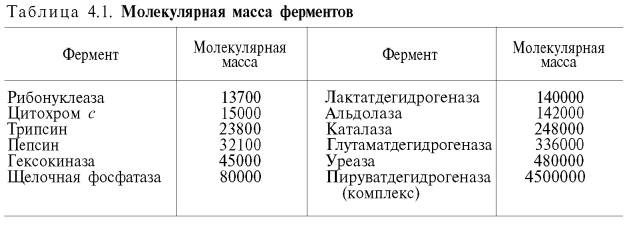 Ферменты оказывают высокоспецифическое действие, что также доказывает их белковую природу, поскольку белки в иммунологическом отношении отличаются крайне высокой специфичностью. Наконец, прямым доказательством белковой природы ферментов является лабораторный синтез первого фермента – рибонуклеазы, осуществленный в 1969 г. в лаборатории Б. Меррифилда в Нью-Йорке. Этот автоматический синтез на твердой фазе состоял в последовательном включении всех 124 аминокислотных остатков в строгом соответствии с последовательностью аминокислот (с первичной структурой) естественного фермента – рибонуклеазы поджелудочной железы. Искусственно синтезированный фермент не отличался от природной рибонуклеазы по химическим, каталитическим и иммунологическим тестам. Принимая во внимание перечисленные обстоятельства, при получении ферментов в чистом виде и при их хранении следует учитывать одно важное свойство белков, а именно стабильность, которая определяется рядом факторов. Одним из общих правил при работе с ферментами является оптимальная температура, обычно соответствующаятемпературе тела, а для препаративных целей – использование температуры около 0°С. Следует, однако, иметь в виду, что несколько ферментов, весьма чувствительных к пониженной температуре, в частности митохондриальный фермент (АТФаза), катализирующий распад АТФ, при 0°С подвергается инактивации, в то время как при комнатной температуре остается стабильным. Большинство ферментов сохраняет стабильность при рН 6,0–8,0, хотя имеются исключения. Для препаративных целей часто прибегают к обезвоживанию фермента(удаление воды) в вакууме из замороженного раствора (метод получил название «лиофилизация»). Осаждение из раствора фер ментов спиртом или ацетоном также проводят при низкой температуре поскольку при комнатной температуре эти процедуры приводят к почти полной потере ферментативной активности. Для стабилизации фермента часто пользуются хелатообразующими агентами: например, к ферменту добавляют этилендиаминтетраацетат (ЭДТА): 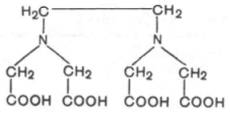 ЭДТА может связывать нежелательные примеси (следы ионов тяжелых металлов: меди, свинца, ртути и др. – в реактивах), тормозящие активность фермента. Одно из непременных условий сохранения стабильности ферментов – хранение их в высушенном или замороженном состоянии (в условиях холода). Многие ферменты стабильны в видесуспензии в концентрированных растворах сульфата аммония. |
