ферменты1_razdel_1-23. Понятие фермент. Свойства ферментов. Отличие ферментов от неорганических катализаторов. Ферменты
 Скачать 1.94 Mb. Скачать 1.94 Mb.
|
Активный центр ферментовПри изучении механизма химической реакции, катализируемой ферментами, исследователя всегда интересует не только определение промежуточных и конечных продуктов и выяснение отдельных стадий реакции, но и природа тех функциональных групп в молекуле фермента, которые обеспечивают специфичность действия фермента на данныйсубстрат (субстраты) и высокую каталитическую активность. Речь идет, следовательно, о точном знании геометрии и третичной структуры фермента, а также химической природы того участка (участков) молекулы фермента, который обеспечивает высокую скорость каталитической реакции. Участвующие в ферментативных реакциях молекулысубстратов часто имеют небольшие размеры по сравнению с молекулами ферментов, поэтому было высказано предположение, что при образовании фермент-субстратных комплексов в непосредственный контакт с молекулойсубстрата, очевидно, вступает ограниченная часть аминокислот пептидной цепи. Отсюда возникло представление об активном центре фермента. Под активным центром подразумевают уникальную комбинацию аминокислотных остатков в молекуле фермента, обеспечивающую непосредственное связывание ее с молекулой субстрата и прямое участие в акте катализа (рис. 4.2). Установлено, что у сложных ферментов в состав активного центра входят также просте-тические группы. В активном центре условно различают так называемый каталитический центр, непосредственно вступающий в химическое взаимодействие с субстратом, и связывающий центр, или контактную («якорную») площадку, которая обеспечивает специфическое сродство к субстрату и формирование его комплекса с ферментом. В свою очередь молекула субстрата также содержит функционально различные участки: например, субстраты эстераз или протеиназ – одну специфическую связь (или группу атомов), подвергающуюся атаке со стороны фермента, и один или несколько участков, избирательно связываемых ферментом. 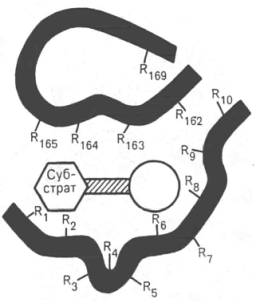 Рис. 4.2. Активный центр фермента (схема) (по Малеру и Кордесу). Темные полосы - участки полипептидной цепи фермента; R - аминокислотные остатки и их порядковые номера (с N-конца). 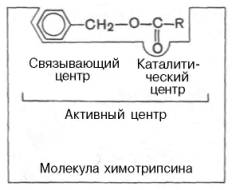 Получены экспериментальные доказательства наличия в активном центре химотрипсина двух остатков гистидина и остатка серина, схематически представленных в трехмерной структурной модели предшественника этого фермента(рис. 4.3). Выявление химической природы и вероятной топографии групп активного центра – проблема первостепенной важности. Она сводится к определению природы аминокислот, их последовательности и взаиморасположения в активном центре. Для идентификации так называемых существенных аминокислотных остатков используют специфические ингибиторы ферментов (часто это субстратподобные вещества или аналоги коферментов), методы «мягкого» (ограниченного) гидролиза в сочетании с химической модификацией, включающей избирательное окисление, связывание, замещение остатков аминокислот и др. 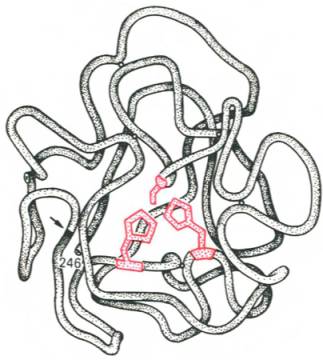 Рис. 4.3. Гипотетическая модель третичной структуры молекулы предшественника химотрипсина (по Ней-рату). Цветом выделены остатки серина и гисти-дина; стрелкой обозначено место отщепления N-концевого участка полипептидной цепи. При помощи методов ингибиторного анализа были предприняты попытки установить закономерности состава и структуры активных центров у ферментов, относящихся к разным группам. В частности, при использованиидиизопропилфторфосфата (ДФФ), принадлежащего к так называемым нервным ядам, наблюдается полное выключение активного центра холинэстеразы – фермента, катализирующего гидролиз ацетилхолина на холин и уксусную кислоту. Оказалось, что этот ингибитор имеет близкое структурное сходство с ацетилхолином и подобно ему взаимодействует с ОН-группой остатка серина в активном центре. Вызывая фосфорилирование серина в активном центре ряда других ферментов, ДФФ также инактивирует их действие: 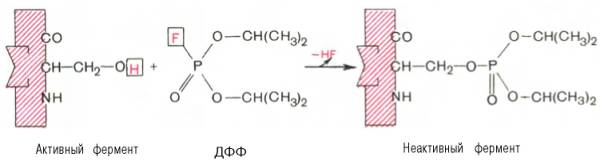 Показано, что ДФФ избирательно фосфорилирует в каждом чувствительном к нему ферменте только один остаток серина, наделенный функциональной активностью. Учитывая этот механизм действия ДФФ, сделаны попытки определения природы аминокислот в окружении «каталитического» остатка серина у ряда ферментов (табл. 4.2). Из данных табл. 4.2 видно, что ферменты, сходные по типу действия, хотя и различаются специфичностью, могут иметь почти одинаковую последовательность аминокислотных остатков в тех участках, которые примыкают к остатку серина, несущему функционально активную гидро-ксильную группу. Существенное значение ОН-группы серина для акта катализа было доказано, кроме того, химическим ее блокированием или удалением, когда эстеразы полностью лишались ферментативной активности.  Предполагают, что формирование активного центра фермента начинается уже на ранних этапах синтеза белка-фермента (см. главу 14) на рибосоме, когда линейная одномерная структура пептидной цепи превращается в трехмерное тело строго определенной конфигурации. Образовавшийся белок приобретает информацию совершенно нового типа, а именно функциональную (в частности, каталитическую). Любые воздействия, приводящие к денатурации, т.е. нарушению третичной структуры, приводят к искажению или разрушению структуры активного центра и соответственно потере ферментом каталитических свойств. Если при подходящих внешних условиях удается восстановить нативную трехмерную структуру белка-фермента (ренатурировать его), то восстанавливается и его каталитическая активность. Это было показано впервые на примере рибо-нуклеазы поджелудочной железы (см. рис. 1.13). Помимо активного центра, в молекуле фермента может присутствовать также аллостерический центр (или центры) (от греч. allos – другой, иной и steros – пространственный, структурный), представляющий собой участок молекулыфермента, с которым связываются определенные, обычно низкомолекулярные, вещества (эффекторы, или модификаторы), молекулы которых отличаются по структуре от субстратов. Присоединение эффектора к аллостерическому центру изменяет третичную и часто также четвертичную структуру молекулы фермента и соответственно конфигурацию активного центра, вызывая снижение или повышение энзимати-ческой активности. Ферменты, активность каталитического центра которых подвергается изменению под влиянием аллостерических эффекторов, связывающихся с аллостерическим центром, получили название аллосте-рических ферментов. Отличительной особенностью ряда аллостерических ферментов является наличие в молекуле олигомерногофермента нескольких активных центров и нескольких аллостерических регуляторных центров, пространственно удаленных друг от друга. В аллостерическом ферменте каждый из двух симметрично построенных протомеров содержит один активный центр, связывающий субстрат S, и один аллостерический центр, связывающий эффектор М2, т.е. 2 центра в одной молекуле фермента (рис. 4.4). Получены доказательства, что для субстратааллостерические ферменты, помимо активного центра, содержат и так называемые эффекторные центры; при связывании с эффекторным центром субстрат не подвергается каталитическому превращению, однако он влияет на каталитическую эффективность активного центра. Подобные взаимодействия между центрами, связывающими лиганды одного типа, принято называть гомотропными взаимодействиями, а взаимодействия между центрами, связывающими лиганды разных типов, – гетеротропными взаимодействиями. Таким образом, приведенные сведения о химической природе активного центра и аллостерических участках свидетельствуют о том, что в энзиматическом катализе, как и в реакции связывания субстрата, участвует не ограниченная и небольшая часть фермента, как предполагалось ранее, а значительно большая часть молекулы белка-фермента. Этими обстоятельствами, вероятнее всего, можно объяснить большие размеры и объемность трехмерной структуры молекулы фермента; эти же обстоятельства следует учитывать в программах создания искусственных низкомолекулярных аналогов ферментов (синзимов), обладающих свойствами на-тивных ферментов(см. ранее). Изоферменты, или изоэнзимы,– это множественные формы фермента, катализирующие одну и ту же реакцию, но отличающиеся друг от друга по физическим и химическим свойствам, в частности по сродству к субстрату, максимальной скорости катализируемой реакции (активности), электрофоретической подвижности или регуляторным свойствам. В живой природе имеются ферменты, молекулы которых состоят из двух и более субъединиц, обладающих одинаковой или разной первичной, вторичной или третичной структурой. Субъединицы нередко называют протомерами, а объединенную олигомерную молекулу – мультимером (рис. 4.5; см. главу 1). Считают, что процесс олигомеризации придает субъединицам белков повышенную стабильность и устойчивость по отношению к действию денатурирующих агентов, включая нагревание, влияние протеиназ и др. Однако на нынешнем этапе знаний нельзя ответить однозначно на вопрос о существенности четвертичной структуры для каталитической активности ферментов, поскольку пока отсутствуют методы, позволяющие в «мягких» условиях разрушить только лишь четвертичную структуру. Применяемые обычно методы жесткой обработки (экстремальные значения рН, высокие концентрации гуанидинхлорида или мочевины) приводят к разрушению не только четвертичной структуры, но и вторичной и третичной структур стабильного олигомерного фермента, протомеры которого оказываются денатурированными и, как следствие этого, лишенными биологической активности. Следует указать на отсутствие ковалентных, главновалентных связей между субъединицами. Связи в основном являются нековалентными, поэтому такие ферменты довольно легко диссоциируют на протомеры. Удивительной особенностью таких ферментов является зависимость активности всего комплекса от способа упаковки между собой отдельных субъединиц. Если генетически различимые субъединицы могут существовать более чем в одной форме, то соответственно и фермент, образованный из двух или нескольких типов субъединиц, сочетающихся в разных количественных пропорциях, может существовать в нескольких сходных, но не одинаковых формах. Подобные разновидности фермента получили название изоферментов (изоэнзимов или, реже, изозимов). В частности, если фермент состоит из 4 субъединиц двух разных типов – Н и М (сердечный и мышечный), то активный фермент может представлять собой одну из следующих комбинаций: НННН, НННМ, ННММ, НМММ, ММММ, или Н4, Н3М, Н2М2, НМ3, М4, соответствующую изоферментам ЛДГ1, ЛДГ2, ЛДГ3, ЛДГ4 и ЛДГ5. При этом синтез Н- и М-типов осуществляется различными генами и в разных органах экспрессируется по-разному. В одних случаях субъединицы имеют почти идентичную структуру и каждая содержит каталитически активный участок (например, β-галакто-зидаза, состоящая из 4 субъединиц). В других случаях субъединицы оказываются неидентичными. Примером последних может служить триптофансинтаза, состоящая из 2 субъединиц, каждая из которых наделена собственной (но не основной) энзиматической активностью, однако, только будучи объединенными в макромолекулярную структуру, обе субъединицы проявляют триптофансинтазную активность. Термин «множественные формы фермента» применим к белкам, катализирующим одну и ту же реакцию и встречающимся в природе в организмах одного вида. Термин «изофермент» применим только к тем множественным формам ферментов, которые появляются вследствие генетически обусловленных различий в первичной структуре белка (но не к формам, образовавшимся в результате модификации одной первичной последовательности). Одним из наиболее изученных 4 ферментов, множественность форм которого детально изучена методом гель-электрофореза, является ЛДГ, катализирующая обратимое превращение пировиноградной кислоты в молочную. Пять изоферментов ЛДГ образуются из 4 субъединиц примерно одинакового размера, но двух разных типов. Поскольку Н-протомеры несут более выраженный отрицательный заряд при рН 7,0–9,0, чем М-протомеры, изофермент, состоящий из 4 субъединиц Н-типа (Н4), при электрофорезе будет мигрировать с наибольшей скоростью в электрическом поле к положительному электроду (аноду). С наименьшей скоростью будет продвигаться к анодуизофермент М4, в то время как остальные изо-ферменты будут занимать промежуточные позиции. Следует подчеркнуть, что изоферменты ЛДГ, обладая почти одинаковой ферментативной активностью, различаются некоторыми физико-химическими свойствами: молекулярной массой, электрофоретической подвижностью, отношением к активаторам и ингибиторам и др., однако для каждой ткани в норме характерно свое соотношение форм (изоферментный спектр) ЛДГ. Например, в сердечной мышце преобладает Н4, т.е. ЛДГ1 , а в скелетных мышцах и печени – М4 (ЛДГ5) (рис. 4.6). Эти обстоятельства широко используют в клинической практике, поскольку изучение появления изоферментов ЛДГ (и ряда других ферментов) в сыворотке крови может представлять интерес для дифференциальной диагностики органических и функциональных поражений органов и тканей. По изменению содержания изоферментов в сыворотке крови можно судить как о топографии патологического процесса, так и о степени поражения органа или ткани. Строение ферментов. Общая характеристика небелковых частей ферментов, их структура, связь с витаминами; примеры. В природе существуют как простые, так и сложные ферменты. Первые целиком представлены полипептидными цепями и при гидролизе распадаются исключительно на аминокислоты. Такими ферментами (простые белки) являются гидролитические ферменты, в частности пепсин, трипсин, папаин, уреаза, лизоцим, рибонуклеаза,фосфатаза и др. Большинство природных ферментов относится к классу сложных белков, содержащих, помимо полипептидных цепей, какой-либо небелковый компонент (кофактор), присутствие которого является абсолютно необходимым для каталитической активности. Кофакторы могут иметь различную химическую природу и различаться по прочности связи с полипептидной цепью. Если константа диссоциации сложного фермента настолько мала, что в растворе все полипептидные цепи оказываются связанными со своими кофакторами и не разделяются при выделении и очистке, то такой фермент получает название холофермента (холоэнзим), а кофактор – простетической группы, рассматривающейся как интегральная часть молекулы фермента. Полипептидную часть фермента принято называть апоферментом. В литературе до сих пор употребляются и другие наименования компонентов сложных ферментов, в частности «фермент-протеид», «белковый компонент» (апофермент), «кофермент» (коэнзим) и «простетическая группа». Под коферментом часто подразумевают дополнительную группу, легко отделяемую от апофермента при диссоциации. Предполагают, что простетическая группа может быть связана с белком ковалентными и неко-валентными связями. Так, в молекуле ацетилкоэнзим-А-карбоксилазы кофактор биотин ковалентно связан с апоферментом посредством амидной связи (см. главу 7). С другой стороны, химические связи между кофакторами и пептидными цепями могут быть относительно слабыми (например, водородные связи, электростатические взаимодействия и др.). В таких случаях при выделении ферментов наблюдается полная диссоциация обеих частей, и изолированый белковый компонент оказывается лишенным ферментативной активности, пока не будет добавлен извне недостающий кофактор. Именно к подобным изолированным низкомолекулярным органическим веществам применим термин «кофермент», типичными представителями которых являются витамины В1, В2, В6, РР, содержащие кофер-менты. Известно также, что и простетические группы, и коферменты активно включаются в химические реакции, выполняя функции промежу-тоных переносчиков электронов, атомов водорода или различных функциональных групп(например, аминных, ацетильных, карбоксильных). В подобных случаях кофермент рассматривают в качестве второго субстрата, или косубстрата. Роль кофермента (Ко) в качестве переносчика, например, атомов водорода может быть представлена в виде схемы, где SH – субстрат, КоЕ – холофермент, А – акцептор протона: 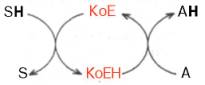 Субстрат подвергается окислению, отдавая электроны и протоны, а КоЕ – восстановлению, принимая электроны и протоны. В следующей полуреакции восстановленный КоЕН может отдавать электроны и протоны на какой-либо другой промежуточный переносчик электронов и протонов или на конечный акцептор (см. главу 9). Коэнзим, кофактор, простетическая группа – двусмысленный биохимический жаргон. До сих пор продолжается терминологический спор, поскольку часто определения «коэнзим», «кофактор» и «простетическая группа» рассматриваются через призму их роли в реакциях энзиматического (ферментативного) катализа. Следует, однако, считаться с тем неоспоримым фактом, что во многих случаях небелковые органические молекулы, как и ионыметаллов, абсолютно необходимы белковому компоненту при выполнении определенной биологической функции, не имеющей отношения к биокатализу. Несомненно, имеют значение также тип и характер связи небелкового компонента с молекулой белка. Поэтому очевидно, что кофактором может служить любой фактор, абсолютно необходимый для выполнения белком его каталитической или любой другой биологической роли. С другой стороны, коферментом может быть любой небелковый фактор, который непосредственно вовлечен в реакцию энзиматического катализа. Кофактор, который непосредственно не участвует в акте катализа, не является коэнзимом. В то же время простетическую группу (ковалентно связанный небелковый компонент, необходимый для определенной функции) можно назвать коферментом, если она непосредственно участвует в энзиматической реакции. Простетическая группа, которая не вовлечена в акт катализа, но функционально является существенным как для фермента, так и для некаталитического белка, может быть названа кофактором. И наконец, кофактор и кофермент, непрочно связанные (или слабо связанные) с ферментом или белком, тем не менее не классифицируются в качестве простетических групп. Многие двухвалентные металлы (Mg2+, Мn2+, Са2+), как будет показано далее, также выполняют роль кофакторов, хотя они не относятся ни к коферментам, ни к простетическим группам. Известны примеры, когда ионы металловпрочно связаны с белковой молекулой, выполняя функции простетической группы. В частности, очищенный фермент, катализирующий окисление аскорбиновой кислоты (витамин С) в дезоксиаскорбиновую кислоту, содержит 8 атомовмеди на одну молекулу; все они настолько прочно связаны с белковой молекулой, что даже не обмениваются с ионообменными смолами и не отделяются методом диализа. Более того, с помощью метода электронного парамагнитного резонанса показано участие ионов меди в промежуточном переносе электронов. Интересно отметить, что свободные ионы меди также наделены каталитической активностью при окислении аскорбиновой кислоты, однако эта активность повышается во многие тысячи раз, если ионы меди соединяются с апофер-ментом в единый комплекс – холофермент. Данные о важнейших коферментах и простетических группах ферментов, включая их наименования и структуру, химическую природу витамина, входящего в их состав, и характер выполняемой биохимической функции в метаболизме, детально рассмотрены в главах 7 и 9–13. Получены доказательства кофакторной функции в ферментативных реакциях и ряда других биологически активных соединений, не относящихся к витаминам: HS-глутатиона, АТФ, липоевой кислоты, производных ну-клеозидов (уридинфосфат, цитидинфосфат, фосфоаденозинфосфосульфат), порфиринсодержащих веществ и др. Сюда же могут быть отнесены тРНК, которые в составе ферментов аминоацил-тРНК-синтетаз принимают активное участие в транспорте аминокислот в рибосоме, где осуществляется синтез белка (см. главу 14). Следует отметить одну отличительную особенность двухкомпонентных ферментов: ни кофактор отдельно (включая большинство коферментов), ни сам по себе апофермент каталитической активностью не наделены, и только их объединение в одно целое, протекающее не хаотично, а в соответствии с программой их структурной организации, обеспечивает быстрое протекание химической реакции. Коферменты – это небелковые компоненты сложных ферментов, которые проявляют высокую химическую активность и входят в состав активных центров сложных ферментов. Классификация коферментов. 1. По химической природе: 1) витаминные; 2) витаминоподобные; 3) невитаминные. 2. По механизму действия: 1) переносчики атомов водорода, электронов и протонов. 2) переносчики отдельных химических групп. Коферменты І группы переносчики атомов водорода, электронов и протонов: А. Невитаминные: гем, глутатион, Б. Витаминные: аскорбиновая кислота (АК), НАД и НАДФ, ФАД и ФМН, 5-дезоксиаденозилкобаламин. В. Витаминоподобные: убихинон (коэнзим Q), липоєвая кислота (ЛК), тетрагидробиоптерин (ТГБП), хиноновые коферменты. Коферменты ІІ группы (переносчики различных химических групп): А. Невитаминные: фосфаты нуклеозидов, фосфаты углеводов. Б. Витаминные: ТДФ, КоА, ПАЛФ, биоцитин, ТГФК, метилкобаламин, витамины К и А Невитаминные коферменты I группы 1. Гем - транспортирует электроны. Структуру гема составляет суперкольцо протопорфирина ІХ, которое состоит из 4 пирольних колец, соединенных метиновыми (-СН-) мостиками; 4-х метильных (-СН3) групп, 2-х винильных групп и 2-х остатков пропионовой кислоты. В центре протопорфиринового ядра находится атом Fе2+. Механизм действия: Благодаря наличию в составе гема атома железа, ферменты содержащие гем способны транспортировать электроны. При этом железо переходит из двухвалентной формы в трехвалентную форму и наоборот: Биологическая роль: гем входит в состав гемсодержащих ферментов: цитохромов (ферменты тканевого дыхания и микросомального окисления), ферментов каталазы и пероксидазы. 3. Глутатион (G-SH) – трипептид, состоит из остатков глутамата, цистеина и глицина (га- ма-глутаминил-цистеинил-глицин) транспортирует атомы водорода. Имеет в своем со- ставе свободную SH-группу цистеина, за счет которой осуществляется перенос атомов водорода или идет присоединение субстратов: 2GSH ↔ GS-SG. Биологическая роль: G-SH в качестве кофермента функционирует в составе ферментов: глутатионпероксидазы и глутатионредуктазы (антиоксидантных ферментов); глутатион-Sтрансферазы, которая обезвреживает токсические ксенобиотики. Витаминоподобные коферменты I группы: 1.Убихинон (коэнзим Q) – липидорастворимый хинон с изопреноидной боковой цепью. Транспортирует атомы водорода и электроны. Входит в состав дыхательной цепи митохондрий. 2.Липоевая кислота. Кофермент принимает участие в реакциях окислительного декарбок- силирования α-кетокислот Входит в состав муль- тиферментных комплексов: пируватдегидрогеназного и α-кетоглутаратдегидрогеназного. 3.ТГБП (тетрагидробиоптерин) переносит атомы водорода и электроны, входит в состав ферментов гидроксилирования: фенилаланингидроксилазы; триптофангидроксилазы. 4. Хиноновые коферменты (пирохинолинхинон, топахинон, триптофан-триптофилхинон) переносят атомы водорода. Образуются при конденсации глутамата и тирозина. Входят в состав ферментов МАО (моноаминооксидаз), вместе с Cu2+: полиаминооксидаз и гистаминаз. Витаминные коферменты I группы: 1. 5-дезоксиаденозил-кобаламин образуется из витамина В12 в митохондриях. Биологичская роль - внутримолекулярный перенос атомов водорода. Входит в состав фермента метилмалонил-КоА-мутазы, который превращает метилмалонил-КоА в сукци- 2.Аскорбиновая кислота нил КоА. (витамин С) образует в организме обратимую редокс систему. Био- химические свойства аскорбиновой кислоты (АК) связаны с ее способностью вступать в окислительно-восстановительные реакции. АК принимает участие в переносе атомов водорода и электронов. При окислении (дегидрировании) АК превращается сначала в свободный радикал АК, потом в дегидроаскорбиновую кислоту, а дальше в 2,3-дикетогулоновую кислоту. Первые реакции являются обратимыми, а последняя реакция ведет к окончательному разрушению АК. Биологическая роль АК: 1.Кофактор реакций гидроксилирования: а). гидроксилирование дофамина в норадреналин, б).гидроксилирование пара-гидроксифенилпирувата в гомогентизиновую кислоту; в) гидроксилирование триптамина в 5-окситриптамин; г) гидроксилирование пролина в гидро- ксипролин и лизина в гидроксилизин в коллагеновых белках (является кофактором пролил- гидроксилазы); д) гидроксилирование γ -бутиробетаина в карнитин; е) гидроксилирование кортикостероидов (наибольшая концентрация АК определяется в надпочечниках) 2. Антиоксидантные функции. а) Взаимодействие со свободными радикалами. АК легко взаимодействует с супероксидным радикалом, превращаясь в де- гидроаскорбиновую кислоту. б) АК катализирует высвобождение иона Fe 2+ из ферритина (последний выполняет роль депо железа в организме): Ферритин-Fe 3+ + АК + 2Н+ → ферритин + Fe 2+ + аскорбат-радикал Далее два аскорбат-радикала превращаются при дисмутации в АК и ДГАК: 2 АК-радикал → АК + ДГАК Регенерация ДГАК в аскорбиновую кислоту идет за счет восстановленного глутатиона, НА- ДH2 и других коферментов переносчиков атомов водорода. 3. Никотинамидные коферменты: Это производные витамина РР, которые используется ферментами – оксидоредуктазами. Наиболее известными являются НАД (никотина- мидадениндинуклеотид) и НАДФ (никотинамидадениндинуклеотидфосфат). Функция НАД и НАДФ состоит в переносе атомов водорода и электронов (эта реакция осуществляется за счет никотинамидной части молекул коферментов). Роль НАД и НАДФ очень велика. Укажем на некоторые процессы, которые идут с уча- стием НАД и НАДФ-зависимых дегидрогеназ: 1) гликолиз (аэробный, анаэробный); 2) декар- боксилирование α-кетокислот; 3) пентозофосфатный цикл (в нем идет синтез НАДФН2); 4) цикл трикарбоновых кислот; 5) β-окисление и синтез жирных кислот; 6) синтез и гидроксили- рование холестерина и стероидов; 7) гидроксилирование ксенобиотиков. Некоферментные функции: Моно-АДФ-рибозилирование белков – это присоедине- ние к белкам одного остатка АДФ-рибозы. Эта реакция вызывает изменению активности фер- ментов и регуляторных белков (белки мышц, АТФ-аза, альдегиддегидрогеназа и другие). Холерный и дифтерийный токсины имеют АДФ-рибозилтрансферазную активность, с чем и связана их высокая токсичность для организма. НАД + Белок → АДФ-рибоза-белок + никотинамид Поли-АДФ-рибозилирование белков клеточных ядер (гистонов, факторов транскрипции) необходимо для регуляции експресии генов, дифференциации клеток. НАД служит источником цикло-АДФ-рибозы, который стимулирует выход кальция и запускает процессы, зависимые от кальция в клетке. 4.Флавиновые коферменты содержат витамин В2 - рибофлавин, который имеет желтый цвет, поэтому они были названы желтыми коферментами. Главными коферментами являются ФМН (флавинмононуклеотид) и ФАД (флавинадениндинуклеотид). Особен- ностью их структуры является то, что они содержат производное рибозы – спирт рибитол .Действующая часть кофермента – флавин (в его основе лежит кольцо изоаллоксазина). Механизм действия ФАД и ФМН состоит в пе- реносе атомов водорода (протонов и электронов). ФАД входит в состав ферментов - флавопротеинов, которые катализируют большое количе- ство разных типов реакций. Выделяют три главных типа реакций: 1) Флавиновые ферменты осуществляют обратимую реакцию дегидрирования (отщепления- присоединения атомов водорода) от субстрата. 2) Флавиновые коферменты катализируют перенос атомов водорода (электронов и протонов) в дыхательной цепи митохондрий, забирая их от восстановленных никотинамидных кофер- ментов (в процессе биологического окисления). 3) Флавиновые коферменты участвуют в свободно-радикальных реакциях. Именно флавиновые коферменты в дыхательной цепи митохондрий, являются основным источник суперок- сидного радикала и пероксида водорода. ФАД + ФАДН2 → ФАДН. (семихинонный флавиновый радикал) ФАДН. + О2 + Н+→ ФАД + Н2О2 ФМН и ФАД входят в состав многих ферментов - сукцинатдегидрогеназа, альдеги- доксидаза, ксантиноксидаза, оксидаза D-аминокислот, моноаминоксидаза. Флавиновые фер- менты принимают участие в β-окислении жирных кислот, в окислении спиртов, альдегидов, глюкозы, аминов, глицерина, пуринов (ксантина, гипоксантина, 6-метилпурина), производ- ных никотина, хинолина, НАДН и НАДФН, амида липоевой кислоты. ФАД участвует в ра- боте пируватдегидрогеназного и альфа-кетоглутаратдегидрогеназного комплексов, в окисле- нии ксенобиотиков. Например, моноаминоксидаза окисляет биогенные амины – гормоны и нейромедиаторы до соответствующих альдегидов: В реакциях, которые протекают с участием кислорода, флавопротеины переносят атомы водорода непосредственно на кислород, что ведет к образованию пероксида водорода. Такие флавопротеины относят к оксидазам (аэробным дегидрогеназам) – моноаминоксидаза, ксантиноксидаза. Характеристика коферментов II группы Невитаминные коферметы 1.Фосфаты нуклеозидов. К ним относятся: АТФ, ГТФ, УТФ, ЦТФ, ТТФ. Механизм действия: транспортируют фосфорные остатки. Биологическая роль: входят в состав ферментов, которые необходимы для включения веществ в дальнейший метаболизм или для образования активных форм веществ, используемых в трансферазных реакциях: 2.Фосфаты углеводов. Механизм действия: транспортируют фосфорные остатки и входят в состав ферментов: глюкозо-фосфат-изомеразы; фосфоглицератмутазы и других. Витаминные коферменты 1.Тиаминдифосфат (ТДФ или тиаминпирофосфат). Кофермент состоит из двух гетероцик- лов (ядра тиазола и пиримидинового цикла) и пирофосфатного остатка. Тиаминдифосфат в со- ставе ферментов катализирует окислительное декарбоксилирование пировиноградной и альфа- кетоглутаровой и перенос гликольальдегидной группы от кетосахаров на альдосахара в составе фермента транскетолазы. 2. Коэнзим А (КоА-SH), кофермент ацилирования (кофермент ацетил- и ацилтрансфераз)- участвует в метаболизме углеводов ( декарбоксилирование пирувата и альфа-кетоглутарата), в реакциях окисления и синтеза жирных кислот, холестерина, гема, ацетилхолина, обезвре- живании чужеродных веществ и др. КоА-SH - это типичный нуклеотид и состоит из адени- лового нуклеотида соединенного с пантотеновой кислотой (витамин В3) и бета- меркаптоэтиламином: Функция КоА- SH состоит в активации и переносе остатков карбоновых кислот СН3 - СООН + АТФ + КоА-SH → СН3- СО∼S-КоА + Н2О Уксусная кислота активная уксусная кислота (ацетил-КоА) 3.Пиридоксальфосфат (ПАЛФ) и пиридоксаминфосфат (ПАМФ) являются производным витамина В6. ПАЛФ принимает участие в реакциях обмена аминокислот, переносит химиче- ские группы (NH2, CO2): а) в составе аминотрансфераз катализирует процессы переаминиро- вания, перенося NH2-группу с аминокисло- ты на кетокислоту; б) в составе декарбок- силаз принимает участие в процесах декар- боксилирования аминокислот с образова- нием биогенных аминов; в) в составе δ- амино-левулинатсинтазы участвует в син- тезе гема; г) участвует во взаимопревраще- ниях глицина и серина. 4.Биоцитин состоит из биотина (витамина В8) и остатка лизина. Биотин это гетероцикл со- стоящий из имидазольного и тиофенового колец. Биоцитин является коферментом фермен- тов карбоксилаз, которые присоединяют СО2 к молекуле карбоновой кислоты с удлинением цепи на 1 атом углерода. 1.Принимает участие в реакциях карбоксилирования с участием АТФ: например, образова- ние малонил-КоА – интермедиата в синтезе жирных кислот или образование щавелевоуксус- ной кислоты, метаболита цикла трикарбоновых кислот. 2.Биоцитин принимает участие в реакциях транскарбоксилирования (без участия АТФ), при которых субстраты обмениваются карбоксильными группами: R1 - COOH + R2H R1H + R2 - COOH 5.Тетрагидрофолиевая кислота (ТГФК). Структура кофермента включает кольцо птериди- на, пара-аминобензойную кислоту (ПАБК) и глутаминовую кислоту. ТГФК синтезируется из витамина В9 (фолиевой кислоты) под действием фермента дигидро- фолатредуктазы, который присое- диняет 4 атома водорода к фолиевой кислоте. Этот фермент ингибирует- ся противоопухолевым препаратом метотрексатом, что ведет к тормо- жению синтеза нуклеотидов, необ- ходимых для репликации ДНК и тормозит рост опухоли. Бактерии в отличие от животных способны самостоятельно синтезировать фолат из предше- ственников – птеринового ядра, ПАБК и глутамата. Сульфаниламидные антимикробные препараты структурно подобны ПАБК и поэтому тормозят синтез ФК, задерживая размно- жение бактерий. Функции ТГФК состоят в межмолекулярном переносе одноуглеродных фрагментов: 1. Метильного (-СН3 ), ТГФК является синергистом другого кофермента – метилкобаламина, который также переносит этот важный остаток. 2. Метиленового ( - СН2 - ) 3. Метинильного ( - СН = ) 4. Оксиметильного ( - СН – ОН ) 5. Формильного ( - СОН ) 6. Форминоиминного ( - СН=NH ) ТГФК принимает участие в обмене аминокислот (синтез метионина из гомоцистеина), в синтезе дезоксирибонуклеотидов (тимидилата для ДНК путем метилирования дУТФ) и пу- риновых ядер (аденина и гуанина), холина, креатина, адреналина. 6.Метилкобаламин синтезируется из витамина В12, структура которого очень сложная и включает кориновое ядро, в центре которого расположен атом кобальта, соединенный с 4 пиррольными кольцами 2 ковалентными и 2 нековалентными связями (хромофорная часть). К ней перпендикулярно присоединяется лиганд-метильный радикал. Метилкобаламин при- нимает участие в метилировании гомоцистеина в метионин. Фермент гомоцистеин- метилтрансфераза переносит метильный радикал из метилтетрагидрофолата на гомоцистеин. 7.Витамин А (ретинол) принимает участие в синтезе гликопротеинов в качестве кофактора гликозилтрансфераз – ферментов, гликозилирующих белки. Переносит олигосахариды через мембрану. Гликопротеины – основа муцинов, которые покрывают слизистые оболочки. Ви- тамин А является антиоксидантом, так как защищает мембраны от действия активных ради- калов. 8.Витамин К - производное нафтохинона. Является кофактором гама-глутамил- карбоксилазы, которая активирует протромбин, превращая его в тромбин. Считается, что ви- тамин К является кофактором 7 факторов свертывания крови и многих белков соединитель- ной ткани и костей. Коферментная функция витамина К состоит в карбоксилировании остат- ков глутаминовой кислоты в белках. Благодаря этому в глутаминовой кислоте появляется дополнительная карбоксильная группа и такой белок приобретает способность связывать ио- ны кальция, что и запускает процесс свертывания крови и другие реакции (например, депо- нирование солей кальция в костях). Вит. К + СО2 + глутамат-белок → Вит. К-эпоксид + гамма-карбоксиглутамат-белок 9.Витамин Е (токоферол) является коферментом десатуразы жирных кислот, а также проявляет мощные антиоксидантные свойства Структура ферментов. Понятие простых и сложных ферментов. Приведите примеры. Апофермент, его структура и роль. Кофермент, его структура и роль. В природе существуют как простые, так и сложные ферменты. Первые целиком представлены полипептидными цепями и при гидролизе распадаются исключительно на аминокислоты. Такими ферментами (простые белки) являются гидролитические ферменты, в частности пепсин, трипсин, папаин, уреаза, лизоцим, рибонуклеаза,фосфатаза и др. Большинство природных ферментов относится к классу сложных белков, содержащих, помимо полипептидных цепей, какой-либо небелковый компонент (кофактор), присутствие которого является абсолютно необходимым для каталитической активности. Кофакторы могут иметь различную химическую природу и различаться по прочности связи с полипептидной цепью. Если константа диссоциации сложного фермента настолько мала, что в растворе все полипептидные цепи оказываются связанными со своими кофакторами и не разделяются при выделении и очистке, то такой фермент получает название холофермента (холоэнзим), а кофактор – простетической группы, рассматривающейся как интегральная часть молекулы фермента. Полипептидную часть фермента принято называть апоферментом. В литературе до сих пор употребляются и другие наименования компонентов сложных ферментов, в частности «фермент-протеид», «белковый компонент» (апофермент), «кофермент» (коэнзим) и «простетическая группа». Под коферментом часто подразумевают дополнительную группу, легко отделяемую от апофермента при диссоциации. Предполагают, что простетическая группа может быть связана с белком ковалентными и неко-валентными связями. Так, в молекуле ацетилкоэнзим-А-карбоксилазы кофактор биотин ковалентно связан с апоферментом посредством амидной связи (см. главу 7). С другой стороны, химические связи между кофакторами и пептидными цепями могут быть относительно слабыми (например, водородные связи, электростатические взаимодействия и др.). В таких случаях при выделении ферментов наблюдается полная диссоциация обеих частей, и изолированый белковый компонент оказывается лишенным ферментативной активности, пока не будет добавлен извне недостающий кофактор. Именно к подобным изолированным низкомолекулярным органическим веществам применим термин «кофермент», типичными представителями которых являются витамины В1, В2, В6, РР, содержащие кофер-менты. Известно также, что и простетические группы, и коферменты активно включаются в химические реакции, выполняя функции промежу-тоных переносчиков электронов, атомов водорода или различных функциональных групп(например, аминных, ацетильных, карбоксильных). В подобных случаях кофермент рассматривают в качестве второго субстрата, или косубстрата. Роль кофермента (Ко) в качестве переносчика, например, атомов водорода может быть представлена в виде схемы, где SH – субстрат, КоЕ – холофермент, А – акцептор протона:  Субстрат подвергается окислению, отдавая электроны и протоны, а КоЕ – восстановлению, принимая электроны и протоны. В следующей полуреакции восстановленный КоЕН может отдавать электроны и протоны на какой-либо другой промежуточный переносчик электронов и протонов или на конечный акцептор (см. главу 9). Коэнзим, кофактор, простетическая группа – двусмысленный биохимический жаргон. До сих пор продолжается терминологический спор, поскольку часто определения «коэнзим», «кофактор» и «простетическая группа» рассматриваются через призму их роли в реакциях энзиматического (ферментативного) катализа. Следует, однако, считаться с тем неоспоримым фактом, что во многих случаях небелковые органические молекулы, как и ионыметаллов, абсолютно необходимы белковому компоненту при выполнении определенной биологической функции, не имеющей отношения к биокатализу. Несомненно, имеют значение также тип и характер связи небелкового компонента с молекулой белка. Поэтому очевидно, что кофактором может служить любой фактор, абсолютно необходимый для выполнения белком его каталитической или любой другой биологической роли. С другой стороны, коферментом может быть любой небелковый фактор, который непосредственно вовлечен в реакцию энзиматического катализа. Кофактор, который непосредственно не участвует в акте катализа, не является коэнзимом. В то же время простетическую группу (ковалентно связанный небелковый компонент, необходимый для определенной функции) можно назвать коферментом, если она непосредственно участвует в энзиматической реакции. Простетическая группа, которая не вовлечена в акт катализа, но функционально является существенным как для фермента, так и для некаталитического белка, может быть названа кофактором. И наконец, кофактор и кофермент, непрочно связанные (или слабо связанные) с ферментом или белком, тем не менее не классифицируются в качестве простетических групп. Многие двухвалентные металлы (Mg2+, Мn2+, Са2+), как будет показано далее, также выполняют роль кофакторов, хотя они не относятся ни к коферментам, ни к простетическим группам. Известны примеры, когда ионы металловпрочно связаны с белковой молекулой, выполняя функции простетической группы. В частности, очищенный фермент, катализирующий окисление аскорбиновой кислоты (витамин С) в дезоксиаскорбиновую кислоту, содержит 8 атомовмеди на одну молекулу; все они настолько прочно связаны с белковой молекулой, что даже не обмениваются с ионообменными смолами и не отделяются методом диализа. Более того, с помощью метода электронного парамагнитного резонанса показано участие ионов меди в промежуточном переносе электронов. Интересно отметить, что свободные ионы меди также наделены каталитической активностью при окислении аскорбиновой кислоты, однако эта активность повышается во многие тысячи раз, если ионы меди соединяются с апофер-ментом в единый комплекс – холофермент. Данные о важнейших коферментах и простетических группах ферментов, включая их наименования и структуру, химическую природу витамина, входящего в их состав, и характер выполняемой биохимической функции в метаболизме, детально рассмотрены в главах 7 и 9–13. Получены доказательства кофакторной функции в ферментативных реакциях и ряда других биологически активных соединений, не относящихся к витаминам: HS-глутатиона, АТФ, липоевой кислоты, производных ну-клеозидов (уридинфосфат, цитидинфосфат, фосфоаденозинфосфосульфат), порфиринсодержащих веществ и др. Сюда же могут быть отнесены тРНК, которые в составе ферментов аминоацил-тРНК-синтетаз принимают активное участие в транспорте аминокислот в рибосоме, где осуществляется синтез белка (см. главу 14). Следует отметить одну отличительную особенность двухкомпонентных ферментов: ни кофактор отдельно (включая большинство коферментов), ни сам по себе апофермент каталитической активностью не наделены, и только их объединение в одно целое, протекающее не хаотично, а в соответствии с программой их структурной организации, обеспечивает быстрое протекание химической реакции. 7. Охарактеризуйте виды сложных ферментов. Что такое олигоферменты, мультиферментные комплексы? Особую группу ферментов составляют надмолекулярные (или мульти-молекулярные) ферментные комплексы, в состав которых входят не субъединицы (в каталитическом отношении однотипные протомеры), а разные ферменты, катализирующие последовательные ступени превращения какого-либо субстрата. Отличительными особенностями подобных муль-тиферментных комплексов являются прочность ассоциации ферментов и определенная последовательность прохождения промежуточных стадий во времени, обусловленная порядком расположения каталитически активных (различных) белков в пространстве («путь» превращения в пространстве и времени). Типичными примерами подобных мультиферментных комплексов являются пируватдегидрогеназа и α-кетоглутаратдегидрогеназа, катализирующие соответственно окислительное декарбоксилирование пиро-виноградной и α-кетоглутаровой кислот в животных тканях, и синтетаза высших жирных кислот. Ассоциация отдельных ферментов в единый недиссоциирующий комплекс имеет определенный биологический смысл и ряд преимуществ. В частности, при этом резко сокращаются расстояния, на которые молекулы промежуточных продуктов должны перемещаться при действии изолированных ферментов. Ряд таких мультиферментных комплексов, иногда называемых ферментными ансамблями, структурно связан с какой-либо органеллой (рибосомы, митохондрии) или с биомембраной и составляет высокоорганизованные надмолекулярные системы, обеспечивающие жизненно важные функции, например тканевое дыхание (перенос электронов от субстратов к кислороду через систему дыхательных ферментов). Мультиферментные комплексы это надмолекулярные образования которые включают, несколько ферментов и коферментов. Они катализируют последовательные этапы реакции преобразования одного субстрата. Биологическое значение мультиферментных комплексов состоит в том, что благодаря их существованию облегчается перенос реагирующих веществ между отдельными ферментами и коферментами, что ускоряет протекание реакций. Мультиферментные комплексы, как правило, формируются на мембранах путем самосборки. Однокомпонентные (мономерные) и двухкомпонентные (олиголимерные) ферменты. По химической природе бывают мономерные (однокомпонентные) ферменты, состоящие только из белковой части и олигомерные (двухкомпонентные), содержащие наряду с белковой частью (апофермент) и небелковую часть (кофактор). В роли кофактора могут выступать: коферменты, непрочно связанные с белковой частью, и простетические группы прочно связанные с белком. Кофактор может быть представлен коферментными формами водорастворимых витаминов (В1, В2, В3, В5, В6, В12, Н) и многими двухвалентными металлами (Mg2 , Mn2 , Ca2 ). 8. Дайте характеристику изоферментов. Приведите примеры. Имеет ли изучение изоферментов для диагностики различных заболеваний? Ответ поясните. |
