ферменты1_razdel_1-23. Понятие фермент. Свойства ферментов. Отличие ферментов от неорганических катализаторов. Ферменты
 Скачать 1.94 Mb. Скачать 1.94 Mb.
|
|
РЕГУЛЯЦИЯ АКТИВНОСТИ ФЕРМЕНТОВ Одним из уникальных свойств живых организмов является удивительная их способность к сохранению сбалансированности катаболических (биодегра-дативных) и анаболических (биосинтетических) процессов. При этом в клетках одновременно совершаются процессы синтеза, распада и взаимопревращения сотен и тысяч разнообразных веществ, которые в свою очередь регулируются множеством механизмов, обеспечивающих постоянство внутренней среды организма. Некоторые из этих регуляторных механизмов, среди которых важная роль принадлежит механизмам регуляции синтеза и каталитической активности ферментов, будут рассмотрены далее. Влияние закона действия масс. В катализируемой ферментом обратимой химической реакции, например А + В <=> С + D, концентрация компонентов реакции и соответственно направление реакции будут регулироваться влиянием закона действия масс. Оно, в частности, может быть показано в обратимой реакции трансаминирования, катализируемой ферментом аланинаминотрансферазой: Аланин + α-Кетоглутарат <=> Пируват + Глутамат. Этот тип регуляции играет, очевидно, лишь ограниченную роль, поскольку в реальных условиях реакция обычно протекает в одном направлении, так как образовавшиеся продукты могут оказаться субстратами для действия других ферментов и выводиться из сферы реакции. В этих случаях устанавливается скорее устойчивое (стационарное) состояние, чем истинное равновесие. Изменение количества фермента. На бактериях хорошо изучен феномен индуцированного (индуцирующего) синтеза ферментов при выращивании их на среде, где единственным источником углерода и энергии служит тот или иной углевод, например глюкоза. Замена в среде глюкозы на лактозу (индуктор) приводит к индуцированному или адаптивному (после небольшого периода лаг-фазы) синтезу фермента галактозидазы (программированному лактозным геном, см. главу 13), расщепляющей лактозу на глюкозу и галактозу. В клетках прокариот и эукариот имеются ферменты, концентрация которых не требует добавления индуктора; это так называемые конститутивные ферменты. Количество фермента в клетке зависит от наличия продукта реакции, катализируемой данным ферментом, причем продукт реакции вызывает торможение синтеза фермента в результате репрессии (см. далее). В животных тканях быстрый синтез ферментов наблюдается реже. Механизм его (индуцирующий синтез) изучен только для небольшого числа ферментов: тирозинтрансаминазы, серин- и треониндегидратазы, триптофанпирролазы и др. – в ответ на введение гормонов или прием белковой пищи. Однако при поступлении в организм некоторых ядов, канцерогенных веществ, алкалоидов, инсектицидов через несколько дней наблюдается резкое повышение активности(соответственно количества) ферментов-гидроксилаз (монооксигеназ) эндоплазматической сети клеток печени, окисляющих чужеродные вещества в нетоксичные для организма продукты. Вполне допустимо предположить, что в этих случаях имеет место синтез ферментов путем индукции (т.е. de novo). Описаны случаи, когда под действием подобных гидроксилаз чужеродные вещества превращаются в организме в более токсичные соединения. Это явление, обратное детоксикации, получило название летального синтеза. Проферменты. Протеолитические ферменты пищеварительного тракта, а также поджелудочной железы синтезируются в неактивной форме – в виде проферментов (зимогенов). Регуляция в этих случаях сводится к превращению проферментов в активные ферменты под влиянием специфических агентов или других ферментов – протеиназ. Так, трипсин в поджелудочной железе синтезируется в форме неактивного трипсиногена. Поступив в кишечник, он превращается в активный трипсин в результате аутокатализа или под действием других протеиназ (механизм активации подробно рассматривается в главе 12). Превращение неактивного пепси-ногена в активный пепсин происходит аутокаталитически в результате специфического ограниченного протеолиза в присутствии соляной кислоты и также связано с отщеплением от профермента специфического ингибитора пептидной природы. Эти превращения зимогенов в активные ферменты связаны с конформационными изменениями молекулы фермента и формированием активного центра или его раскрытием (демаскирование). Синтез протеиназ в неактивной форме и ряда других неактивных белков-предшественников имеет, очевидно, определенный биологический смысл, предотвращая разрушение клеток органов, в которых образуются проферменты. Примерами подобного активирования белков является активирование некоторых гормонов (проинсулин —> инсулин), белка соединительной ткани (растворимый проколлаген превращается в нерастворимый коллаген), белков свертывающей системы крови. 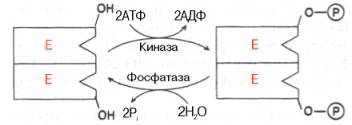 Рис. 4.23. Ковалентная модификация фермента путем фосфорилирования-дефосфо-рилирования остатков серина. 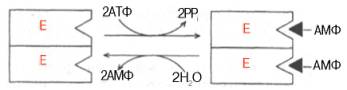 Рис. 4.24. Нековалентная модификация фермента путем аденилирования-деадени-лирования. Химическая модификация фермента. Некоторые белки при формировании третичной структуры подвергаются постсинтетической химической модификации (см. главу 1). Оказалось, что активность ряда ключевых ферментовобмена углеводов, в частности фосфорилазы, гликогенсинтазы и др., также контролируется путем фосфорилирования и дефосфорили-рования, осуществляемого специфическими ферментами – протеинкиназой и протеинфосфатазой, активность которых в свою очередь регулируется гормонами (см. главу 10). Уровень активностиключевых ферментов обмена углеводов и соответственно интенсивность и направленность самих процессов обмена определяются соотношением фосфорилированных и де-фосфорилированных форм этих ферментов. Обычно различают обратимую ковалентную и нековалентную химические модификации ферментов, осуществляемые через ОН-группы серина, реже – тирозина или за счет нековалентных взаимодействий с молекулой фермента. В первом случае активным ферментом оказывается или фосфо-рилированная, или дефосфорилированная форма, как в случае с молекулами мышечной фосфорилазы и гликогенсинтазы соответственно (см. главу 10). В качестве примеров можно в виде схемы представить оба типа модификации, в которой символом Р обозначается остаток фосфата, Pi– неорганический фосфат (Н3РО4), РРi – неорганический пирофосфат (Н4Р2О7), АМФ – остаток адениловой кислоты (рис. 4.23; 4.24). Химическая постсинтетическая модификация ферментов включает, кроме того, процессы ограниченного протеолиза(см. ранее), метилирования (см. главу 13), гликозилирования, уридилирования, аденилирования, АДФ-рибозилирования и др., обеспечивая тем самым микроскопический тип регуляции активности ферментов и соответственно физиологическую скорость процессов обмена веществ. Аллостерическая регуляция. Во многих строго биосинтетических реакциях основным типом регуляции скорости многоступенчатого ферментативного процесса является ингибирование по принципу обратной связи. Это означает, что конечный продукт биосинтетической цепи подавляет активность фермента, катализирующего первую стадию синтеза, которая является ключевой для данной цепи реакции. Поскольку конечный продукт структурно отличается от субстрата, он связывается с аллостери-ческим (некаталитическим) центром молекулы фермента, вызывая ингиби-рование всей цепи синтетической реакции. Предположим, что в клетках осуществляется многоступенчатый биосинтетический процесс, каждая стадия которого катализируется собственным ферментом: Скорость подобной суммарной последовательности реакций в значительной степени определяется концентрациейконечного продукта Р, накопление которого выше допустимого уровня оказывает мощное инги-бирующее действие на первую стадию процесса и соответственно на фермент E1. Впервые существование подобного механизма контроля активности ферментов метаболитами было обнаружено у Е.coli при исследовании синтеза изолейцина и ЦТФ. Оказалось, что изолейцин, являющийся конечным продуктом синтеза, избирательно подавляет активность треонин-дегидратазы, катализирующей первую стадию последовательного процесса превращения треонина в изолейцин, насчитывающего пять ферментативных реакций: 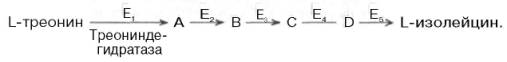 Аналогично ЦТФ как конечный продукт биосинтетического пути оказывает ингибирующий эффект на первый фермент(аспартаткарбамоилтран-сферазу), регулируя тем самым свой собственный синтез (см. главу 13). Этот тип ингибирования получил название ингибирования по принципу обратной связи, или ретроингибирования. Существование его доказано во всех живых организмах. В настоящее время он рассматривается как один из ведущих типов регуляции активности ферментов и клеточного метаболизма в целом. 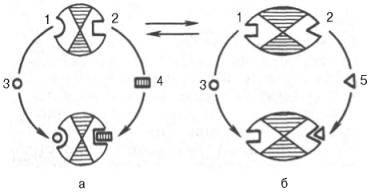 Рис. 4.25. Взаимодействие алло-стерического фермента с субстратом и эффекторами (схема). а - активный комплекс; б - неактивный комплекс; 1 - активный центр; 2 - аллостерический центр; 3 - субстрат; 4 - положительный эффектор; 5 - отрицательный эффектор. С другой стороны, в амфиболических процессах, выполняющих одновременно биосинтетические и биодеградативные функции , доказано существование регуляции как по типу ретроингибирования, так и макроэрги-ческими соединениями – индикаторами энергетического состояния клетки. Для амфиболических процессов уникальным типом регуляции, свойственным только им, является, кроме того, активация предшественником, когда первый метаболит в многоступенчатом пути активирует фермент, катализирующий последнюю стадию. Так, доказано активирующее влияние глюкозо-6-фосфата, являющегося предшественником гликогена, на фермент гликогенсинтазу. Подобные типы ингибирования конечным продуктом и активирования первым продуктом свойственны аллостерическим (регуляторным) ферментам, когда эффектор, модулятор, структурно отличаясь от субстрата, связывается в особом (аллостерическом) центре молекулы фермента, пространственно удаленном от активного центра. Следует, однако, иметь в виду, что модуляторами аллостерических ферментов могут быть как активаторы, так и ингибиторы. Часто оказывается, что сам субстрат оказывает активирующий эффект. Ферменты, для которых и субстрат, и модулятор представлены идентичными структурами, носят название гомотропных в отличие от гетеротропных ферментов, для которых модулятор имеет отличную от субстрата структуру. Взаимопревращение активного и неактивного аллостерических ферментов в упрощенной форме, а также конфор-мационные изменения, наблюдаемые при присоединении субстрата и эффекторов, представлены на рис. 4.25. Присоединение отрицательного эффектора к аллостерическому центру вызывает значительные изменения конфигурации активного центра молекулы фермента, в результате чего фермент теряет сродство к своему субстрату (образование неактивного комплекса). Аллостерические взаимодействия проявляются в характере кривых зависимости начальной скорости реакции от концентрации субстрата или эффектора, в частности в S-образности этих кривых (отклонение от гиперболической кривой Михаэлиса-Ментен). S-образный характер зависимости v от [ S ] в присутствии модулятора обусловлен эффектом кооперативности. Это означает, что связывание одной молекулы субстрата облегчает связывание второй молекулы в активном центре, способствуя тем самым увеличению скорости реакции. Кроме того, для аллостерических регуляторных ферментов характерна нелинейная зависимость скорости реакции от концентрациисубстрата. Другие типы регуляции активности ферментов. Абсолютное количество присутствующего в клетке ферментарегулируется временем его синтеза и распада. К регуляторным механизмам могут быть отнесены также конкуренция ферментов за общий субстрат, выключение активности одного из изоферментов (у множественных форм ферментов), влияние концентра- ций кофакторов и явление компартментализации. Механизм компарт-ментализации метаболических процессов играет, по-видимому, важную биологическую роль, пространственно разъединяя с помощью биомембран ферментысо своими субстратами (например, лизосомальные ферменты: протеиназы, фосфатазы, рибонуклеазы и другие гидролитические ферменты – с цитоплазматическими веществами, на которые они действуют). Кроме того, облегчая независимую регуляцию, этот механизм позволяет разделить несовместимые в одном и том же месте (и, возможно, в одно и то же время) метаболические процессы. Примером последних могут быть пути синтеза высших жирных кислот, протекающие в основном в растворимой фракции цитоплазмы, и пути распада (окисления) жирных кислот, сосредоточенные в митохондриях. Необходимо указать, однако, что при ком-партментализации возникает проблема транспорта как метаболитов, так и восстановительных эквивалентов через биомембраны субклеточных ор-ганелл. Эту задачу решает так называемый челночный механизм, позволяющий перевод метаболитов в формы, способные переходить через мембраны, и обеспечивающий внутриклеточный гомеостаз (см. главу 13). |
