ферменты1_razdel_1-23. Понятие фермент. Свойства ферментов. Отличие ферментов от неорганических катализаторов. Ферменты
 Скачать 1.94 Mb. Скачать 1.94 Mb.
|
СТРОЕНИЕ ФЕРМЕНТОВВ природе существуют как простые, так и сложные ферменты. Первые целиком представлены полипептидными цепями и при гидролизе распадаются исключительно на аминокислоты. Такими ферментами (простые белки) являются гидролитические ферменты, в частности пепсин, трипсин, папаин, уреаза, лизоцим, рибонуклеаза,фосфатаза и др. Большинство природных ферментов относится к классу сложных белков, содержащих, помимо полипептидных цепей, какой-либо небелковый компонент (кофактор), присутствие которого является абсолютно необходимым для каталитической активности. Кофакторы могут иметь различную химическую природу и различаться по прочности связи с полипептидной цепью. Если константа диссоциации сложного фермента настолько мала, что в растворе все полипептидные цепи оказываются связанными со своими кофакторами и не разделяются при выделении и очистке, то такой фермент получает название холофермента (холоэнзим), а кофактор – простетической группы, рассматривающейся как интегральная часть молекулы фермента. Полипептидную часть фермента принято называть апоферментом. В литературе до сих пор употребляются и другие наименования компонентов сложных ферментов, в частности «фермент-протеид», «белковый компонент» (апофермент), «кофермент» (коэнзим) и «простетическая группа». Под коферментом часто подразумевают дополнительную группу, легко отделяемую от апофермента при диссоциации. Предполагают, что простетическая группа может быть связана с белком ковалентными и неко-валентными связями. Так, в молекуле ацетилкоэнзим-А-карбоксилазы кофактор биотин ковалентно связан с апоферментом посредством амидной связи (см. главу 7). С другой стороны, химические связи между кофакторами и пептидными цепями могут быть относительно слабыми (например, водородные связи, электростатические взаимодействия и др.). В таких случаях при выделении ферментов наблюдается полная диссоциация обеих частей, и изолированый белковый компонент оказывается лишенным ферментативной активности, пока не будет добавлен извне недостающий кофактор. Именно к подобным изолированным низкомолекулярным органическим веществам применим термин «кофермент», типичными представителями которых являются витамины В1, В2, В6, РР, содержащие кофер-менты. Известно также, что и простетические группы, и коферменты активно включаются в химические реакции, выполняя функции промежу-тоных переносчиков электронов, атомов водорода или различных функциональных групп(например, аминных, ацетильных, карбоксильных). В подобных случаях кофермент рассматривают в качестве второго субстрата, или косубстрата. Роль кофермента (Ко) в качестве переносчика, например, атомов водорода может быть представлена в виде схемы, где SH – субстрат, КоЕ – холофермент, А – акцептор протона: 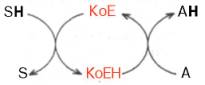 Субстрат подвергается окислению, отдавая электроны и протоны, а КоЕ – восстановлению, принимая электроны и протоны. В следующей полуреакции восстановленный КоЕН может отдавать электроны и протоны на какой-либо другой промежуточный переносчик электронов и протонов или на конечный акцептор (см. главу 9). Коэнзим, кофактор, простетическая группа – двусмысленный биохимический жаргон. До сих пор продолжается терминологический спор, поскольку часто определения «коэнзим», «кофактор» и «простетическая группа» рассматриваются через призму их роли в реакциях энзиматического (ферментативного) катализа. Следует, однако, считаться с тем неоспоримым фактом, что во многих случаях небелковые органические молекулы, как и ионыметаллов, абсолютно необходимы белковому компоненту при выполнении определенной биологической функции, не имеющей отношения к биокатализу. Несомненно, имеют значение также тип и характер связи небелкового компонента с молекулой белка. Поэтому очевидно, что кофактором может служить любой фактор, абсолютно необходимый для выполнения белком его каталитической или любой другой биологической роли. С другой стороны, коферментом может быть любой небелковый фактор, который непосредственно вовлечен в реакцию энзиматического катализа. Кофактор, который непосредственно не участвует в акте катализа, не является коэнзимом. В то же время простетическую группу (ковалентно связанный небелковый компонент, необходимый для определенной функции) можно назвать коферментом, если она непосредственно участвует в энзиматической реакции. Простетическая группа, которая не вовлечена в акт катализа, но функционально является существенным как для фермента, так и для некаталитического белка, может быть названа кофактором. И наконец, кофактор и кофермент, непрочно связанные (или слабо связанные) с ферментом или белком, тем не менее не классифицируются в качестве простетических групп. Многие двухвалентные металлы (Mg2+, Мn2+, Са2+), как будет показано далее, также выполняют роль кофакторов, хотя они не относятся ни к коферментам, ни к простетическим группам. Известны примеры, когда ионы металловпрочно связаны с белковой молекулой, выполняя функции простетической группы. В частности, очищенный фермент, катализирующий окисление аскорбиновой кислоты (витамин С) в дезоксиаскорбиновую кислоту, содержит 8 атомовмеди на одну молекулу; все они настолько прочно связаны с белковой молекулой, что даже не обмениваются с ионообменными смолами и не отделяются методом диализа. Более того, с помощью метода электронного парамагнитного резонанса показано участие ионов меди в промежуточном переносе электронов. Интересно отметить, что свободные ионы меди также наделены каталитической активностью при окислении аскорбиновой кислоты, однако эта активность повышается во многие тысячи раз, если ионы меди соединяются с апофер-ментом в единый комплекс – холофермент. Данные о важнейших коферментах и простетических группах ферментов, включая их наименования и структуру, химическую природу витамина, входящего в их состав, и характер выполняемой биохимической функции в метаболизме, детально рассмотрены в главах 7 и 9–13. Получены доказательства кофакторной функции в ферментативных реакциях и ряда других биологически активных соединений, не относящихся к витаминам: HS-глутатиона, АТФ, липоевой кислоты, производных ну-клеозидов (уридинфосфат, цитидинфосфат, фосфоаденозинфосфосульфат), порфиринсодержащих веществ и др. Сюда же могут быть отнесены тРНК, которые в составе ферментов аминоацил-тРНК-синтетаз принимают активное участие в транспорте аминокислот в рибосоме, где осуществляется синтез белка (см. главу 14). Следует отметить одну отличительную особенность двухкомпонентных ферментов: ни кофактор отдельно (включая большинство коферментов), ни сам по себе апофермент каталитической активностью не наделены, и только их объединение в одно целое, протекающее не хаотично, а в соответствии с программой их структурной организации, обеспечивает быстрое протекание химической реакции. |
