ферменты1_razdel_1-23. Понятие фермент. Свойства ферментов. Отличие ферментов от неорганических катализаторов. Ферменты
 Скачать 1.94 Mb. Скачать 1.94 Mb.
|
Сущность явления катализаФермент, выполняя функцию катализатора химической реакции, подчиняется общим законам катализа и обладает всеми свойствами, характерными для небиологических катализаторов, однако имеет и отличительные, уникальные свойства, которые выделяют их на фоне обычных органических катализаторов гомогенного типа. Обеспечиваются эти свойства особенностями строения ферментов. Сходство ферментов с небиологическими катализаторами заключается в том, что ферменты: 1) катализируют только энергетически возможные реакции, то есть те реакции которые могут протекать и без них; 2) не изменяют направление реакции; 3) не сдвигают равновесие обратимой реакции, а лишь ускоряют его наступление; 4) не расходуются в процессе реакции и выходят из реакции в первоначальном виде. Oтличие ферментов от небиологических катализаторов заключается в том, что: 1) скорость ферментативных реакций выше, чем реакций, катализируемых небелковыми катализаторами (эффективность действия ферментов). Для большинства ферментов характерно то, что 1 молекула фермента может превратить от 1000 до 1 млн молекул субстрата за 1 минуту. Эта скорость недостижима для небиологических катализаторов. 2) ферменты обладают высокой специфичностью действия; 3) ферменты катализируют реакции в очень мягких условиях (обычное давление, нейтральная рН, невысокая t); 4) активность ферментов в клетках строго регулируется как на генетическом уровне, так и посредством определённых низкомолекулярных соединений (субстратов и продуктов реакции, катализируемых этими же ферментами); 15. Общие свойства ферментов. Международная классификация и номенклатура ферментов. Свойства ферментов как биокатализаторов: 1) Специфичность (избирательность) действия. а) абсолютная специфичность – фермент катализирует превращение только одного субстрата (один фермент – один субстрат). Пример – уреаза, аргиназа, сахараза, лактаза и др. б) стереоструктурная – фермент катализирует превращение определенного стереоизомера (лактатдегидрогеназа превращает только L-лактат) в) относительная – фермент катализирует превращение группы веществ с одним типом химической связи (один фермент – одна связь). Пример - пептидазы, эстеразы, гликозидазы. 2) Зависимость скорости ферментативной реакции от температуры. Ферментативные реакции, как и все химические реакции, ускоряются при повышении температуры (в 2-4 раза на каждые 10оС). Однако скорость ферментативной реакции имеет свой температурный оптимум, превышение которого приводит к понижению активности ферментов из-за тепловой денатурации их молекул. Для большинства ферментативных реакций температурный оптимум - 38-40оС, а при 50-60оС и выше скорость ферментативных реакций сильно уменьшается из-за разрушения молекул фермента (искл. - миокиназа не инактивируется даже при 100 оС). Зависимость активности ферментов от температуры называется термолабильностью. Ферменты лучше сохраняются при низких температурах – их активность снижается, но денатурации не происходит. Это свойство используется в медицине для производства препаратов ферментов. При некоторых операциях необходимо снизить скорость обмена веществ. Тогда используют охлаждение органов (например, при пересадке почек, сердца и др. органов). 3) Зависимость ферментативной активности от рН среды. Каждый фермент имеет свой рН– оптимум - значение рН, при котором его активность максимальна. Фермент, как и любой белок, имеет в своей структуре ионогенные группы (например, карбоксильные группы или аминогруппы в боковых цепях), а от концентрация ионов водорода зависит их диссоциация и соотношение между положительно и отрицательно заряженными группами. Соотношение между этими группами определяет и пространственное строение молекулы фермента (его конформацию), а следовательно, и его активность. Большинство ферментов наиболее активны при рН=6-8. Исключения - пепсин (рНопт=1,5-2), аргиназа (рНопт=10-11). 4) Ферменты ускоряют как прямую так и обратную реакции (например, лактатдегидрогеназа) 5) Активность ферментов может изменяться под влиянием различных веществ, которые могут повышать (активаторы) или снижать (ингибиторы) скорость катализируемой реакции. 6) Ферменты в отличие от небиологических катализаторов проявляют более высокую активность и проявляют свою способность ускорять реакции в очень маленьких концентрациях (например, одна молекула карбангидразы способна расщепить 36 млн. молекул Н2СO3). 7) Ферменты, как и небиологические катализаторы, катализируют только те реакции, которые подчиняются II закону термодинамики и являются энергетически возможными. Ферменты не входят в состав конечных продуктов реакции, не влияют на константу равновесия реакции, а только увеличивают скорость ее достижения. 3. Номенклатура ферментов принята V Международным конгрессом биохимиков (1961). 1. Систематическая номенклатура. Название фермента включает: химическое название субстрата; тип химической реакции (в соответствии с международной классификацией ферментов); суффикс «-аза». Например: L-Лактат:НАД+ - оксидоредуктаза. 2. Рабочая номенклатура. Название фермента образуется из химического названия субстра- та с добавлением суффикса «-аза» либо из названия химического превращения субстрата с добавлением суффикса «-аза». Например: lipos (жир), фермент катализирующий его превращение называется «липаза». Лактатдегидрогеназа - это рабочее название фермен- та L-Лактат:НАД+ - оксидоредуктазы. 3. Тривиальное (исторически сложившиеся) название. Не дает представления о субстрате или типе химического превращения. Пример - пепсин, тромбин, трипсин, ренин. Согласно систематической номенклатуре каждому ферменту был дан код (шифр), со- стоящий из 4х цифр, которые обозначают: 1-класс, 2-подкласс, 3-подподкласс, 4-порядковый номер фермента в подподклассе. Например: 1.1.1.27 - лактатдегидрогеназа, которая относит- ся к I классу – оксидоредуктазам. 4.Классификация ферментов (построена по типу химических реакций): 1.класс – оксидоредуктазы: катализируют окислительно-восстановительные процессы - (дегидрогеназы, оксидазы, цитохромы). 2.класс – трансферазы: катализируют реакции переноса химических групп, название берут от группы, которую переносят (метилтрансферазы, сульфотрансферазы, аминотрансферазы, фосфотрансферазы, ацилтрансферазы). 3.класс – гидролазы: катализируют реакции гидролиза, т.е. расщепление субстрата с участи- ем воды (пептидазы, эстеразы, фосфатазы, гликозидазы). 4.класс – лиазы: катализируют реакции расщепления ковалентных связей между атомами C, O, N, S негидролитическим путем (декарбоксилазы, альдолазы, дегидратазы). 5.класс – изомеразы: катализируют реакции изомеризации (эпимеразы, рацемазы, изомера- зы). 6.класс – лигазы: (синтетазы) катализируют реакции синтеза молекул за счет энергии АТФ (АТФ-синтаза, пируваткарбоксилаза). 16. Понятие «фермент». Классификация и номенклатура ферментов. Приведите примеры. Ферменты (энзимы) – это биокатализаторы преимущественно белковой природы (иРНК тоже имеют ферментативную активность), которые принимают участие в химических реакциях в организме. Слово «фермент» происходит от слова «fermentatio» - брожение, а энзим – от «enzyme», что означает закваска в дрожжах. Наука, изучающая ферменты, называется энзимологией или ферментологией. Принятые обозначения в энзимологии: Е – фермент, энзим (“еnzуме”). S – субстрат – вещество, на которое действует фермент. Р – продукт реакции – вещество, образовавшееся в результате ферментативной реакции Значение ферментов: ферменты принимают участие в большинстве процессов происходящих в организме – 1) реакциях синтеза и распада веществ, 2) процессах переваривания и всасывания, 3) освобождения энергии, 4) обеспечивают координацию биохимических реакций. Нарушение синтеза или активности ферментов приводит к возникновению болезней. Номенклатура ферментов принята V Международным конгрессом биохимиков (1961). 1. Систематическая номенклатура. Название фермента включает: химическое название субстрата; тип химической реакции (в соответствии с международной классификацией ферментов); суффикс «-аза». Например: L-Лактат:НАД+ - оксидоредуктаза. 2. Рабочая номенклатура. Название фермента образуется из химического названия субстра- та с добавлением суффикса «-аза» либо из названия химического превращения субстрата с добавлением суффикса «-аза». Например: lipos (жир), фермент катализирующий его превращение называется «липаза». Лактатдегидрогеназа - это рабочее название фермен- та L-Лактат:НАД+ - оксидоредуктазы. 3. Тривиальное (исторически сложившиеся) название. Не дает представления о субстрате или типе химического превращения. Пример - пепсин, тромбин, трипсин, ренин. Согласно систематической номенклатуре каждому ферменту был дан код (шифр), со- стоящий из 4х цифр, которые обозначают: 1-класс, 2-подкласс, 3-подподкласс, 4-порядковый номер фермента в подподклассе. Например: 1.1.1.27 - лактатдегидрогеназа, которая относит- ся к I классу – оксидоредуктазам. 4.Классификация ферментов (построена по типу химических реакций): 1.класс – оксидоредуктазы: катализируют окислительно-восстановительные процессы - (дегидрогеназы, оксидазы, цитохромы). 2.класс – трансферазы: катализируют реакции переноса химических групп, название берут от группы, которую переносят (метилтрансферазы, сульфотрансферазы, аминотрансферазы, фосфотрансферазы, ацилтрансферазы). 3.класс – гидролазы: катализируют реакции гидролиза, т.е. расщепление субстрата с участи- ем воды (пептидазы, эстеразы, фосфатазы, гликозидазы). 4.класс – лиазы: катализируют реакции расщепления ковалентных связей между атомами C, O, N, S негидролитическим путем (декарбоксилазы, альдолазы, дегидратазы). 5.класс – изомеразы: катализируют реакции изомеризации (эпимеразы, рацемазы, изомера- зы). 6.класс – лигазы: (синтетазы) катализируют реакции синтеза молекул за счет энергии АТФ (АТФ-синтаза, пируваткарбоксилаза). 17. Классификация ферментов по типу катализируемой химической реакции (6 классов ферментов). Охарактеризуйте эти классы, приведите примеры. .Классификация ферментов (построена по типу химических реакций): 1.класс – оксидоредуктазы: катализируют окислительно-восстановительные процессы - (дегидрогеназы, оксидазы, цитохромы). 2.класс – трансферазы: катализируют реакции переноса химических групп, название берут от группы, которую переносят (метилтрансферазы, сульфотрансферазы, аминотрансферазы, фосфотрансферазы, ацилтрансферазы). 3.класс – гидролазы: катализируют реакции гидролиза, т.е. расщепление субстрата с участи- ем воды (пептидазы, эстеразы, фосфатазы, гликозидазы). 4.класс – лиазы: катализируют реакции расщепления ковалентных связей между атомами C, O, N, S негидролитическим путем (декарбоксилазы, альдолазы, дегидратазы). 5.класс – изомеразы: катализируют реакции изомеризации (эпимеразы, рацемазы, изомеразы). 6.класс – лигазы: (синтетазы) катализируют реакции синтеза молекул за счет энергии АТФ (АТФ-синтаза, пируваткарбоксилаза). 18. Что такое «ингибиторы» и «активаторы» ферментов. Виды ингибирования. Активаторы и ингибиторы ферментов 1. Активаторы – вещества, которые повышают скорость ферментативных реакций, увеличивают активность ферментов. Они бывают органической и неорганической природы. Активаторы органической природы: желчные кислоты (активируют поджелудочную ли- пазу), энтерокиназа (активирует трипсиноген), глутатион, цистеин, витамин С (повышают активность оскидоредуктаз). Активаторы неорганической природы: например, HCl активирует пепсиноген, ионы ме- таллов (Na, Cl, K, Mg, Mn, Zn) активируют очень многие ферменты. Ионы металлов: а) спо- собствуют образованию фермент-субстратного комплекса; б) служат донорами и акцептора- ми электронов; в) принимают участие в образовании активного центра ферментов (Zn - в со- ставе карбангидразы, Fe – в составе цитохромов, каталазы, пероксидазы); г) выступают в ро- ли аллостерических регуляторов. 2. Ингибиторы – вещества, которые уменьшают активность ферментов и замедляют химические реакции. Различают обратимое и необратимое ингибирование: Если ингибитор связывается с молекулой фермента слабыми связями (Е+И ↔ ЕИ) то такой ингибитор легко удаляется и активность фермента восстанавливается; Если ингибитор связывается с молекулой фермента прочными ковалентными связями (Е+И → ЕИ), то наступает необратимое подавление активности фермента Необратимое ингибирование происходит при денатурация ферментов-белков под действием концентрированных кислот и щелочей, солей тяжелых металлов, ультрафиолетовом облучении. Некоторые ингибиторы образуют прочные недиссоциируемые связи с функцио- нальными группами в активных центрах ферментов. Например, цианиды связываются с железом в ферментах-гемопротеинах. Фосфорорганические яды (табун, зарин, V-газы) образу- ют прочные связи с остатками серина и треонина входящими в состав многих ферментов. Обратимое ингибирование делится на конкурентное и неконкурентное. Конкурентное ингибирование вызывается веществами, структурно сходными с субстратом и взаимодействующими с активным центром фермента. Например, малоновая кислота, является конку- рентным ингибитором сукцинатдегидрогеназы, поскольку похожа на янтарную кислоту (также имеет 2 карбоксильных группы). Поэтому, малоновая кислота легко связывается с активным центром сукцинатдегидрогеназы, вытесняя оттуда субстрат – янтарную кислоту. Однако, фермент неспособен это сделать с малоновой кислотой, которая короче на 1 атом углерода. Поэто- му если прибавить ма- лоновую кислоту в концентрации, превы- шающей концентрацию янтарной кислоты, то реакция прекратится, поскольку малонат заблокирует активный центр сукцинатдегидрогеназы Конкурентные ингибиторы нередко используются в качестве лекарственных средств. Например, антимикробные препараты сульфаниламиды являются структурными аналогами пара-аминобензойной кислоты из которой микроорганизмы синтезируют необходимый им для размножение витамин В9 (фолиевую кислоту). Многие антибиотики конкурентно тормо- зят синтез белка микроорганизмами или репликацию ДНК. Потивоопухолевые препараты (метотрексат, антагонист витамина В9) блокирует репликацию ДНК в опухолевых клетках. Неконкурентные ингибиторы не имеют структурного сходства к субстрату и при- соединяются не к активному центру, а к другим участкам, в том числе и к аллостерическому центру. Ингибирование происходит вследствие разрушения или необратимой химической модификации функциональных групп ферментов. Примеры: а) алкилирующие агенты (йодацетамид) необратимо реагируют с SН–группами ферментов Е–SH + I-CH2-CО-NH2 → E–S-CH2 –CО-NH2 + HI (фермент) (йодацетамид) комплекс фермент-ингибитор б) препараты ФОС (фосфорорганических соединений) это высокотоксичные яды для насекомых и теплокровных животных. Они взаимодействуют с гидроксигруппой серина в активном центре фермента ацетилхолинэстеразы: в) тетурам – ингибитор ацетальдегиддегидрогеназы (используют при лечении алкоголизма). 19. Ингибирование работы ферментов. Применение ингибирования в медицине. Ингибиторы ферментов обычно принято делить на два больших класса: обратимые и необратимые. Это вещества, вызывающие частичное (обратимое) или полное торможение реакций, катализируемых ферментами. Недавно открыты антиферменты (антиэнзимы, или антизимы), представляющие собой белки (или полипептиды), действующие как ингибиторы ферментов. К подобным веществам относятся, например, ингибитор трипсина, обнаруженный в соевых бобах, и сывороточный антитрипсин. Недавно открыт в печени животных антифермент орнитинде-карбоксилазы (см. главу 12). Антизимы, вероятнее всего, образуют трудно-диссоциируемые комплексы с соответствующими ферментами, выключая их из химических реакций. Иногда ингибитор является составным компонентом предшественника фермента, например пепсина (см. главу 12), или входит в состав сложных комплексов ферментов, например в состав протеинкиназы и протеинфосфатазы, катализирующих процессы фосфо-рилирования-дефосфорилирования в живых организмах. Однако до сих пор не выяснено, являются ли подобные антиферментыистинными ингибиторами или регуляторными субъединицами, в частности, какова разница в назначении регуляторной (R) субъединицы в составе протеинкиназы и ингибиторной (I) субъединицы в составе протеинфосфатазы. Ферменты являются белками, поэтому любые агенты, вызывающие денатурацию белка (кислоты, щелочи, солитяжелых металлов, нагревание), приводят к необратимой инактивации фермента. Однако подобное инак-тивирование относительно неспецифично, оно не связано с механизмом действия ферментов. Гораздо большую группу составляют так называемые специфические ингибиторы, которые оказывают свое действие на какой-либо один фермент или группу родственных ферментов, вызывая обратимое или необратимое ингибирование. Исследование этих ингибиторов имеет важное значение. Во-первых, ингибиторы могут дать ценную информацию о химической природе активного центра фермента, а также о составе его функциональных групп и природе химических связей, обеспечивающих образование фермент-субстратного комплекса. Известны вещества, включая лекарственные препараты, специфически связывающие ту или иную функциональную группу в молекуле фермента, выключая ее из химической реакции. Так, йодацетат IСН2—СООН, его амид и этиловый эфир, пара-хлормеркурибензоат ClHg—С6Н4—СООН и другие реагенты сравнительно легко вступают в химическую связь с некоторыми SH-группами ферментов. Если такие группы имеют существенное значение для акта катализа, то добавление подобных ингибиторов приводит к полной потере активности фермента: R-SH + IСН2—СООН —> НI + R—S—CH2—COOH Действие ряда других ферментов (холинэстераза, трипсин и химотрип-син) сильно тормозится некоторыми фосфорорганическими соединениями, например ДФФ, вследствие блокирования ключевой гидроксильной группысерина в активном центре (см. ранее). Во-вторых, ингибиторы нашли широкое применение в энзимологии при исследовании природы множественных форм ферментов и изоферментов, различающихся не столько электрофоретической подвижностью, сколько различной чувствительностью к одному и тому же ингибитору. При помощи ингибиторов, выключающих отдельные стадии многоступенчатого метаболического процесса, могут быть точно установлены не только последовательность химических реакций, но и природа участвующих в этих превращениях ферментов. Этим путем, применяя йодацетат, фториды и другие специфические ингибиторы, был расшифрован глико-литический путь окислительно-восстановительных превращений глюкозы до стадии образования молочной кислоты в мышечной ткани, насчитывающий 11 стадий с участием 11 ферментов и 10 промежуточных метаболитов. С ингибированием ферментов связан механизм действия многих токсинов и ядов на организм. Известно, что при отравлениях солями сенильной кислоты смерть наступает вследствие полного торможения и выключения дыхательных ферментов (цитохромная система) тканей, особенно клеток мозга. Токсическое влияние на организмчеловека и животных некоторых инсектицидов обусловлено торможением активности холинэстеразы – фермента, играющего ключевую роль в деятельности нервной системы. Современная, так называемая рациональная, химиотерапия (направленное применение лекарственных препаратов в медицине) должна основываться на точном знании механизма действия лекарственных средств на биосинтезферментов, на активность уже синтезированных ферментов или на регуляцию их активности в организме. Иногда для лечения некоторых болезней используют избирательно действующие ингибиторы. Так, ингибитор ряда протеиназ (трипсина, химотрипсина и калликреина) трасилол широко применяется для лечения острого панкреатита – болезни, при которой уровень трипсина и химотрипсина в крови резко возрастает. Знание избирательного ингибиторного действия некоторых природных и синтетических соединений (так называемых антиметаболитов) на ферменты может служить методологической основой для разработки эффективных методов синтеза химиотерапевтических препаратов. Этот путь открывает широкие возможности для направленного воздействия на синтез ферментов в организме и регуляции интенсивности метаболизма при патологии. Типы ингибирования. Различают обратимое и необратимое ингибиро-вание. Если ингибитор вызывает стойкие изменения пространственной третичной структуры молекулы фермента или модификацию функциональных группфермента, то такой тип ингибирования называется необратимым. Чаще, однако, имеет место обратимое ингибирование, поддающееся количественному изучению на основе уравнения Михаэлиса-Ментен. Обратимое ингибирование в свою очередь разделяют на конкурентное и неконкурентное в зависимости от того, удается или не удается преодолеть торможение ферментативной реакции путем увеличения концентрации субстрата. Конкурентное ингибирование может быть вызвано веществами, имеющими структуру, похожую на структуру субстрата, но несколько отличающуюся от структуры истинного субстрата. Такое ингибирование основано на связывании ингибитора с субстратсвязывающим (активным) центром. Классическим примером подобного типа ингибирования является торможение сукцинатдегидрогеназы (СДГ) малоновой кислотой. Этот фермент катализирует окисление путем дегидрирования янтарной кислоты (сукцината) в фумаровую: 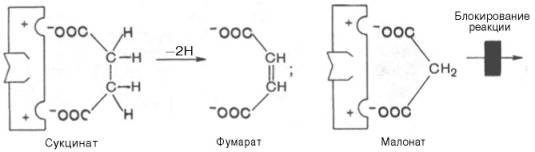 Если в среду добавить малонат (ингибитор), то в результате структурного сходства его с истинным субстратомсукцинатом (наличие двух таких же ионизированных карбоксильных групп) он будет взаимодействовать с активным центром с образованием фермент-ингибиторного комплекса, однако при этом полностью исключается перенос атомаводорода от малоната. Структуры субстрата (сукцинат) и ингибитора (малонат) все же несколько различаются. Поэтому они конкурируют за связывание с активным центром, и степень торможения будет определяться соотношением концентраций малоната и сукцината, а не абсолютной концентрацией ингибитора. Таким образом, ингибитор может обратимо связываться с ферментом, образуя фермент-ингибиторный комплекс. Этот тип ингиби-рования иногда называют ингибированием по типу метаболического антагонизма (рис. 4.20). В общей форме реакция взаимодействия ингибитора с ферментом может быть представлена следующим уравнением: 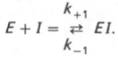 Образовавшийся комплекс, называемый фермент-ингибиторным комплексом ЕI, в отличие от фермент-субстратного комплекса ES не распадается с образованием продуктов реакции. Константу диссоциации комплекса EI, или ингибиторную константу Кi, можно, следуя теории Михаэлиса–Мен-тен, определить как отношение констант обратной и прямой реакций: 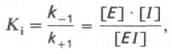 т.е. ингибиторная константа прямо пропорциональна произведению концентрации фермента и ингибитора и обратно пропорциональна концентрации комплекса EI. Метод конкурентного торможения нашел широкое применение в медицинской практике. Известно, например, что для лечения некоторых инфекционных заболеваний, вызываемых бактериями, применяют сульфаниламидные препараты. Оказалось, что эти препараты имеют структурное сходство с парааминобензойной кислотой, которую бактериальная клетка использует для синтеза фолиевой кислоты, являющейся составной частью 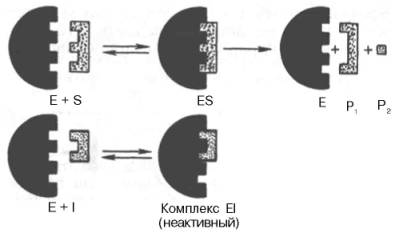 Рис. 4.20. Действие конкурентного ингибитора (схема по В.Л. Кретовичу). Е - фермент; S - субстрат; Р1 и Р2 - продукты реакции; I - ингибитор. ферментов бактерий. Благодаря этому структурному сходству сульфаниламид блокирует действие фермента путем вытеснения парааминобензой-ной кислоты из комплекса с ферментом, синтезирующим фолиевую кислоту, что ведет к торможению роста бактерий. 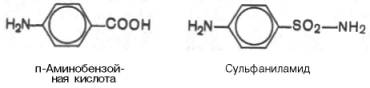 Некоторые аналоги витамина В6 и фолиевой кислоты, в частности дезоксипиридоксин и аминоптерин (см. главу 7), действуют как конкурентные, так называемые коферментные, ингибиторы (или антивитамины), тормозящие многие интенсивно протекающие при патологии биологические процессы в организме. Применение подобных аналогов в медицинской практике (в частности, в дерматологии и онкологии) основано на конкурентном вытеснении коферментов из субстратсвязывающих центров ключевых ферментов обмена. Неконкурентное ингибирование вызывается веществами, не имеющими структурного сходства с субстратами и часто связывающимися не с активным центром, а в другом месте молекулы фермента. Степень торможения во многих случаях определяется продолжительностью действия ингибитора на фермент. При данном типе ингибирования благодаря образованию стабильной ковалентной связи фермент часто подвергается полной инактивации, и тогда торможение становится необратимым. Примером необратимого ингибирования является действие йодацетата, ДФФ, а также диэтил-n-нитрофенилфосфата и солей синильной кислоты. Это действие заключается в связывании и выключении функциональных групп или ионов металлов и молекуле фермента. Следует указать, что неконкурентное ингибирование также может быть обратимым и необратимым, поскольку отсутствует конкуренция между субстратом и ингибитором за активный центр. Примеры необратимого ингибирования приведены ранее. При обратимом неконкурентном ингибировании субстрат S и ингибитор I связываются с разными центрами, поэтому появляется возможность образования как комплекса EI, так и тройного комплекса EIS; последний может распадаться с освобождением продукта, но с меньшей скоростью, чем комплекс ES. 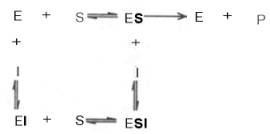 Этот тип неконкурентного ингибирования чаще всего наблюдается у ферментов, катализирующих превращения более одного субстрата, когда связывание ингибитора не блокирует связывание субстрата с активным центром. Ингибиторпри этом соединяется как со свободным ферментом, так и с ES-комплексом. Известно, кроме того, так называемое бесконкурентное ингиби-рование, когда ингибитор связывается с ферментомтакже в некаталитическом центре, однако не со свободным ферментом, а только с ES-комплексом в виде тройного комплекса. 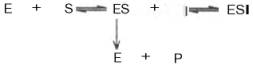 Для выяснения вопроса о типе ингибирования пользуются уравнениями Михаэлиса-Ментен, Лайнуивера-Бэрка или другими, например уравнением Эди-Хофсти: ν = -Km(y/[S]) + Vmax и соответствующими графиками в прямолинейных координатах. 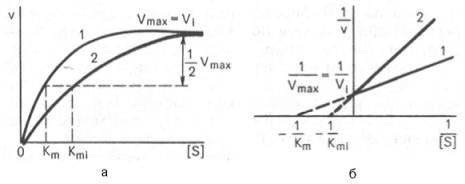 Рнс. 4.21. Графики зависимости скорости ферментативной реакции от концентрации субстрата в присутствии конкурентного ингибитора. а - в координатах v от [ S ] ; б - в координатах 1/v от 1 / [ S ] ; Vmaxи Vi - максимальные скорости реакции; Кm и Kmi - константа Михаэлиса соответственно в отсутствие (1) и в присутствии (2) ингибитора.  Рис. 4.22. Графики зависимости скорости ферментативной реакции от концентрации субстрата в присутствии неконкурентного ингибитора. Обозначения те же, что на рис. 4.21. При конкурентном типе ингибирования ингибитор увеличивает значение Кm, не оказывая влияния на максимальную скорость Vmax(рис. 4.21). Это означает, что при достаточно высокой концентрации субстрата [ S ] ингибиторвытесняется молекулами субстрата из комплекса EI. При неконкурентном ингибировании (рис. 4.22) ингибиторснижает величину максимальной скорости. Если при этом величина Кm не уменьшается, то говорят о полностью неконкурентном ингибировании. Подобный тип ингибиро-вания имеет место при образовании неактивных, труднодиссоциирующих комплексов EI и(или) EIS. Часто, однако, наблюдается смешанный тип ингибирования, иногда называемый частично неконкурентным, или обратимым неконкурентным ингибированием (см. ранее), при котором снижение Vmaxсочетается с одновременным увеличением значений Кm. Это означает, что комплекс EI сохраняет частичную активность, т.е. способность к образованию промежуточного тройного комплекса EIS, в котором субстратподвергается замедленному каталитическому превращению. В редких случаях степень торможения активности фермента может увеличиваться с повышением концентрации субстрата. Для этого типа торможения был предложен, как отмечено ранее, довольно неточный термин «бесконкурентное ингибирование». Один из механизмов такого торможения обусловлен возможностью соединения ингибитора с комплексом ES с образованием неактивного или медленно реагирующего тройного комплекса EIS. Таким образом, при графическом анализе скоростей ферментативных реакций как функции концентраций субстратаможет быть получена ценная информация не только о кинетике ферментативных реакций, но и о молекулярных механизмах ферментативного катализа. 20. Применение ферментов в медицине. Понятие об энзимопатиях. Примеры. Различают энзимопатологию, энзимодиагностику и энзимотерапию. Энзимопатология - это заболевания, которые обусловлены отсутствием или снижением ак- тивности ферментов. В основном это – наследственные болезни, обусловленные генетиче- скими нарушениями. Их называют молекулярными болезнями. Например: • дефекты ферментов обмена фенилаланина возникают при снижении активности фенилаланингидроксилазы (фенилпировиноградная олигофрения) • дефект галактозо-1-фосфатуридилтрансферазы) галактоземия; • дефекты ферментов обмена гликогена – гликогенозы; • дефекты ферментов обмена липидов – липидозы, болезнь Нимана-Пика и др. Энзимодиагностика - это использование определения активности ферментов в биологических жидкостях для выявления тех или иных заболеваний. Так, повышение активности аланинаминотрансферазы и ЛДГ5 в сыворотке крови свидетельствует о поражении печени (ге- патиты), повышение активности сывороточной аспартатаминотрансферазы и ЛДГ1 встречается при инфаркте миокарда, повышение активности амилазы в моче - остром панкреатите. Энзимотерапия - это использование ферментных препаратов для лечения заболеваний. Так, в качестве заместительной терапии при болезнях желудка назначают пепсин, для усиле- ния переваривания пищи применяют ферменты поджелудочной железы (препараты - фестал, мезим); для разжижения мокроты применяют ингаляции с трипсином; для рассасывания соединительнотканных рубцов – фермент гиалуронидазу; при растворения тромбов – фибринолизин, стрептокиназа и др. 21. Понятие метаболизма. Стадии метаболизма. Цикл трикарбоновых кислот (цикл Кребса), его роль в обмене углеводов, липидов, аминокислот. Обмен веществ или метаболизм - это совокупность протекающих в организме химических превращений, обеспечивающих их рост, развитие, адаптацию к изменениям окружающей среды и воспроизведение. Функции метаболизма: cнабжение клеток химической энергией; превращение молекул пищи в строительные блоки; сборка из этих блоков компонентов клетки (белки, липиды, нуклеиновые кислоты); синтез и разрушение специализированных биологических молекул (гем, холин). Обмен веществ: 1. Анаболизм — это совокупность процессов биосинтеза органических веществ, компонентов клетки и других структур органов и тканей. Анаболизм обеспечивает рост, развитие, обновление биологических структур, а также непрерывный ресинтез макроэргических соединений (АТФ) и их накопление. 2. Катаболизм — это совокупность процессов расщепления сложных молекул, компонентов клеток, органов и тканей до простых веществ (с использованием части из них в качестве предшественников биосинтеза) и до конечных продуктов метаболизма (с образованием макроэргических соединений). Процессы анаболизма и катаболизма находятся в организме в состоянии динамического равновесия или временного превалирования одного из них. Преобладание анаболических процессов над катаболическими приводит к росту, накоплению массы тканей, а катаболических — к частичному разрушению тканевых структур, выделению энергии. Состояние равновесного или неравновесного соотношения анаболизма и катаболизма зависит от возраста. В детском возрасте преобладают процессы анаболизма, а в старческом — катаболизма. У взрослых людей эти процессы находятся в равновесии. Их соотношение зависит также от состояния здоровья, выполняемой человеком физической или психоэмоциональной деятельности.  I этап катаболизма происходит в желудочно-кишечном тракте и сводится к реакциям гидролиза пищевых веществ. Химическая энергия рассеивается в виде тепла. II этап (внутриклеточный катаболизм) происходит в цитоплазме и митохондриях. Химическая энергия частично рассеивается в виде тепла, частично накапливается в виде восстановленных коферментных форм, частично запасается в макроэргических связях АТФ (субстратное фосфорилирование). III этап (заключительный) катаболизма протекает в митохондриях и сводится к образованию конечных продуктов обмена СО2 и Н2О. Химическая энергия частично рассеивается в виде тепла, 40–45 % ее запасается в виде АТФ (окислительное фосфорилирование). |
