ферменты1_razdel_1-23. Понятие фермент. Свойства ферментов. Отличие ферментов от неорганических катализаторов. Ферменты
 Скачать 1.94 Mb. Скачать 1.94 Mb.
|
ЦИКЛ ТРИКАРБОНОВЫХ КИСЛОТ (ЦИКЛ КРЕБСА)Цикл трикарбоновых кислот впервые был открыт английским биохимиком Г. Кребсом. Он первым постулировал значение данного цикла для полного сгорания пирувата, главным источником которого является гликолитическое превращение углеводов. В дальнейшем было показано, что цикл трикарбо-новых кислот является тем центром, в котором сходятся практически все метаболические пути. Таким образом, цикл Кребса – общий конечный путь окисления ацетильных групп (в виде ацетил-КоА), в которые превращается в процессе катаболизмабольшая часть органических молекул, играющих роль «клеточного топлива»: углеводов, жирных кислот и аминокислот. Образовавшийся в результате окислительного декарбоксилирования пирувата в митохондриях ацетил-КоА вступает в цикл Кребса. Данный цикл происходит в матриксе митохондрий и состоит из восьми последовательных реакций (рис. 10.9). Начинается цикл с присоединения ацетил-КоА к оксалоацетату и образования лимонной кислоты (цитрата). Затем лимонная кислота (шестиуглеродное соединение) путем ряда дегидрирований (отнятие водорода) и двух декарбоксилирований (отщепление СО2) теряет два углеродных атома и снова в цикле Кребса превращается в оксалоацетат (четырехуглеродное соединение), т.е. в результате полного оборота цикла одна молекула ацетил-КоА сгорает до СО2 и Н2О, а молекула окса-лоацетата регенерируется. Функции цикла Кребса Водороддонорная функция. Цикл Кребса поставляет субстраты для дыхательной цепи (НАД-зависимые субстраты: изоцитрат, a-кетоглутарат, малат; ФАД-зависимый субстрат – сукцинат). Катаболическая функция. В ходе ЦТК окисляются до конечных продуктов обмена ацетильные остатки, образовавшиеся из топливных молекул (глюкоза, жирные кислоты, глицерол, аминокислоты). Анаболическая функция. Субстраты ЦТК являются основой для синтеза многих молекул (кетокислоты — α-кетоглутарат и ЩУК — могут превращаться в аминокислоты глу и асп; ЩУК может превращаться в глюкозу, сукцинил-КоА используется на синтез гема). Анаплеротическая функция. Цикл не прерывается благодаря реакциям анаплероза (пополнения) фонда его субстратов. Важнейшей анаплеротической реакцией является образование ЩУК (молекулы, запускающей цикл) путем карбоксилирования ПВК. Энергетическая функция. На уровне сукцинил-КоА происходит субстратное фосфорилирование с образованием 1 молекулы макроэрга. Помимо этого, 4 дегидрогеназные реакции в цикле Кребса создают мощный поток электронов, богатых энергией. При последовательном переносе электронов на кислород выделяется энергия, достаточная для образования 9 молекул АТФ путем окислительного фосфорилирования. 22. Понятие «метаболические пути», их классификация. Современная теория тканевого дыхания. Дыхательная цепь, ее надмолекулярная организация. В клетке постоянно происходит большое количество разнообразных химических реакций, которые формируют метаболические пути - последовательное превращение одних соединений в другие. Метаболизм - совокупность всех метаболических путей, протекающих в клетках организма. Среди всех метаболических путей, протекающих в организме, выделяют противоположно направленные процессы: катаболизм и анаболизм. Катаболизм - распад сложных веществ до простых с высвобождением энергии. Анаболизм - синтез из простых более сложных веществ. Метаболические пути согласованы между собой по месту, времени и интенсивности протекания. Эта согласованность протекания всех процессов обеспечивается сложными и многообразными механизмами регуляции. Структура метаболических путей в клетке крайне разнообразна (см. табл. 2-3). В случае, когда субстрат в результате ряда ферментативных процессов превращается в один продукт, такой путь носит название линейного метаболического пути. Часто встречаются разветвлённые метаболические пути, приводящие к синтезу различных конечных продуктов в зависимости от потребности клетки. В процессе изучения курса биологической химии вы также познакомитесь с циклическими и спиральными метаболическими путями. Таблица 2-3. Типы метаболических путей
Тканевое дыхание и биологическое окисление. Распад органических соединений в живых тканях, сопровождающийся потреблением молекулярного кислорода и приводящий к выделению углекислого газа и воды и образованию биологических видов энергии, называется тканевым дыханием. Тканевое дыхание представляют как конечный этап пути превращений моносахаров (в основном глюкозы) до указанных конечных продуктов, в который на разных стадиях включаются другие сахара и их производные, а также промежуточные продукты распада липидов(жирные кислоты), белков (аминокислоты) и нуклеиновых оснований. Итоговая реакция тканевого дыхания будет выглядеть следующим образом: С6Н12О6 + 6O2 = 6СO2+ 6Н2O + 2780 кДж/моль. (1) Впервые сущность дыхания объяснил А.-Л. Лавуазье (1743-1794), обративший внимание на сходство между горениеморганических веществ вне организма и дыханием животных. Постепенно становились ясными принципиальные различия между этими двумя процессами: в организме окисление протекает при относительно низкой температуре в присутствии воды, и его скорость регулируется обменом веществ. В настоящее время биологическое окисление определяется как совокупность реакций окисления субстратов в живых клетках, основная функция которых - энергетическое обеспечение метаболизма. В развитие концепций биологического окисления в XX в. важнейший вклад внесли А.Н. Бах, О. Варбург, Г. Крепс, В.А. Энгель-гардт, В.И. Палладин, В.А. Белицер, С.Е. Северин, В.П. Скулачев. Потребление кислорода тканями зависит от интенсивности реакций тканевого дыхания. Наибольшей скоростью тканевого дыхания характеризуются почки, мозг, печень, наименьшей – кожа, мышечная ткань (в покое). Уравнение (2) описывает суммарный результат многоступенчатого процесса, приводящего к образованию молочной кислоты (см. главу 10) и протекающего без участия кислорода: С6Н12Об = 2С3Н6О3 + 65 кДж/моль. (2) Этот путь отражает, по-видимому, энергетическое обеспечение простейших форм жизни, функционировавших в бескислородных условиях. Современные анаэробные микроорганизмы (осуществляющие молочнокислое, спиртовое и уксуснокислое брожение) получают для жизнедеятельности энергию, производимую в процессе гликолиза или его модификаций. Использование клетками кислорода открывает возможности для более полного окисления субстратов. В аэробных условиях продукты бескислородного окисления становятся субстратами цикла трикарбоновых кислот (см. главу 10), в ходе которого образуются восстановленные дыхательные переносчики НАДФН, НАДН и флавиновые коферменты. Способность НАД+ и НАДФ+ играть роль промежуточного переносчика водорода связана с наличием в их структуре амида никотиновой кислоты. При взаимодействии этих кофакторов с атомами водорода имеет место обратимое гидрирование (присоединение атомов водорода): 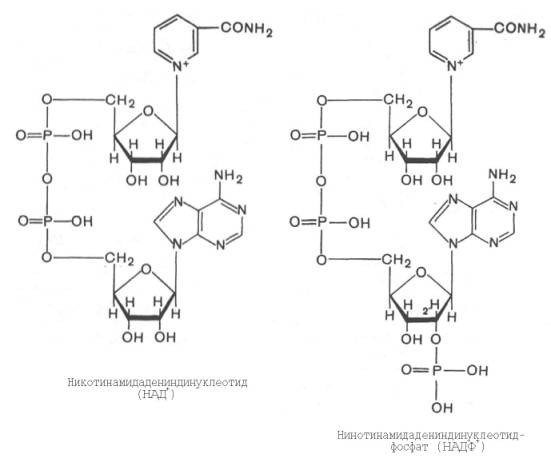 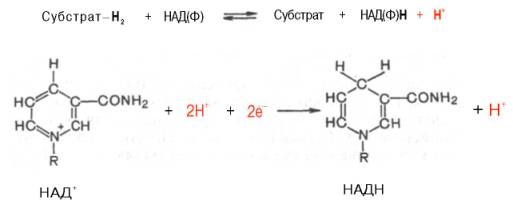 При этом в молекулу НАД+ (НАДФ+) включаются 2 электрона и один протон, а второй протон остается в среде. Во флавиновых коферментах (ФАД или ФМН), активной частью молекул которых является изоаллоксазиновое кольцо, в результате восстановления чаще всего наблюдается присоединение 2 протонов и 2 электроноводновременно: 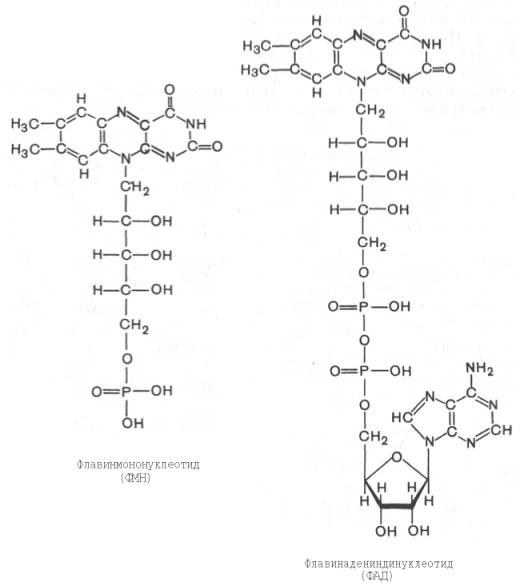 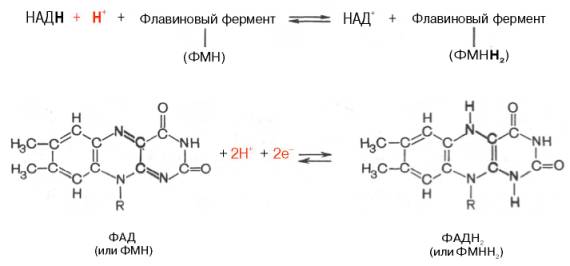 Восстановленные формы этих кофакторов способны транспортировать водород и электроны к дыхательной цепимитохондрий или иных энерго-сопрягающих мембран (см. далее). Организация и функционирование дыхательной цепи. В клетках эукариот дыхательная цепь расположена во внутренней мембране митохондрий, у дышащих бактерий – в цитоплазматической мембране и специализированных структурах – мезосомах, или тилакоидах. Компоненты дыхательной цепи митохондрий в порядке убыванияокислительно-восстановительного потенциала можно расположить, как показано в табл. 9.1.  Молярные соотношения компонентов дыхательной цепи являются постоянными, ее компоненты встроены в митохондриальную мембрану в виде 4 белково-липидных комплексов: НАДН-КоQН2-редуктаза (комплекс I), сукцинат-КоQ-редуктаза (комплекс II), КоQН2-цитохром c-редуктаза (комплекс III) и цитохром а-цитохромокси-даза (комплекс IV) (рис. 9.7). Если субстратом окисления служат α-кетокислоты, в переносе электронов на НАД+ участвуют липоатсодержащие дегидрогеназы. В случае окисления пролина, глутамата, изоцитрата и других субстратов перенос электроновпроисходит непосредственно на НАД+. Восстановленный НАД в дыхательной цепи окисляется НАДН-дегидрогеназой, содержащей железосерный белок (FeS) и ФМН и прочно связанной с дыхательной цепью. 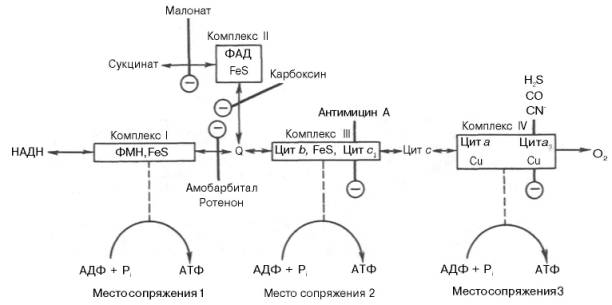 Рис. 9.7. Взаимное расположение компонентов дыхательной цепи с указанием мест фосфорилирования и специфических ингибиторов. KoQ (убихинон), необходимый компонент дыхательной цепи, является производным бензохинона с боковой цепью, которая у млекопитающих чаще всего представлена 10 изопреноидными единицами (см. главу 7). Как любой хинон, KoQ способен находиться и в восстановленном, и окисленном состоянии. Это свойство определяет его роль в дыхательной цепи - служить коллектором восстановительных эквивалентов, поставляемых в дыхательную цепь через флавиновые дегидрогеназы. Содержание его значительно превосходит содержание других компонентов дыхательной цепи. Дополнительным участником дыхательной цепи является железосерный белок FeS (негемовое железо). Он участвует в окислительно-восстановительном процессе, протекающем по одноэлектронному типу. Первый участок локализации FeS находится между ФМН и KoQ, второй - между цитохромами b и c1. Это соответствует тому факту, что со стадии ФМН путь протонов и электронов разделяется: первые накапливаются в митохондриальном матриксе, а вторые идут на гидрофобные переносчики - KoQ и цитохромы. Цитохромыв дыхательной цепи выстроены в порядке возрастания окислительно-восстановительного потенциала. Они представляют собой гемопротеины, в которых простетическая геминовая группа близка к гему гемоглобина (у цитохрома b идентична). Ионы железа в составе гема при получении и отдаче электронов обратимо изменяют свою валентность. В процессах тканевого дыхания наиболее важную роль играют цитохро-мы b, с1, с, а и а3. Цитохром а3 представляет собой терминальный участок дыхательной цепи – цитохромоксидазу, которая осуществляет окисление цитохрома си образование воды. Элементарный акт представляет собой двухэлектронное восстановление одного атомакислорода, т.е. каждая молекула кислорода одновременно взаимодействует с двумя электрон-транспортными цепями. При транспорте каждой пары электронов во внутримитохондриальном пространстве может накапливаться до 6 протонов (рис. 9.8). Строение дыхательной цепи интенсивно исследуется. В числе последних достижений молекулярной биохимии – установление тонкой структуры дыхательных ферментов с помощью рентгеноструктурного анализа. С помощьюэлектронного микроскопа с наивысшим доступным в настоящее время разрешением можно «увидеть» структуру цитохромоксидазы (рис. 9.9). 23. Макроэргические соединения, их химическое строение. Роль в организме АТФ. Образование АТФ в организме (окислительное и субстратное фосфорилирование). К макроэргическим соединениям относятся аденозинтрифосфорная кислота (АТФ), аденозиндифосфорная кислота (АДФ), а также пирофосфат (H4P2O7), полифосфаты (полимеры метафосфорной кислоты) и др. Самое важное макроэргическое соединение — АТФ. Используя энергию, заключенную в макроэргических связях АТФ, при действии ферментов, переносящих фосфатные группы, можно получить другие макроэргические соединения, например, ГТФ (гуанозинтрифосфорная кислота), ФЕП (фосфоенолпировиноградная кислота) и др. Образуется АТФ в процессах биологического окисления и при фотосинтезе. Энергия макроэргических связей используется для совершения любой работы: активации соединений (например, глюкозы, чтобы могла начаться цепь ее окислительных превращений), синтеза биополимеров (нуклеиновых кислот, белков, полисахаридов), избирательного поглощения веществ из окружающей клетку среды и выброса из клетки ненужных продуктов, мышечного сокращения и восстановления активного состояния организма и т. д. Запас этих соединений позволяет организму быстро реагировать на изменение внешних условий и совершать физическую работу. В энергетическом обеспечении клетки важнейшую роль играет адениловая система, которая включает АМФ, АДФ, Н4Р2О7 (пирофосфат), Н3РО4 (неорганический фосфат) и цАМФ (циклический АМФ). АТФ (аденозинтрифосфорная кислота) относится к группе высокоэнергетических фосфатов, содержит две фосфоангидридные связи. АТФ относится к макроэргическим веществам — веществам, содержащим в своих связях большое количество энергии. АТФ — нестабильная молекула: при гидролизе концевого остатка фосфорной кислоты АТФ переходит в АДФ (аденозиндифосфорную кислоту), при этом выделяется 32 кДж энергии. 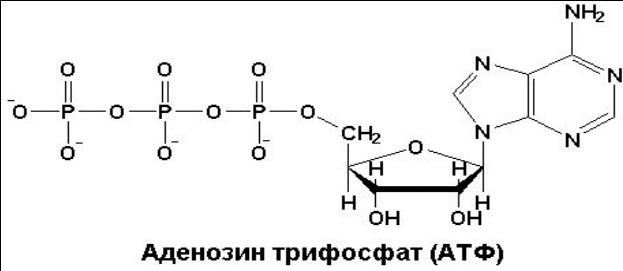 АТФ — универсальный переносчик и основной аккумулятор энергии в живых клетках. АТФ содержится во всех клетках растений и животных. Количество АТФ в среднем составляет 0,04% (на сырую массу клетки) В клетке молекула АТФ расходуется в течение одной минуты после ее образования. У человека количество АТФ, равное массе тела, образуется и разрушается каждые 24 часа. АТФ используется клетками для процессов биосинтеза (анаболические реакции), активации многих молекул (глюкоза, глицерол), выполнения механической работы, переноса веществ через мембраны, обеспечивает точную передачу генетической информации и др. При этом АТФ может гидролизоваться двумя способами: АТФ + Н2О = АДФ + неорганический фосфат + энергия (32 кДж\моль); АТФ + Н2О = АМФ + пирофосфат + энергия (32 кДж\моль). Синтез АТФ носит название фосфорилирования и описывается уравнением: АДФ + Н3РО4 = АТФ + Н2О. Эта реакция происходит при условии обеспечения энергией в количестве не менее 32 кДж/моль. Если источником этой энергии является транспорт электронов по дыхательной цепи внутренней мембраны митохондрий, говорят об окислительном фосфорилировании. Это главный путь синтеза АТФ в аэробных клетках. Если источником энергии является гидролиз макроэргической связи субстрата, говорят о субстратном фосфорилировании. Такой механизм имеет место в цитозоле и митохондриях и может происходить в анаэробных условиях. Процесс окислительного фосфорилирования тесно связан (сопряжен) с окислительно-восстановительными реакциями (ОВР), а именно с реакцией окисления водорода кислородом до воды — тканевым дыханием. |