биохимия лекции. Энзимология как учение о ферментах. Простые и сложные ферменты
 Скачать 3.9 Mb. Скачать 3.9 Mb.
|
|
Раздел 3.5 Ковалентная модификация ферментов. В ряде случаев каталитическая активность ферментов может изменяться в результате разрыва или образования ковалентных связей в молекуле. Существует несколько вариантов ковалентной модификации, из которых наибольший интерес представляют частичный протеолиз и регуляция путём фосфорилирования — дефосфорилирования. Частичный протеолиз. Многие белки синтезируются в форме неактивных предшественников, которые затем активируются в результате специфического расщепления одной или нескольких пептидных связей. Если каталитически активный белок называется ферментом (или энзимом), то неактивный предшественник фермента называется проферментом (или зимогеном). Активация белков путем частичного протеолиза - процесс, широко распространенный в биологических системах. Вот несколько примеров. пищеварительные ферменты, гидролизующие белки, синтезируются в желудке и поджелудочной железе в виде проферментов: пепсин – в виде пепсиногена, трипсин – в виде трипсиногена и т.д. свертывание крови представляет собой каскад реакций протеолитической активации проферментов. Это обеспечивает быструю ответную реакцию на повреждение кровеносного сосуда. некоторые белковые гормоны синтезируются в виде неактивных предшественников. Например, инсулин образуется из проинсулина. фибриллярный белок соединительной ткани коллаген также образуется из предшественника — проколлагена. Активацию неактивных предшественников ферментов путем частичного протеолиза можно рассмотреть на примере превращения трипсиногена в трипсин. Этот процесс происходит под действием фермента энтеропептидазы в просвете двенадцатиперстной кишки и сводится к отщеплению с N-конца полипептидной цепи 6 аминокислотных остатков и соответственно укорочению полипептидной цепи (рисунок 3.11). Такое же действие на трипсиноген оказывает и активный трипсин. В результате изменения первичной структуры в молекуле профермента возникают новые нековалентные связи, изменяется конформация полипептидной цепи и формируется активный центр. В молекуле профермента активный центр отсутствует. 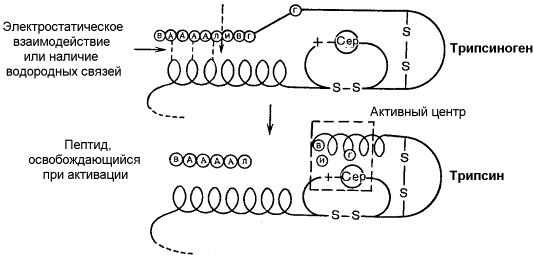 Рисунок 3.11. Схема механизма активации трипсиногена быка. Физиологический смысл выработки пищеварительных ферментов в форме проферментов заключается в том, что в противном случае ферменты могли бы оказывать свой эффект на клеточные белки слизистой желудка и поджелудочной железы, вызывая разрушение этих клеток. Такое разрушение клеток может наблюдаться, например, при панкреатите, когда активация трипсина происходит непосредственно в поджелудочной железе. Фосфорилирование – дефосфорилирование ферментов – присоединение или отщепление фосфатной группы. В отличие от частичного протеолиза, это обратимое изменение каталитической активности ферментов. Такие ферменты могут существовать в двух формах – фосфорилированной и дефосфорилированной. В зависимости от конкретного случая, одна из этих форм будет обладать более высокой, а другая – более низкой каталитической активностью. Фосфорилированию обычно подвергаются остатки серина, реже тирозина или треонина. Донором фосфатной группы является молекула АТФ. Фосфорилирование происходит избирательно и затрагивает лишь небольшое число аминокислотных остатков, не обязательно в активном центре фермента. Присоединение фосфата приводит к изменению конформации фермента и его активности. Фосфатные группы, связанные с остатками аминокислот, удаляются путём гидролиза с образованием неорганической фосфорной кислоты. Фосфорилирование и дефосфорилирование катализируется протеинкиназами и протеинфосфатазами соответственно (рисунок 3.12). Активность протеинкиназ и протеинфосфатаз находится под гормональным контролем и регулируется также нервной системой.  Рисунок 3.12. Ковалентная модификация, осуществляемая путем фосфорилирования — дефосфорилирования. Примером фермента, активность которого регулируется путём обратимого фосфорилирования, является гликогенфосфорилаза, участвующая в распаде гликогена в клетках печени и мышц Неактивная форма фермента (дефосфорилированная) превращается в активную форму (фосфорилированную) при помощи другого фермента – киназы фосфорилазы. Реакцию дефосфорилирования катализирует фосфатаза фосфорилазы которая инактивирует фосфорилазу. Раздел 3.6 Регуляция по принципу обратной связи. В результате аллостерических механизмов и ковалентной модификации происходит изменение активности уже имеющихся в клетке молекул фермента. Существуют также механизмы, влияющие на скорость реакций обмена веществ путём изменения количества молекул ферментативного белка в клетке. В настоящее время установлено, что синтез и распад ферментов, как и других белков, происходит в организме непрерывно. У взрослого здорового человека в условиях динамического равновесия процессы синтеза и распада имеют одинаковую скорость, благодаря чему общее содержание фермента не изменяется во времени. Для каждого фермента характерна своя скорость распада. В большинстве случаев полное прекращение синтеза фермента привело бы к исчезновению 50% молекул фермента за несколько дней, но некоторые ферменты обновляются значительно быстрее. Скорость синтеза фермента может варьировать от нуля до максимума, тогда как скорость распада представляется постоянной. Таким образом, любое вещество, влияющее на скорость синтеза фермента, способно оказать существенное воздействие на регуляцию обмена веществ путем изменения соотношения ферментов в организме. В основе многих гормональных воздействий на обмен веществ у человека лежат, как было установлено, именно такие контролирующие влияния на выработку каталитически активных белков. 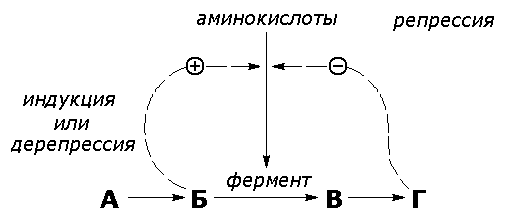 Рисунок 3.14. Регуляция синтеза фермента. Конечный продукт (Г) цепи метаболических реакций снижает концентрацию фермента, катализирующего этап Б → В путем репрессии его синтеза. Субстрат (Б) индуцирует синтез того фермента, который превращает его в В, препятствуя действию репрессора. Вещество, которое избирательно препятствует синтезу определенного фермента, называется репрессором. При помощи механизма репрессии конечные продукты реакций обмена веществ могут регулировать процесс их собственного образования по принципу обратной связи. Было доказано, что в некоторых системах накопление метаболитов, образующихся в итоге цепи последовательных реакций, предотвращает синтез одного из ферментов, функционирующего в начале этой цепи (рисунок 3.14). Продукт реакции в таком случае действует как специфический репрессор синтеза этого фермента предотвращая как ненужное потребление субстратов, вовлекаемых в реакции данной метаболической цепи, так и бесполезный расход энергии и аминокислот, необходимых для образования каталитически активного белка. Примером того, как конечные продукты цепи химических реакций способны замедлять синтез ферментных белков, катализирующих начальные стадии процесса (то есть снижать количество молекул этих ферментов), может служить регуляция синтеза гемоглобина в клетках кроветворных органов. По мере накопления гема в этих клетках подавляется синтез фермента, катализирующего первую реакцию синтеза гема (рисунок 3.15). Тем самым предупреждается избыточное накопление гемоглобина в клетке. 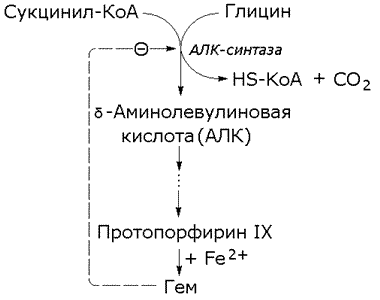 Рисунок 3.15. Регуляция синтеза гема по механизму репрессии на уровне фермента, катализирующего начальную реакцию этого метаболического пути. Явление, противоположное репрессии, известно под названиями индукция фермента или дерепрессия. В типичном случае субстрат определенного фермента способен индуцировать синтез этого фермента, что в свою очередь стимулирует потребление данного субстрата. Воздействуя на механизм синтеза фермента, индуктор, вероятно, прямо или косвенно противодействует репрессору. Соотношение между репрессором (конечным продуктом) и индуктором (субстратом) определяет, таким образом, количество ключевых ферментов и обеспечивает приспособление последовательности метаболических реакций к количеству метаболитов, поступающих в клетки организма с пищей. Как и в случае регуляторных ферментов, лишь немногие ключевые ферменты способны реагировать подобным образом на изменение физиологических потребностей. Такие ферменты называют индуцибельными (или адаптивными); ферменты, содержание которых в таких условиях не изменяется, называют конститутивными; они составляют постоянное содержимое клетки. У человека на адаптивные ферменты, вероятно, в большей мере влияют эндокринные факторы, нежели промежуточные продукты реакций обмена веществ. Так, гормоны коры надпочечников глюкокортикоиды стимулируют синтез ферментов, участвующих в образовании сахара крови (глюкозы), тогда как гормон поджелудочной железы инсулин противодействует этому. Глюкокортикоиды прямо или косвенно играют роль индукторов ферментов, когда как инсулин усиливает процесс репрессии. От определяемой противоположными воздействиями индукции и репрессии уровня синтеза ферментов зависит физиологическая регуляция содержания глюкозы в крови этими противоборствующими эндокринными системами. Ингибирование - частичное или полное торможение ферментативной реакции под действием веществ различной химической природы. Вещества, вызывающие ингибирование ферментов, называют ингибиторами. Различают обратимое и необратимое ингибирование. Если ингибитор вызывает стойкое снижение скорости реакции, то это необратимое ингибирование. При этом образуются ковалентные связи между молекулами фермента и ингибитора. Некоторые ферменты полностью ингибируются очень малыми концентрациями ионов тяжёлых металлов, например, ионов ртути (Hg2+), серебра (Ag+) и мышьяка (As+), или иодуксусной кислотой. Эти ингибиторы необратимо соединяются с SH-группами ферментов и вызывают денатурацию ферментного белка. Диизопропилфторфосфат (ДФФ) – соединение из группы нервнопаралитических отравляющих веществ. Он является ингибитором ацетилхолинэстеразы, которая инактивирует нейромедиатор ацетилхолин. ДФФ связывается с остатком аминокислоты серина в активном центре и блокирует действие фермента. В результате ацетилхолин накапливается в синаптической щели, нервные импульсы следуют один за другим, мышца не расслабляется, и наступает паралич или смерть.  Рисунок 3.16. Необратимое ингибирование фермента ацетилхолинэстеразы диизопрропилфторфосфатом. Другим примером необратимого ингибирования может служить действие цианидов на фермент цитохромоксидазу, участвующую в окислительно-восстановительных процессах в митохондриях клеток. Отравление цианидами может привести к смерти. Если ингибитор соединяется с ферментом при помощи нековалентных связей, то возможно восстановление исходной активности фермента после удаления ингибитора, например, путём диализа. Такое ингибирование называется обратимым. Обратимое ингибирование можно разделить на конкурентное и неконкурентное. Запомните особенности, характерные для конкурентного ингибирования: конкурентный ингибитор сходен по строению с субстратом. конкурентный ингибитор взаимодействует с активным центром фермента, образуя фермент-ингибиторный комплекс, и препятствует взаимодействию активного центра с субстратом. действие конкурентного ингибитора зависит от его концентрации: чем выше концентрация ингибитора, тем ниже скорость ферментативной реакции. действие конкурентного ингибитора можно снять, увеличив концентрацию субстрата. График зависимости скорости ферментативной реакции от концентрации субстрата в присутствии конкурентного ингибитора даёт такую же величину Vmax, как и в отсутствии ингибитора. Величина KM в данном случае будет увеличена, поскольку для обеспечения скорости, равной половине максимальной, в присутствии ингибитора потребуется больше субстрата. Отсюда следует, что конкурентный ингибитор препятствует образованию фермент-субстратного комплекса, но не влияет на процесс распада фермент-субстратного комплекса с образованием продуктов реакции.  Рисунок 3.17. Влияние конкурентного ингибитора на кинетические свойства фермента. Примером конкурентного ингибирования является ингибирование фермента сукцинатдегидрогеназы малоновой кислотой. Сукцинатдегидрогеназа катализирует реакцию дегидрирования янтарной кислоты с образованием фумаровой кислоты. Малоновая кислота, как и янтарная кислота, содержит две карбоксильные группы, но обладает более короткой углеродной цепью. Поэтому дегидрирование малоновой кислоты невозможно. Если концентрация малоновой кислоты в среде будет превышать концентрацию янтарной, то активность сукцинатдегидрогеназы снижается. Ингибирующее действие малоновой кислоты исчезает при увеличении концентрации янтарной кислоты. 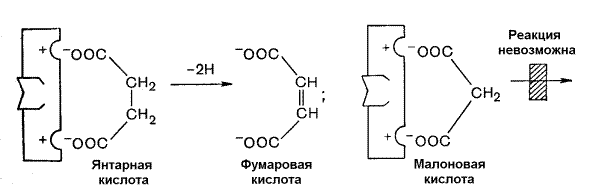 Рисунок 3.18. Конкурентное ингибирование сукцинатдегидрогеназы малоновой кислотой. Запомните особенности, характерные для неконкурентного ингибирования: неконкурентный ингибитор не сходен по строению с субстратом. неконкурентный ингибитор может взаимодействовать, как правило, не с активным центром фермента, а с другими участками в молекуле фермента. Поэтому фермент-ингибиторный комплекс может присоединять субстрат. На ввиду изменения конформации активного центра сродство к субстрату будет понижено. действие неконкурентного ингибитора не зависит от его концентрации. действие неконкурентного ингибитора нельзя снять, увеличив концентрацию субстрата. График зависимости скорости реакции от концентрации субстрата в присутствии неконкурентного ингибитора показывает сниженную величину Vmax. Субстрат не может вытеснить ингибитор из его соединения с ферментом. Величина KM в присутствии неконкурентного ингибитора не меняется. Это значит, что неконкурентный ингибитор воздействует на фермент на стадии распада фермент-субстратного комплекса, но не влияет на связывание субстрата.  Рисунок 3.19. Влияние неконкурентного ингибитора на кинетические свойства фермента. Неконкурентные ингибиторы снижают количество молекул субстрата, которые взаимодействуют с одной молекулой фермента в единицу времени (число оборотов фермента). Ингибиторы ряда ферментов используются в медицине как химиотерапевтические препараты. Целью химиотерапии является уничтожение возбудителя болезни при помощи химических веществ, не повреждая при этом организма-хозяина. Раздел 4.1 Распределение ферментов в тканях и в клетке. Изоферменты и мультиферменты: особенности структурной организации, биологическая роль. Локализация ферментов в клетке В клеточном содержимом ферменты распределены не хаотически, а строго упорядоченно. При помощи внутриклеточных мембран клетка разделена на отсеки или компартменты (рисунок 4.1). В каждом из них осуществляются строго определенные биохимические процессы и сосредоточены соответствующие ферменты или полиферментные комплексы. Вот несколько характерных примеров.  Рисунок 4.1. Внутриклеточное распределение ферментов различных метаболических путей. В лизосомах сосредоточены преимущественно разнообразные гидролитические ферменты. Здесь протекают процессы расщепления сложных органических соединений на их структурные компоненты. В митохондриях находятся сложные системы окислительно-восстановительных ферментов. Ферменты активирования аминокислот распределены в гиалоплазме, но они же есть и в ядре. В гиалоплазме присутствуют многочисленные метаболоны гликолиза, структурно объединенные с таковыми пентозофосфатного цикла, что обеспечивает взаимосвязь дихотомического и апотомического путей распада углеводов. В то же время ферменты, ускоряющие перенос аминокислотных остатков на растущий конец полипептидной цепи и катализирующие некоторые другие реакции в процессе биосинтеза белка, сосредоточены в рибосомальном аппарате клетки. В клеточном ядре локализованы в основном нуклеотидилтрансферазы, ускоряющие реакцию переноса нуклеотидных остатков при новообразовании нуклеиновых кислот. Распределение ферментов по субклеточным органеллам изучают после предварительного фракционирования клеточных гомогенатов путем высокоскоростного центрифугирования, определяя содержание ферментов в каждой фракции. Локализацию данного фермента в ткани или клетке часто удается установить in situ гистохимическими методами («гистоэнзимология»). Для этого тонкие (от 2 до 10 мкм) срезы замороженной ткани обрабатывают раствором субстрата, к которому специфичен данный фермент. В тех местах, где находится фермент, образуется продукт катализируемой этим ферментом реакции. Если продукт окрашен и нерастворим, он остается на месте образования и позволяет локализовать фермент. Гистоэнзимология дает наглядную и в известной мере физиологичную картину распределения ферментов. Ферментные системы ферментов, сосредоточенные во внутриклеточных структурах, тонко координированы друг с другом. Взаимосвязь катализируемых ими реакций обеспечивает жизнедеятельность клеток, органов, тканей и организма в целом. При исследовании активности различных ферментов в тканях здорового организма можно получить картину их распространения. Оказывается, что некоторые ферменты широко распространены во многих тканях, но в разных концентрациях, а другие очень активны в экстрактах, полученных из одной или нескольких тканей, и практически отсутствуют в остальных тканях организма. 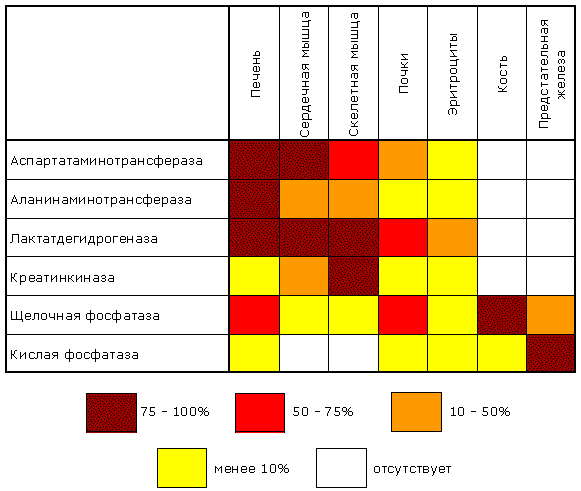 Рисунок 4.2. Относительная активность некоторых ферментов в тканях человека, выраженная в процентах от активности в ткани с максимальной концентрацией данного фермента (Мосс, Баттерворт, 1978). Изоферменты (изозимы) Изоферментами или изозимами называют множественные формы ферментов, которые существуют у одного и того же вида, в одной и той же ткани, и даже в одной и той же клетке. Все эти формы фермента катализируют одну и ту же реакцию, но различаются по своим кинетическим свойствам, а также по первичной структуре. Изоферменты играют регуляторную роль в обмене веществ и позволяют метаболизму в разных тканях лучше приспосабливаться к действию внутренних и внешних факторов. Примером фермента, у которого были обнаружены такие формы, может служить лактатдегидрогеназа (L-лактат:НАД+-оксидоредуктаза, КФ 1.1.1.27), катализирующая обратимую окислительно-восстановительную реакцию: 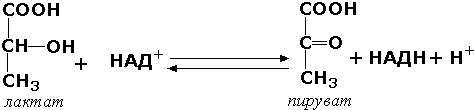 Лактатдегидрогеназа (ЛДГ) присутствует в тканях животных в виде пяти разных изоферментов, которые различаются на уровне четвертичной структуры. Молекула ЛДГ состоит из четырех протомеров двух типов, Н (от англ. heart - сердце) и М (от англ. muscle - мышца), которые различаются по аминокислотному составу и последовательности аминокислот. Каталитической активностью обладает только тетрамерная молекула. Протомеры могут быть скомпонованы следующими способами: Изофермент HHHH HHHM HHMM HMMM MMMM Обозначение ЛДГ1 ЛДГ2 ЛДГ3 ЛДГ4 ЛДГ5 Изоферменты сывороточной лактатдегидрогеназы могут быть обнаружены с помощью электрофореза при рН 8,6. При данном значении рН изозимы несут разный заряд и распределяются на электрофореграмме в пяти разных местах. Наибольшим отрицательным зарядом обладает изозим ЛДГ1. Распределение изоферментов ЛДГ (изоферментный спектр) в тканях также отличается. Так, изоформа ЛДГ, содержащая четыре М-субъединицы, преобладает в печени и скелетной мышце, а изоформа, состоящая из четырех Н-субъединиц, преобладает в миокарде (рисунок 4.3). 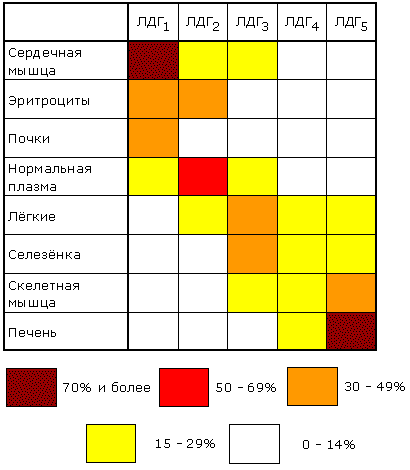 Рисунок 4.3. Относительное содержание изоферментов ЛДГ (в процентах от суммарной активности) в некоторых тканях человека (Мосс, Баттерворт, 1978). Мультиферменты Мультиферменты (мультэнзимы) - надмолекулярные комплексы, в состав которых входят ферменты, катализирующие последовательные стадии превращения субстрата. Например, для в реакциях превращения метаболита A в метаболит D : комплекс ферментов Е1, Е2, Е3 является мультиферментом. Объединение нескольких ферментов в один комплекс имеет важное преимущество: резко сокращаются расстояния, на которые молекулы промежуточных продуктов должны перемещаться от фермента к ферменту. Поэтому суммарная скорость таких метаболических путей довольно высока. Примером мультэнзима может служить пируватдегидрогеназный комплекс, находящийся в митохондриях и катализирует последовательные реакции окислительного декарбоксилирования пирувата:  Пируватдегидрогеназный комплекс состоит из трёх ферментов: пируватдекарбоксилазы, трансацилазы и дигидролипоилдегидрогеназы.  В промежуточных реакциях участвует пять коферментов: тиаминдифосфат; липоевая кислота; коэнзим А; ФАД; НАД. Регуляторным ферментом комплекса является пируватдекарбоксилаза, активность которой (и всего комплекса в целом) снижается при высокой концентрации АТФ в клетке. |
