биохимия лекции. Энзимология как учение о ферментах. Простые и сложные ферменты
 Скачать 3.9 Mb. Скачать 3.9 Mb.
|
|
Раздел 6.3 Индукторы синтеза ферментов как лекарственные препараты. Как уже упоминалось, индукторами синтеза ферментных белков называются вещества, способствующие экспрессии структурных генов ДНК, иначе говоря, реализации наследственной информации, заложенной в генах. В 1961 г. французские исследователи Ф. Жакоб и Ж.Моно провели исследование индукции генов, кодирующих ферменты катаболизма дисахарида лактозы в клетках кишечной палочки E. coli. Эти исследования позволили сформулировать концепцию оперона и механизмы регуляции синтеза белка в клетках прокариот. 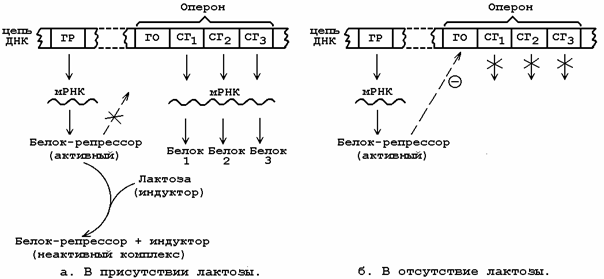 Оперон (транскриптон) - это совокупность генов, способных включаться и выключаться в зависимости от метаболических потребностей клетки. В состав оперона входит несколько структурных генов (СГ), кодирующих синтез функционально связанных друг с другом белков (например, ферментов одного метаболического пути), а также ген-оператор (ГО), управляющий транскрипцией структурных генов. К гену-оператору примыкает промотор - начальный участок инициации транскрипции. Функция гена-оператора контролируется пространственно удалённым геном-регулятором (ГР), продуцирующим белок-репрессор, который может находиться в активной либо неактивной форме. Активный белок-репрессор способен взаимодействовать с геном-оператором и блокировать область промотора. Это препятствует присоединению РНК-полимеразы к промотору и транскрипция структурных генов отменяется. Вещества, вызывающие инактивацию белка-репрессора, являются индукторами синтеза белка. Отсутствие активного белка-репрессора приводит к разблокированию промотора и транскрипция становится возможной. Синтезируемая мРНК поступает на рибосому и становится матрицей для синтеза ферментного белка. Наиболее распространёнными лекарственными препаратами, оказывающими влияние на процессы биосинтеза белков-ферментов, являются индукторы микросомальных монооксигеназ. В настоящее время описано более 250 химических соединений, вызывающих увеличение активности микросомальных ферментов. К числу этих индукторов относятся барбитураты, полициклические и хлорированные углеводороды, бифенилы, спирты, кетоны. некоторые стероиды. Комбинированное действие индукторов, например, фенобарбитала и антипирина, вызывает значительно более выраженный эффект, нежели раздельное применение этих соединений. Однако такие закономерности характерны не для всех сочетаний индукторов, что может быть связано с их конкурентными отношениями при взаимодействии с цитохромом Р-450. К числу индукторов относятся инсектициды (ДДТ, алдрин, гексахлорциклогексан) и многочисленные медикаментозные препараты: анальгетики (амидопирин), транквилизаторы и нейролептики (мепротон, сибазон, аминазин), противовоспалительные средства (бутадиен), гипогликемические препараты (букарбан), антигистаминные (димедрол), антитуберкулезные средства (рифампицин). стероиды (тестостерон, метилтестостерон, гидрокортизон, преднизолон). Несмотря на разнообразные виды химического строения, все индукторы имеют ряд общих признаков. Все они относятся к числу липидорастворимых соединений и характеризуются тропизмом по отношению к мембранам эндоплазматического ретикулума. Индукторы являются субстратами микросомальных ферментов. Наиболее мощные индукторы характеризуются длительным периодом полувыведения. Все вещества, вызывающие активацию микросомальных монооксигеназ, могут быть подразделены на индукторы широкого спектра действия и индукторы узкого крута действия, избирательно активирующие биотрансформацию отдельных соединений. К первой группе относятся фенобарбитал и др. барбитураты, хлорированные углеводороды, в том числе ДДТ. Индукторы этой группы обладают способностью ускорять биотрансформацию многочисленных липидорастворимых веществ, увеличивая содержание в микросомальной фракции цитохрома Р-450 и активность НАДФ-Н-цитохром-Р-450-редуктазы, стимулируя процессы окисления, восстановления и реакции конъюгации. Степень выраженности индуцирующего действия веществ зависит от их химического строения, от дозы и режима введения, от индивидуальных особенностей организма, имеет определенную органную направленность и возрастную особенность. Надо подчеркнуть, что свойства барбитуратов индуцировать микросомальные ферменты оказались полезными при передозировке антикоагулянтов, позволяя ускорить их биотрансформацию и к тому же замедлить их всасывание в желудочно-кишечном тракте. Лекарственные средства-индукторы: барбитураты, транквилизаторы, антигистаминные, антидиабетические - производные сульфанилмочевины, гуанидина, бутадион, зиксорин, глюкокортикоиды, дифенил, рифампицин, как правило, снижают эффекты некоторых одновременно назначаемых препаратов (левомицетина, дигоксина, дигитоксина, эстрогенов, витамина D), вызывая быстрое разрушение и снижение концентрации их в крови ниже терапевтической. Только введение больших количеств последних обеспечит их адекватный эффект. В то же время отмена индукторов (например, фенобарбитала - наиболее сильного индуктора) служит причиной быстрого возрастания концентрации данных лекарственных средств в крови и оазвития токсического действия. Химические соединения-индукторы оказывают на метаболизм лекарств стимулирующий эффект путем, как говорилось выше, увеличения скорости синтеза (индуцирования синтеза) микросомальных ферментов, в том числе цитохрома Р-450 и НАДФН2-цитохром Р-450-редуктазы, а также вследствие уменьшения скорости распада этих ферментов. Предполагается, что в основе индуцирования синтеза лежит дерепрессия гена-оператора генетических систем, ведающих синтезом микросомальных ферментов, аналогично предполагаемому механизму действия гормонов. В механизме действия индукторов принимают участие циклические нуклеотиды. Раздел 6.4 Использование ингибиторов ферментов для лечения заболеваний. Важное практическое значение для терапевтических целей приобретают ингибиторы ферментов как естественного происхождения, так и синтетические. Особенно широкое признание получили ингибиторы протеаз для лечения патологических состояний, вызванных активацией протеолитических систем крови и тканей. Ингибиторы протеиназ Ингибиторы протеолитических ферментов применяются при лечении острого панкреатита. По мнению многих авторов, основной причиной развития этого заболевания является активация ферментов поджелудочной железы непосредственно в протоках с помощью особых факторов — цитокиназ, превращающих трипсиноген в трипсин. (В физиологических условиях, как известно, ферменты находятся в поджелудочной железе в неактивной форме. Их активация происходит лишь при поступлении в кишечник). Активируются и другие ферменты (калликреиноген, химотрипсиноген, проэластаза и другие), что приводит к аутокаталитическим процессам (самоперевариванию тканей железы), внутритканевым кровоизлияниям, отеку и другим изменениям. Применение ингибиторов положило начало новому этапу в лечении панкреатитов. С этой целью с успехом используются ингибиторы трипсина, в особенности тразилол (получают из околоушной железы крупного рогатого скота), пантрипин (из поджелудочной железы) и контрикал (из легких). Введение препаратов проводится внутривенно. Степень развития заболевания и его исход будут зависеть от состояния системы трипсин-ингибитор. Если ингибитора достаточно и система обладает компенсаторными способностями, то активированный фермент нейтрализуется; равновесие в системе восстанавливается. При дефиците ингибитора равновесие нарушается и процесс получает дальнейшее развитие. Ингибиторы фибринолиза Антитрипсиновые препараты (трасилол, контрикал, пантрипин) используются также для лечения и профилактики кровотечений, вызванными активацией в организме процессов фибринолиза при проведении хирургических операций и в послеоперационном периоде. Они образуют неактивный комплекс с фибринолизином крови, предотвращая тем самым его влияние на фибрин. Другая группа ингибиторов фибринолиза включает синтетические препараты, из которых наибольшее распространение получила аминокапроновая кислота. В химическом отношении она близка к аминокислоте лизину: блокирует по конкурентному типу каталитический центр активатора, который связывается с лизиновым концом молекулы плазминогена. Помимо подавления активатора плазминогена, аминокапроновая кислота снижает активность самого плазмина. Это действие менее выражено, но оно имеет большое значение в тех случаях, когда в качестве активаторов выступают киназы тканей. Синтетические ингибиторы фибринолиза назначают внутрь или внутривенно при фибринолитических кровотечениях, возникающих во время операций на сердце, легких, мозге, надпочечниках и других органах, богатых тканевыми лизокиназами, активирующими плазминоген. Их назначают также для уменьшения кровопотерь вовремя родов и акушерских операций, при тромбоцитопении, гемофилии, заболеваниях печени и при массивных переливаниях консервированной крови. Ингибиторы ацетилхолинэстеразы Согласно современным представлениям, передача возбуждения в центральной и периферической нервной системе осуществляется при участии специальных биомолекул - нейромедиаторов или нейротрансмиттеров. Они высвобождаются в процессе передачи нервного импульса из нервного окончания в синаптическую щель, воздействуют на постсинаптический рецептор, что сопровождается соответствующим физиологическим ответом. Одним из таких нейромедиаторов является ацетилхолин, рецепторы к которому имеются в гладкомышечных клетках желудка, кишечника, бронхов, матки, желчного и мочевого пузыря (рисунок 6.5). Инактивация ацетилхолина в синаптической щели осуществляется ферментом ацетилхолинэстеразой, одна молекула которого может расщепить до 25000 молекул ацетилхолина в секунду.  Рисунок 6.5. Передача возбуждения с помощью ацетилхолина в качестве нейромедиатора (слева); связывание и гидролиз ацетилхолина ацетилхолинэстеразой (справа). Ингибиторы ацетилхолинэстеразы средства подавляют действие этого фермента и тем самым способствуют накоплению и усилению действия ацетилхолина, выделяющегося в окончаниях холинергических нервов. Их эффект, следовательно, напоминает действие ацетилхолина (более выраженное и более продолжительное) и холиномиметических веществ, т. е. обладают М- и Н-холиномиметическим действием: повышение тонуса и сократительной активности гладких мышц, замедление пульса, снижение сократительной способности миокарда и скорости распространения возбуждения по проводящим путям, усиление секреции разных желез (М-холиномиметический эффект), обеспечение в малых дозах передачи импульсов в вегетативных ганглиях и усиления нервно-мышечной передачи (никотиноподобный эффект). Мышечные подергивания, в частности, могут явиться показателем наступающей фазы токсического действия. Исходя из стойкости взаимодействия антихолинэстеразных средств с ацетилхолинэстеразой они подразделяются на группу обратимых (физостигмин, прозерин, галантамин) и группу необратимых (фосфакол, армин, пирофос) ингибиторов холинэстеразы; к этой группе относятся и фосфорорганические соединения — инсектициды, пестициды и др. Препараты первой группы взаимодействуют с анионным и эстеразным центрами ацетилхолинэстеразы, вызывая временное, относительно непродолжительное угнетение активности фермента. С анионным центром за счет электростатических сил связывается положительно заряженный четвертичный или третичный атом азота молекулы лекарственного средства; а с эстеразным центром — углерод их карбонильной группы. Прочность образующихся при этом компонентов определяется устойчивостью ингибитора по отношению и эстеразному центру фермента и способностью ацетилхолина конкурировать с ингибитором за субстрат. Препараты группы антихолинэстеразных средств обратимого действия применяются в офтальмологии (для сужения зрачка и понижения внутриглазного давления при глаукоме), при лечении миастении, атонии кишечника и мочевого пузыря. Они противопоказаны при бронхиальной астме. Препараты второй группы взаимодействуют с эстеразным центром фермента, фосфорилируя его, образуют стойкий, прочный комплекс, который не разрушается (практически разрушается весьма медленно) и не позволяет восстановиться активности ацетилхолинэстеразы. Эстеразный центр фермента практически не разрушает такой ингибитор. Активность его подавляется необратимо. Ингибиторы моноаминоксидазы Моноаминооксидаза (МАО) — фермент, вызывающий окислительное дезаминирование и инактивацию моноаминов, в том числе норадреналина, дофамина, серотонина, то есть основных нейромедиаторов, способствующих передаче нервного возбуждения в центральной нервной системе. МАО локализована преимущественно интранейронально, в митохондриях и частично в везикулах. Ингибиторы МАО ипразид и ниаламид представляют собой производные гидразина; они способствуют накоплению моноаминов в синаптической щели. Тем самым повышают активность моноаминергических систем мозга, которая снижается при депрессивных состояниях. Ингибиторы МАО обладают положительным влиянием на эффективную сферу больного, улучшением настроения и общего психического состояния. Они нашли применение и при ряде нейровегетативных и соматических заболеваний с явлениями депрессий, которые выражены в той или иной степени. Препараты усиливают и увеличивают продолжительность действия снотворных веществ обезболивающих и других нейротропных средств. Следует отметить, что данные препараты инактивируют не только моноаминоксидазу мозга, но и одновременно некоторые ферменты печени, участвующие в обезвреживании ряда эндогенных токсических продуктов. Поэтому ингибиторы МАО обладают высокой токсичностью. При их применении следует исключить употребление пищевых продуктов (сыр, кофе, пиво), содержащих тирамин и фенилэтиламин, разрушающихся в тонком кишечнике и печени под влиянием моноаминоксидазы, что обусловливает их сосудосуживающее и гипертензивное действия. Ингибиторы карбоангидразы Карбоангидраза — фермент, участвующий в процессе гидратации и дегидратации угольной кислоты, преимущественно в клетках проксимальных почечных канальцев. Его ингибитором является диакарб, используемый в качестве мочегонного средства (диуретика). Диуретический эффект диакарба основан на том, что уменьшение образования угольной кислоты приводит к снижению реабсорбции ионов бикарбоната и ионов натрия эпителием канальцев и повышению выделения их с мочой, в связи с чем значительно увеличивается выделение воды. Одновременно происходит увеличение выделения с мочой ионов калия. В связи с усиленным выведением бикарбонатов из организма уменьшается щелочной резерв крови и может развиваться ацидоз. Препарат наиболее эффективен при отеках, обусловленных легочно-сердечной недостаточностью, при которой необходимо снизить высокое содержание в крови углекислоты и бикарбонатов. Ингибиторы ксантиноксидазы Аллонуринол является конкурентным ингибитором ксантиноксидазы. Этот фермент катализирует образование мочевой кислоты из пуриновых оснований. Под действием аллопуринола понижается образование солей мочевой кислоты (уратов) в крови и отложение их в тканях. Уменьшается также выделение уратов почками, что снижает вероятность образования в них камней. Аллопуринол назначают под для лечения и профилактики подагры и некоторых форм мочекаменной болезни, сопровождающихся гиперурикемией (повышением содержания уратов в крови). Препарат применяют под контролем уровня мочевой кислоты в крови и моче. Ингибиторы ацетальдегиддегидрогеназы Препараты тетурам и циамид применяют для лечения хронического алкоголизма. Действие этих препаратов основано на способности влиять на обмен алкоголя в организме. Алкоголь, окисляясь, проходит через фазу ацетальдегида и уксусной кислоты. Ацетальдегид при участии фермента ацетальдегиддегидрогеназы быстро окисляется. Тетурам, блокируя ацетальдегидроксидазу, задерживает процесс окисления и обусловливает увеличение концентрации ацетальдегида в крови, что приводит к изменению дыхания и кровообращения, сопровождающихся неприятными ощущениями: покраснение и чувство жара в лице и верхней части туловища, затруднение дыхания, шум в голове, сердцебиение, чувство страха, иногда озноб; артериальное давление значительно понижается. Назначая алкоголь на фоне действия тетурама вырабатывают отрицательный условный рефлекс на вкус и запах спиртных напитков и добиваются определенной непереносимости алкоголя. Раздел 7.1 Общая характеристика обмена веществ. Две стороны (фазы) метаболизма. 7.1.1. Метаболизм (обмен веществ) – совокупность химических реакций, протекающих в живой клетке. Эти реакции протекают в определённой последовательности и тесно связаны между собой. Главные функции метаболизма в клетке: а) запасание энергии, которая добывается путем расщепления пищевых веществ, поступающих в организм, или путем преобразования энергии солнечного света; б) превращение молекул пищевых веществ в строительные блоки; в) сборку белков, нуклеиновых кислот, липидов, полисахаридов и прочих клеточных компонентов из этих строительных блоков; г) синтез и разрушение тех биомолекул, которые необходимы для выполнения специфических функций данной клетки. 7.1.2. Метаболизм включает множество метаболических путей. Метаболический путь - определенная последовательность ферментативных реакций в клетке. Промежуточные продукты реакций метаболического пути называются метаболитами. На каждой из стадий метаболического пути происходит небольшое химическое изменение метаболитов. В результате этих превращений исходная молекула превращается в конечный продукт метаболического пути. 7.1.3. Большинство метаболических путей являются линейными (рисунок 7.1, а), но встречаются и циклические метаболические пути (рисунок 7.1, б). Обычно метаболические пути имеют разветвления, в которых одни вещества выходят из цепи реакций данного пути, а другие, наоборот, включаются в него (рисунок 7.1, в).   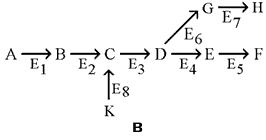 Рисунок 7.1. а. Линейный метаболический путь (схема). Предшественник А превращается в продукт F в результате пяти последовательных реакций. Продукт одной ферментативной реакции служит при этом субстратом следующей. б. Циклический путь (схема). Конечным продуктом такого пути является один из субстратов первой ферментативной реакции. Таким путём происходит окисление ацетильной группы до СО2 и Н2О в цикле Кребса. в. Разветвлённый метаболический путь (схема). Метаболит D выходит из цепи реакций данного пути, превращаясь в метаболит G, а вещество К, наоборот, включается в него. Обратите внимание, что главные метаболические пути немногочисленны и одинаковы у большинства живых организмов. Именно эти пути представляют для нас наибольший интерес. Рассмотрению их будут посвящены разделы 7.3. и 7.4 настоящей темы. 7.1.4. Две стороны (фазы) метаболизма. Метаболизм складывается из двух противоположных сторон: катаболизма и анаболизма. Катаболизм – это фаза, в которой происходит последовательное расщепление сложных молекул до более простых, таких, как СО2, вода и аммиак. Процессы катаболизма сопровождаются выделением энергии. Эта энергия частично аккумулируется в форме макроэргического соединения – аденозинтрифосфата (АТФ). Анаболизм – это фаза метаболизма, в которой происходит образование (биосинтез) сложных молекул (белков, липидов, полисахаридов) из простых предшественников. Процессы биосинтеза протекают с затратой энергии. Источником этой энергии служит распад АТФ до АДФ и неорганического фосфата. Метаболические пути, выполняющие как катаболическую, так и анаболическую функцию, называют амфиболическими. 7.1.5. Катаболическая и анаболическая фазы метаболизма тесно связаны между собой: а) Энергия, выделяемая в реакциях катаболизма, и аккумулированная в форме молекул АТФ, потребляется в анаболических процессах. б) В реакциях катаболизма образуются простые метаболиты, которые могут использоваться в реакциях биосинтеза (анаболизма).  Рисунок 7.2. Взаимосвязь путей катаболизма и анаболизма. |
