биохимия лекции. Энзимология как учение о ферментах. Простые и сложные ферменты
 Скачать 3.9 Mb. Скачать 3.9 Mb.
|
|
Раздел 1.1 Энзимология как учение о ферментах. Простые и сложные ферменты. Метаболизм, или обмен веществ, представляет собой процесс, в котором, с одной стороны, из простых веществ строятся более сложные, а с другой — происходит распад веществ до конечных продуктов обмена, что сопровождается выделением энергии. Процесс биосинтеза обозначают термином анаболизм, а распад называют катаболизмом: МЕТАБОЛИЗМ Анаболизм Катаболизм Биосинтез Распад Малые молекулы → Крупные молекулы Крупные молекулы → Малые молекулы Энергия потребляется Энергия освобождается Неупорядоченность уменьшается Неупорядоченность возрастает Преимущественно восстановительные процессы Преимущественно окислительные процессы Примеры: Глюконеогенез Гликолиз Синтез жиров Липолиз Синтез белков Протеолиз В основе функционирования организма в целом лежит тонко сбалансированное равновесие между процессами анаболизма и катаболизма. Так, в норме в организме взрослого непрерывно происходит распад компонентов тканей с выработкой энергии и восполнение этих компонентов в процессе анаболизма с использованием потребляемых пищевых веществ. В условиях патологии — при лихорадочных состояниях, голодании или недостаточном питании — преобладают процессы катаболизма, что может привести к истощению и гибели. В периоды выздоровления после болезней, в процессе заживления ран, во время беременности, лактации и роста преобладают анаболические процессы; патологически выраженное преобладание анаболизма может привести к чрезмерному росту (гигантизм) или ожирению. Нарушения обмена веществ в большинстве случаев обусловлены повреждением тех механизмов, которые в норме регулируют скорость процессов анаболизма и катаболизма, поддерживая определенные соотношении между ними в различных тканях организма. Скорость метаболических процессов определяется действием многочисленных ферментов — биологических катализаторов белковой природы. Термин «фермент» происходит от латинского слова fermentum — закваска. Наряду с этим понятием в литературе используется равноценный термин «энзим» греческого происхождения. Раздел биохимии, изучающий ферменты, получил название «энзимология». Энзимология составляет основу познания на молекулярном уровне важнейших проблем физиологии и патологии человека. Переваривание пищевых веществ и их использование для выработки энергии, образование структурных и функциональных компонентов тканей, сокращение мышц, передача электрических сигналов по нервным волокнам, восприятие света глазом, свертывание крови — каждый из этих физиологических механизмов имеет в основе каталитическое действие определенных ферментов. Было показано, что многочисленные заболевания непосредственно нарушением ферментативного катализа; определение активности ферментов в крови и других тканях даёт ценные сведения для медицинской диагностики; ферменты или их ингибиторы могут применяться как лекарственные вещества. Таким образом, знание важнейших особенностей ферментов и катализируемых ими реакций необходимо при рациональном подходе к изучению заболеваний человека, их диагностике и лечению. Как и другие функциональные белки, ферменты делятся на простые и сложные. Простые ферменты — это простые белки, они построены из аминокислот и при гидролизе распадаются только на аминокислоты. Сложные ферменты — это сложные белки, они состоят из простого белка и небелкового компонента. При их гидролизе, помимо свободных аминокислот, освобождается небелковая часть или продукты её распада. Белковая часть сложного фермента получила название апофермент, небелковая часть — кофактор. Кофакторы могут иметь разную химическую природу и отличаться по прочности связи с апоферментом. В роли кофактора могут выступать ионы различных металлов, а также другие неорганические ионы. Органические вещества неаминокислотной природы, используемые в роли кофакторов, называются коферментами. Кофермент вместе с апоферментом образуют холофермент. Кофермент + Апофермент ↔ Холофермент В некоторых случаях в условиях живой клетки равновесие в этой реакции сильно сдвинуто вправо и кофермент прочно связан со своей белковой частью, они не разделяются при выделении и очистке. Такой кофермент называется простетической группой. Следует отметить одну отличительную особенность сложных ферментов, заключающуюся в том, что ни кофактор (в том числе кофермент), ни сам по себе апофермент каталитической активностью не обладают и только их объединение в единое целое обеспечивает быстрое протекание химической реакции. Следует отметить одну отличительную особенность сложных ферментов, заключающуюся в том, что ни кофактор (в том числе кофермент), ни сам по себе апофермент каталитической активностью не обладают и только их объединение в единое целое обеспечивает быстрое протекание химической реакции. Раздел 1.2 Строение и свойства аминокислот. Пептидная связь. Цветные реакции на белки и аминокислоты. Вспомните из курса биоорганической химии, что все белки и пептиды построены из мономеров – α-аминокислот, имеющих общую формулу: , 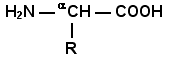 где R – радикал или боковая цепь. Таким образом, индивидуальные свойства каждой из аминокислот определяются структурой её радикала. Повторите формулы 20 белковых аминокислот (рисунок 1.1) и их сокращённые обозначения (таблица 1.1). 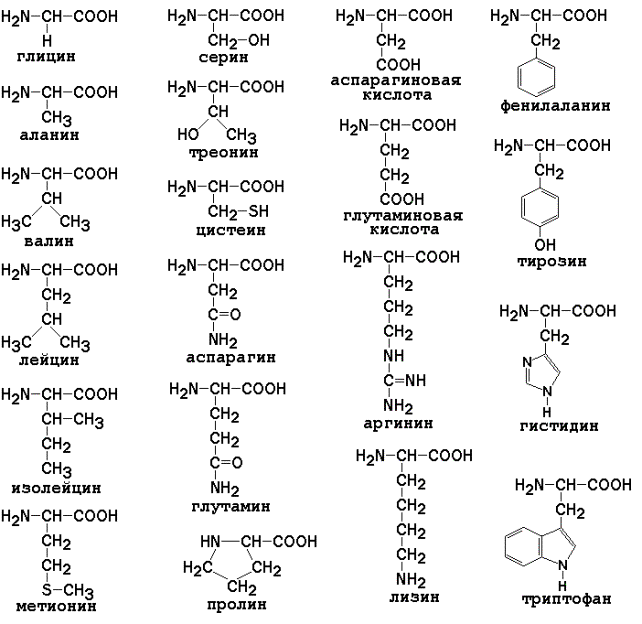 Рисунок 1.1. Формулы аминокислот. Таблица 1.1. Сокращённое обозначение свободных аминокислот и их остатков в составе белков и пептидовСокращённое обозначение Название аминокислоты Название аминокислотного остатка ала аланин аланил- арг аргинин аргинил- асн аспарагин аспарагинил- асп аспарагиновая кислота (аспартат) аспартил- вал валин валил- гис гистидин гистидил- гли глицин глицил- глн глутамин глутаминил- глу глутаминовая кислота (глутамат) глутамил- иле изолейцин изолейцил- лей лейцин лейцил- лиз лизин лизил- мет метионин метионил- про пролин пролил- сер серин серил- тир тирозин тирозил- тре треонин треонил- три триптофан триптофил- фен фенилаланин фенилаланил- цис цистеин цистеинил- Запомните, как можно классифицировать аминокислоты, основываясь на полярности их радикалов (рисунок 1.2). АМИНОКИСЛОТЫ с неполярными радикалами с полярными радикалами Обратите внимание, что полярные (заряженные и незаряженные) радикалы могут взаимодействовать с молекулами воды при помощи водородных связей. Поэтому они называются гидрофильными. Неполярные радикалы не взаимодействуют с молекулами воды, они называются гидрофобными. В то же время неполярные радикалы аминокислот обладают большим сродством к органическим растворителям (гексан, хлороформ и т.д.), а аминокислоты с полярными радикалами растворяются в таких растворителях хуже. Как вам известно из курса биоорганической химии, при взаимодействии α-карбоксильной группы одной аминокислоты с α-аминогруппой другой аминокислоты образуется пептидная (амидная) связь: 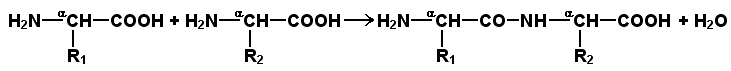 Соединения, в которых аминокислоты связаны при помощи пептидных связей, называются пептидами, а аминокислотные звенья пептидов – аминокислотными остатками. Аминокислотный остаток, имеющий свободную α-аминогруппу, называют N-концевым, а остаток, имеющий свободную α-карбоксильную группу, - С-концевым. Пептидные связи формируют первичную структуру белка – последовательность чередования аминокислот в полипептидной цепи. Научитесь записывать структурные формулы пептидов. Запомните, что пептиды записываются и читаются с N-конца. Сначала пишется структура пептидного остова, например: 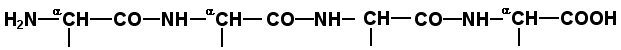 для тетрапептида для тетрапептида и так далее. Затем к α-углеродным атомам присоединяют боковые радикалы, например, трипептид фен-глу-ала записывают следующим образом: 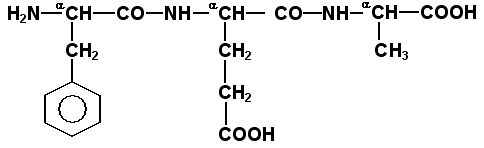 Определённые трудности вызывает написание пептидов, содержащих остатки пролина. В этом случае нужно иметь в виду, что радикал пролина присоединяется не только к α-углеродному атому, но и замещает атом водорода в α-аминогруппе. Например, пептид тре-гли-про записывается следующим образом: 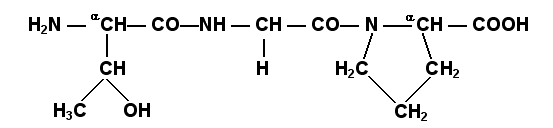 Научитесь давать названия пептидам. Запомните, что все аминокислотные остатки, входящие в состав полипептида (кроме С-концевого), имеют окончание –ил вместо –ин (таблица 1.1). Таким образом, названия названия представленных выше пептидов следующие: фенилаланил-глутамил-аланин и треонил-глицил-пролин соответственно. Обратите внимание на то, что названия остатков некоторых аминокислот (асн, асп, глн, глу, три, цис) образуются не по общему правилу. Запомните, что качественной реакцией на пептидную связь является биуретовая реакция. Вещества, содержащие не менее двух пептидных групп, образуют в щелочной среде с ионами Cu2+ комплексное соединение фиолетового цвета. 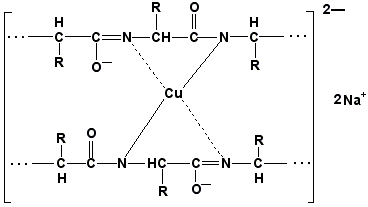 Ход опыта. К 5 каплям 1%-ного раствора яичного белка добавляют 5 капель 10%-ного раствора гидроксида натрия и 2 капли 1%-ного раствора сульфата меди, пробирку встряхивают, и её содержимое приобретает фиолетовую окраску. Обратите внимание, что интенсивность окрашивания пропорциональна содержанию белка в пробе, поэтому биуретовая реакция может быть использована для количественного определения белка в биологических жидкостях (например, в сыворотке крови). Для обнаружения аминокислот, содержащих α-аминогруппы, используется нингидриновая реакция. При нагревании в присутствии нингидрина происходит окислительное дезаминирование α-аминогрупп аминокислот и пептидов, а молекула нингидрина при этом восстанавливается. Восстановленный нингидрин реагирует с аммиаком и другой молекулой окисленного нингидрина, в результате чего образуется окрашенный комплекс синего или сине-фиолетового цвета: 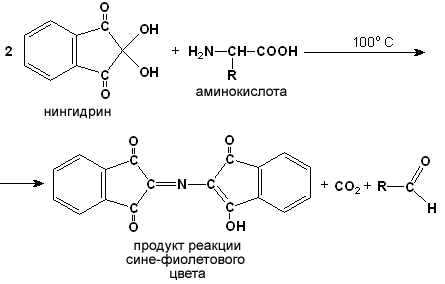 Ход опыта. К 5 каплям раствора α-аланина добавляют 2 капли 0,5%-ного водного раствора нингидрина и кипятят 1—2 минуты. В пробирке появляется розово-фиолетовое окрашивание, а с течением времени раствор синеет. Нингидриновая реакция широко применяется в процессе хроматографического разделения аминокислот на бумаге и количественного определения аминокислот. Раздел 1.3 Уровни структурной организации белков. Принято выделять четыре уровня структурной организации белковой молекулы: первичная, вторичная, третичная и четвертичная структура. Рассмотрим особенности каждого из этих уровней. 1. Первичной структурой белка называют последовательность чередования аминокислот в полипептидной цепи. Эту структуру формируют пептидные связи между α-амино- и α-карбоксильными группами аминокислот (см. раздел 1.2 настоящего курса). Первичная структура каждого белка уникальна и запрограммирована генетически. Выяснение аминокислотной последовательности белков представляет интерес по ряду причин. Во-первых, даже небольшие изменения первичной структуры белка в результате генных мутаций могут значительно изменять его свойства. Это приводит к нарушению нормальной функции белка, а следовательно, к развитию заболевания. Примеры заболеваний, развивающихся в результате изменения первичной структуры ферментного белка, будут рассмотрены в 5-й теме настоящего курса. Во-вторых, знание аминокислотной последовательности важно для выяснения молекулярной основы биологической активности белка. В-третьих, сравнительное изучение последовательностей аминокислот в белках позволяет проследить эволюцию форм жизни на молекулярном уровне. В-четвёртых, это необходимо для выяснения тех принципов, на основе которых из полипептидных цепей формируются высокоспецифичные пространственные структуры. Установлено, что последовательность аминокислотных остатков полипептидной цепи белка несёт в себе информацию, необходимую для формирования пространственной структуры белковой молекулы. Процесс сворачивания полипептидной цепи в правильную трёхмерную структуру получил название фолдинг. До последнего времени считалось, что формирование пространственной структуры белка происходит самопроизвольно, в отсутствие каких-либо компонентов. Однако сравнительно недавно выяснилось, что это справедливо только для относительно небольших белков (порядка 100 аминокислотных остатков). Для фолдинга крупных белков необходимы специальные протеины — шапероны, которые создают возможность быстрого формирования правильной пространственной структуры белка. 2. Вторичная структура белка представляет собой способ свёртывания полипептидной цепи в спиральную или иную конформацию. При этом образуются водородные связи между СО- и NН-группами пептидного остова одной цепи или смежных полипептидных цепей. Известны три основных типа вторичной структуры пептидных цепей: α-спираль, β-складчатый слой и неупорядоченный клубок (см. таблицу 1.2). α-Спираль Жёсткая структура. Имеет вид регулярной спирали, образующейся при помощи водородных связей в пределах одной полипептидной цепи. При этом СО-группа каждого аминокислотного остатка взаимодействует с NH-группой четвёртого от него остатка. Водородные связи ориентированы вдоль оси спирали, боковые радикалы аминокислот направлены наружу. 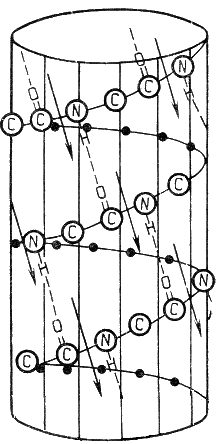 β-Складчатый слой Жёсткая структура. Образуется при помощи водородных в пределах одной или нескольких полипептидных цепей. Пептидные цепи расположены в одном направлении (параллельно) или в противоположных направлениях (антипараллельно), напоминая меха аккордеона. Боковые радикалы лежат выше и ниже плоскости слоя 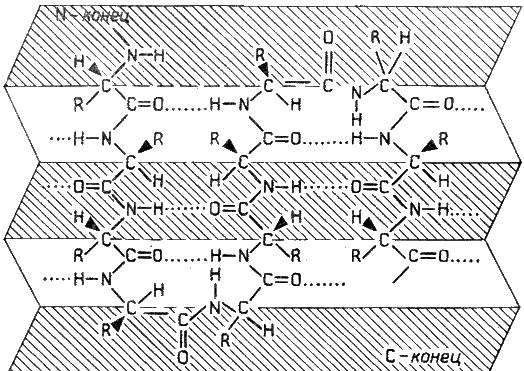 Неупорядоченный клубок Не имеет какой-либо правильной, периодической пространственной ориентации. В этих участках полипептидная цепь может легко изменять свою конформацию. Обратите внимание на то, что тип вторичной структуры белка определяется его первичной структурой. Например, в месте расположения остатка пролина (атомы пирролидинового кольца в пролине лежат в одной плоскости) пептидная цепь делает изгиб, и водородные связи между аминокислотами не образуются. Поэтому белки с высоким содержанием пролина (например, коллаген) не способны образовывать a-спираль. Радикалы аминокислот, несущие электрический заряд, также препятствуют спирализации. Если в пределах одного витка (примерно 4 аминокислотных остатка) находятся два таких радикала (или более), они взаимодействуют и деформируют спираль. 3. Третичная структура белка – это пространственная ориентация полипептидной спирали. Основную роль в образовании третичной структуры белка играют водородные, ионные, гидрофобные и дисульфидные связи, которые образуются в результате взаимодействия между радикалами аминокислот. Водородные связи образуются между двумя полярными незаряженными радикалами, например, радикалами серина и глутамина: 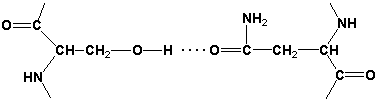 Ионные связи могут возникать между противоположно заряженными радикалами, например, радикалами глутамата и аргинина: 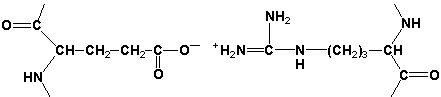 Гидрофобные взаимодействия характерны для неполярных радикалов, например, валина и лейцина: 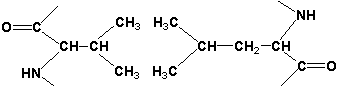 Дисульфидные связи образуются между SН-группами двух радикалов цистеина, находящихся в разных участках полипептидной цепи: 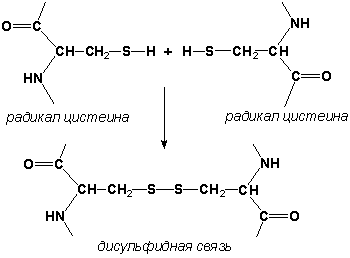 По форме молекулы и особенностям формирования третичной структуры белки делят на глобулярные и фибриллярные. Познакомьтесь с особенностями этих групп белков, научитесь давать их характеристику, запомните примеры (таблица 1.3).
4. Четвертичная структура белка – размещение в пространстве взаимодействующих между собой нескольких полипептидных цепей белка. Четвертичная структура - высший уровень организации белковой молекулы — более половины известных белков её не имеют. Белки, обладающие четвертичной структурой, называют также олигомерными белками, а полипептидные цепи, входящие в их состав, — субъединицами или протомерами. В некоторых белках такие субъединицы одинаковы или имеют сходное строение, а другие белки состоят из субъединиц с цепями разных типов. Каждый из протомеров синтезируется в виде отдельной полипептидной цепи, которая сворачивается в глобулу и затем соединяется с другими протомерами. Объединение идёт путём самосборки. Каждый из протомеров содержит участки, комплементарные другим протомерам. Взаимодействие между контактными участками протомеров происходит при помощи гидрофобных, ионных и водородных связей. Олигомерные белки имеют несколько устойчивых конформаций и обладают аллостерическими свойствами, то есть способны обратимо переходить из одной конформации в другую с изменением своей функциональной активности. Примером таких белков может служить эритроцитарный белок гемоглобин. Многие ферменты также характеризуются аллостерическими свойствами. Более подробно функционирование аллостерических белков будет рассмотрено в 3-й теме настоящего курса. 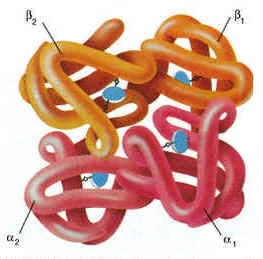 Рисунок 1.4. Пространственное строение гемоглобина. В состав его молекулы входят четыре попарно одинаковые субъединицы, обозначаемые буквами α и β. Небелковая часть гемоглобина — гем — показана синим цветом. Известны некоторые белки, молекула которых состоит из двух или более полипептидных цепей, соединённых дисульфидными связями (например, тромбин — фермент, участвующий в свёртывании крови). Подобные белки нельзя отнести к олигомерным. Такие белки образуются из единой полипептидной цепи в результате частичного протеолиза — локального расщепления пептидных связей. Аллостерическими свойствами, характерными для олигомерных белков, такие белки не обладают. 1. Главными физико-химическими свойствами белков являются молекулярная масса, электрический заряд и растворимость в воде. Молекулярная масса белков может значительно варьировать. Например, гормон инсулин имеет молекулярную массу около 6 тыс. Да, а иммуноглобулин М - около 1 млн. Да. Молекулярная масса белка зависит от количества аминокислотных остатков, входящих в его состав, а также массы неаминокислотных компонентов. Масса одного остатка аминокислоты в среднем составляет 110 Да. Таким образом, зная количество остатков аминокислот в белке, можно оценить его молекулярную массу и наоборот (Н.Н.Мушкамбаров, 1995). Электрический заряд белка определяется соотношением положительно и отрицательно заряженных групп на поверхности его молекулы. Заряд белковой частицы зависит от рН среды. Для характеристики белка используют понятие «изоэлектрическая точка». Изоэлектрическая точка (pI) — значение pH среды, при котором суммарный заряд белковой частицы равен нулю. В изоэлектрической точке белки наименее устойчивы в растворе и легко выпадают в осадок. Величина pI зависит от соотношения кислых и основных аминокислот в белке. Для белков и пептидов с преобладанием кислых аминокислот (отрицательно заряженных при pH 7,0) значение pI находится в кислой среде; для белков и пептидов с преобладанием основных аминокислот (положительно заряженных при pH 7,0) значение pI находится в кислой среде. Изоэлектрическая точка — характерная константа белков, её значение для большинства белков животных тканей лежит в пределах от 5,5 до 7,0, что свидетельствует о преобладании в их составе кислых аминокислот. Однако в природе имеются белки, у которых значение изоэлектрической точки лежит при крайних значениях pH среды. В частности, величина pI пепсина (фермента желудочного сока) равна 1, в лизоцима (фермента, расщепляющего клеточную стенку микроорганизмов) — около 11. Значения молекулярной массы и изоэлектрической точки некоторых белков приведены в таблице 1.4. Альбумин сывороточный 66 000 4.9 Альбумин яичный 45 000 4.6 α-Амилаза 50 000 5.3 Гаптоглобин 85 000 4.2 Гемоглобин 65 000 6.8 Гистоны 15 000 10.8 Иммуноглобулин А 150 000 7.3 Иммуноглобулин G 150 000 5.8 Иммуноглобулин М 950 000 6.6 Инсулин 5 780 5.35 Карбоксипептидаза 34 400 6.0 Каталаза 245 000 5.6 β-Лактоглобулин 37 100 5.2 Лизоцим 14 000 11.0 α2-Макроглобулин 820 000 5.4 Миоглобин 16 000 7.0 Орозомукоид 41 000 2.8 Пепсин 35 000 1.0 Рибонуклеаза 13 700 7.8 Трансферрин 88 000 5.4 Трипсиноген 24 000 9.3 Уреаза 480 000 5.0 Фибриноген 340 000 5.8 Химотрипсиноген 25 700 9.5 Церулоплазмин 151 000 4.4 Цитохром с 12 400 10.7 Растворимость белков в воде. Из курса биофизической химии известно, что белки как высокомолекулярные соединения образуют коллоидные растворы. Стабильность растворов белков в воде определяется следующими факторами: величиной коллоидных частиц – чем они меньше, тем устойчивей раствор; величиной заряда частиц – чем больше заряд частицы, тем стабильнее раствор; величиной гидратной (сольватной) оболочки – чем больше сольватационной воды содержит коллоид, тем он устойчивее. Имейте в виду, что под действием различных физических и химических факторов может происходить осаждение белков из коллоидных растворов. Различают: обратимые реакции осаждения (высаливание), когда осадок белка можно вновь растворить в воде с восстановлением его исходных физико-химических и биологических свойств; необратимые реакции осаждения под действием факторов, вызывающих грубые нарушения структурной организации белковой молекулы (денатурацию). Заметьте, что в основе реакций осаждения белков могут лежать следующие механизмы: нейтрализация электрического заряда – при добавлении электролитов (кислот, щелочей, солей); разрушение гидратной оболочки – при добавлении водоотнимающих веществ (спирта, ацетона, концентрированных растворов электролитов) и при нагревании; увеличение размеров коллоидных частиц – под действием факторов, вызывающих денатурацию белка. Чаще всего для действия факторов, вызывающих осаждение белков, характерно сочетание двух или всех трёх перечисленных механизмов. Биологическая активность. В основе функционирования любого белка лежит его способность к избирательному взаимодействию со строго определёнными молекулами или ионами — лигандами. Например, для ферментов, катализирующих химические реакции, лигандами будут вещества, участвующие в этих реакциях (субстраты), а также кофакторы, активаторы и ингибиторы. Для транспортных белков лигандами являются транспортируемые вещества и т.д. Лиганд способен взаимодействовать с определённым участком белковой молекулы — центром связывания или активным центром. Этот центр формируется пространственно сближенными радикалами аминокислот на уровне третичной структуры белка. Способность лиганда взаимодействовать с центром связывания обусловлена их комплементарностью, то есть взаимным дополнением их пространственной структуры (подобно взаимодействию «ключ — замок»). Между функциональными группами лиганда и центра связывания образуются нековалентные (водородные, ионные, гидрофобные) связи. Комплементарностью лиганда и центра связывания можно объяснить высокую специфичность (избирательность) взаимодействия белок — лиганд. Итак, различные белки отличаются друг от друга по своим физико-химическим свойствам и биологической активности. На этих различиях основаны методы разделения белковых смесей на фракции и выделения отдельных ферментных белков. Данные методы широко используются в медицинской биохимии и биотехнологии. 2. Денатурация белков – это изменение нативных (природных) физико-химических и, главное, биологических свойств белка вследствие нарушения его четвертичной, третичной и даже вторичной структуры. Денатурацию белка могут вызвать: температура выше 60°С; ионизирующая радиация; концентрированные кислоты и щёлочи; соли тяжёлых металлов (ртути, свинца, кадмия); органические соединения (спирты, фенолы, кетоны). Для денатурированных белков характерно: изменение конформации молекулы; уменьшение растворимости в воде; изменение заряда молекулы; меньшая устойчивость к действию протеолитических ферментов; потеря биологической активности. Это можно объяснить разрушением нативной третичной структуры белка, на уровне которой формируется центр связывания лигандов. Обратите внимание, что при определённых условиях возможно восстановление исходной (нативной) конформации белка после удаления фактора, вызвавшего денатурацию. Этот процесс получил название ренативации. Запомните некоторые примеры использования процесса денатурации белков в медицине: для осаждения белков плазмы крови при определении содержания небелковых веществ в крови; при проведении дезинфекции и санитарной обработки; при лечении и профилактике отравлений солями тяжёлых металлов (в качестве противоядия применяют молоко или яичный белок); для получения лекарственных веществ белковой природы (используется денатурация в мягких условиях с последующей ренативацией). |
