ответы экзамен. Эволюция пищеварительной системы и особенности питания у представителей разных классов позвоночных животных
 Скачать 7.56 Mb. Скачать 7.56 Mb.
|
|
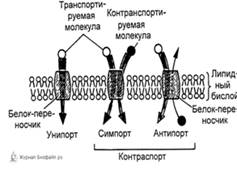
84. Индуцированный ионный транспорт через биологические мембраны. Подвижные переносчики. Каналообразующие агенты.
Подвижные переносчики. Каналообразующие агенты - смотреть в предыдущем вопросе в облегченной диффузии. 85. Характеристика ионных насосов, осуществляющих активный транспорт в биологических мембранах. Ионные насосы (помпы) – интегральные белки, которые обеспечивают активный перенос ионов против градиента концентрации. Энергией для транспорта служит энергия гидролиза АТФ. Различают Na+/K+ помпу (откачивает из клетки Na+ в обмен на К+), Ca2+ помпу (откачивает из клетки Ca2+), Cl– помпу (откачивает из клетки Cl–) и Н+ помпу. В результате работы ионных насосов создаются и поддерживаются трансмембранные ионные градиенты: • концентрация Na+, Ca2+, Cl– внутри клетки ниже, чем снаружи (в межклеточной жидкости); • концентрация K+ внутри клетки выше, чем снаружи. Активный транспорт веществ через биологические мембраны имеет огромное значение. За счет активного транспорта в организме создаются разности концентраций, разности электрических потенциалов, давления, поддерживающие жизненные процессы, то есть с точки зрения термодинамики активный перенос удерживает организм в неравновесном состоянии, поддерживает жизнь, так как равновесие – это смерть организма. Существование активного транспорта веществ через биологические мембраны впервые было доказано в опытах Усинга (1949 год) на примере переноса ионов натрия через кожу лягушки (рис. 8). Экспериментальная камера Усинга, заполненная нормальным раствором Рингера, была разделена на две части свежеизолированной кожей лягушки. В опыте исследовали однонаправленные потоки ионов натрия через кожу лягушки в прямом и обратном направлениях. 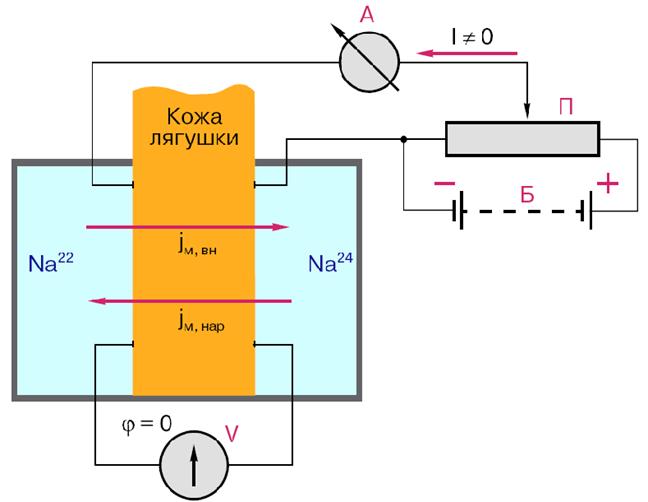 Рис. 8. Схема опыта Уисинга на коже лягушки. V – вольтметр для измерения разности потенциалов на коже лягушки, А – амперметр для измерения трансмембранного тока, Б – батарейка, П – потенциометр. Суммарный поток ионов через мембрану должен был бы отсутствовать. Его наличие свидетельствовало бы о переносе ионов против перепада концентрации, то есть об активном переносе. Для доказательства этого в левую часть экспериментальной камеры были добавлены радиоактивные изотопы 22Na, а в правую – 24Na. 22Na распадается с излучением жестких γ-квантов, излучение 24Na фиксировалось по мягким β-лучам. Было показано, что поток 22Na больше потока 24Na. О наличии тока в цепи свидетельствовали и показания миллиамперметра. Эти экспериментальные данные неопровержимо свидетельствовали о том, что перенос ионов натрия через кожу лягушки не подчиняется уравнению пассивного транспорта. Более того, оказалось, что суммарный поток ионов натрия исключительно чувствителен к факторам, влияющим на энергетический обмен в клетках кожи: наличию кислорода, действию разобщителей окислительного фосфорилирования, действию низких температур. Следовательно, речь должна идти об особом способе переноса ионов, названном впоследствии активным. Позднее было установлено, что активный перенос ионов натрия в коже лягушки обеспечивается ионными насосами, локализованными в клетках базального эпителия. Работа насоса блокировалась специфическим ингибитором оуабаином. Дальнейшие исследования показали, что в биологических мембранах имеется несколько разновидностей ионных насосов, работающих за счет свободной энергии гидролиза АТФ, – специальные системы интегральных белков (транспортные АТФазы) (рис. 9). Перенос ионов транспортными АТФазами происходит вследствие сопряжения процессов переноса с химическими реакциями за счет энергии метаболизма клеток. 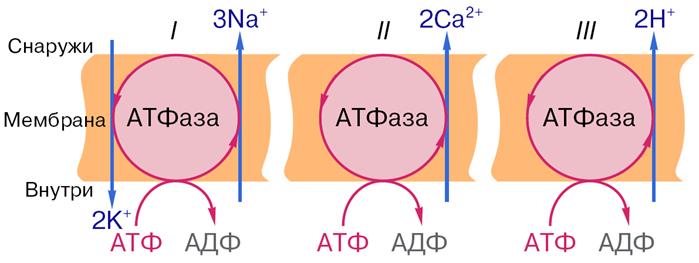 Рис. 9. Активный перенос ионов транспортными АТФазами: I – схема К+-Na+- насоса в клеточной мембране, II – схема кальциевого насоса в мембране саркоплазматического ретикулума, III – схема протонного насоса во внутренней мембране митохондрий. 2.2. Na+/K+-АТФаза Na/K-АТФаза представляет собой сложный белок, встроенный в наружную мембрану клетки и имеющий центры связывания для ионов натрия и калия, а также активный центр, где осуществляются связывание и гидролиз АТФ (рис. 10). Функциональная единица фермента состоит из двух полипептидных цепей: большей (α-субъединицы) и меньшей (β-субъединицы), входящих в состав ферментного комплекса в соотношении 1:1. Меньшая субъединица пересекает мембрану только один раз, в то время как большая – много раз, образуя 5 двойных петель, при этом оба конца пептидной цепи обращены в цитоплазму. Активный центр фермента также обращен в цитоплазму и доступен для цитоплазматического АТФ. Центры связывания переносимых ионов локализованы в петле между второй и третьей спиралями, пронизывающими мембрану. Таким образом, α-субъединица может выполнять функцию насоса независимо от β-субъединицы. Однако оба полипептида образуют компактную глобулу, насквозь пронизывающую мембрану. Та часть β-субъединицы, которая обращена во внеклеточную среду, несет на себе ковалентно присоединенные углеводные фрагменты. 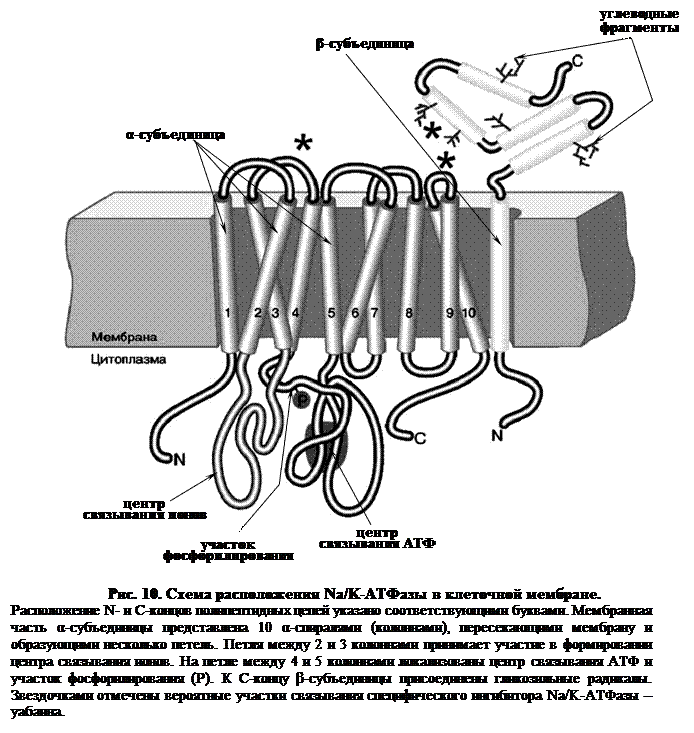 По массе и наличию углеводов этот полипептид можно отнести к лектинам – мембранным гликопротеинам, которые отвечают за межклеточное узнавание и адгезию. В процессе белкового синтеза обе субъединицы встраиваются в мембрану одновременно. Существуют данные, согласно которым β-субъединица обеспечивает правильную ориентацию α-субъединицы в мембране. Гидролизуя АТФ, чтобы обеспечить энергией активный транспорт ионов, Na/K-АТФаза осуществляет сложную многостадийную реакцию, в которой участвуют ионы натрия, калия и магния, а также АТФ. Фермент имеет лабильную структуру. Он легко изменяет свою конформацию (так называют взаимное расположение и упаковку отдельных частей молекулы белка в пространстве) в зависимости от того, какой ион к нему присоединяется. По массе и наличию углеводов этот полипептид можно отнести к лектинам – мембранным гликопротеинам, которые отвечают за межклеточное узнавание и адгезию. В процессе белкового синтеза обе субъединицы встраиваются в мембрану одновременно. Существуют данные, согласно которым β-субъединица обеспечивает правильную ориентацию α-субъединицы в мембране. Гидролизуя АТФ, чтобы обеспечить энергией активный транспорт ионов, Na/K-АТФаза осуществляет сложную многостадийную реакцию, в которой участвуют ионы натрия, калия и магния, а также АТФ. Фермент имеет лабильную структуру. Он легко изменяет свою конформацию (так называют взаимное расположение и упаковку отдельных частей молекулы белка в пространстве) в зависимости от того, какой ион к нему присоединяется.Уже в ранних исследованиях было показано, что в присутствии натрия фермент легко взаимодействует с АТФ, в результате чего терминальный фосфат АТФ переносится на карбоксил аспарагиновой кислоты белковой цепи, образуя фосфорилированный фермент (Е–Р, где Е обозначает молекулу белка-фермента, а Р – фосфорильный остаток). Фосфофермент является промежуточным продуктом АТФазной реакции. Он может находиться в двух конформационных состояниях, условно обозначаемых как Е1 и Е2. Первая форма обладает повышенным сродством к ионам натрия, а вторая – к ионам калия. Переход между ними сопровождается изменением сродства белковой молекулы к переносимым катионам. В настоящее время цикл Na/K-АТФазы охарактеризован более подробно. Основные стадии можно описать следующим образом (рис. 11). 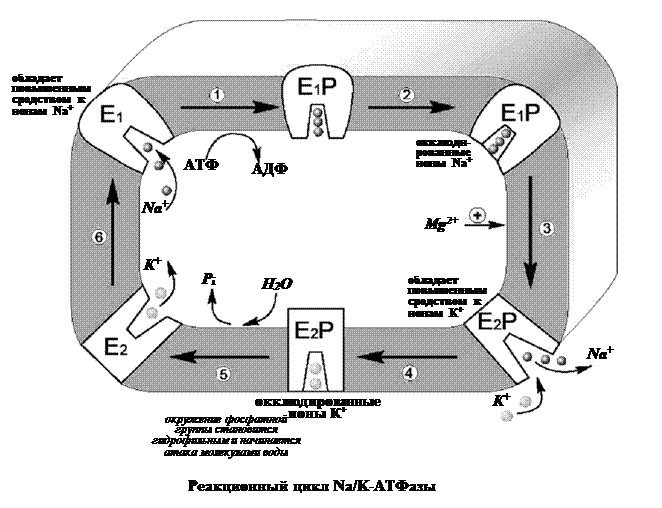 Когда фермент находится в состоянии Е1, он способен взаимодействовать с ионами натрия и АТФ с нутренней стороны мембраны. В результате фосфорилирования молекулы образуется E1P, а АДФ высвобождается из активного центра и возвращается в цитоплазму. Фосфорилированный белок переходит в состояние, при котором ионы натрия не способны высвобождаться ни по внутреннюю, ни по внешнюю стороны мембраны – они недоступны для обмена, окклюдированы. Переход фермента в следующую стадию активируется ионами магния. Хотя специальных центров связывания магния на молекуле фермента не обнаружено, его эффект очень важен – он заключается в ускорении перехода фосфорилированного фермента из конформации E1 в конформацию Е2. Эта стадия отражает молекулярные перемещения отдельных частей белковой глобулы, связанные с непосредственным переносом ионов натрия через мембрану. Таким образом, этот процесс осуществляется синхронно с конформационным переходом E1 – Е2. Вследствие этого окружение центра связывания ионов становится более гидрофобным, и ионы натрия диссоциируют от фермента по другую сторону мембраны, где с этим же центром связываются ионы калия. Калий подвергается такой же окклюзии, что и натрий, и в ходе этого процесса осуществляется перенос ионов калия через мембрану. Конформационная перестройка, претерпеваемая белком при переходе E1 – Е2, обеспечивает перестройку ионных центров и последующее перемещение петли, содержащей центр связывания ионов, внутрь мембраны. Это приводит к изменению сродства к переносимым ионам и одновременно делает ионный центр доступным для внешней или внутренней среды. Комплекс Е2Р отличается от своего предшественника тем, что окружение фосфатной группировки становится более гидрофильным и фосфат оказывается доступным для атаки молекулой воды. Происходят водный гидролиз Е–Р (дефосфорилирование фосфофермента) и высвобождение неорганического фосфата во внутриклеточную среду. После этого ионы калия также диссоциируют от центра связывания, высвобождаясь в цитоплазму. Последняя стадия цикла одновременно подготавливает фермент для начала нового цикла – конформер Е2 превращается в конформер E1, вновь приобретающий способность взаимодействовать с ионами натрия. Этот процесс ускоряется АТФ, повышающим сродство фермента к натрию и понижающим его сродство к калию. 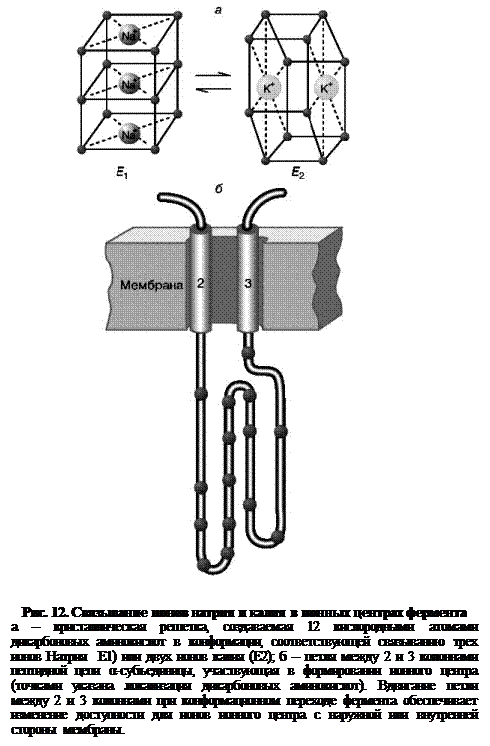 Таким образом, за полный гидролитический цикл происходят выброс из клетки трех ионов натрия, обогащение цитоплазмы двумя ионами калия и гидролиз одной молекулы АТФ. Так происходит активный транспорт ионов натрия из клетки и калия в клетку, а энергия АТФ тратится на оплату перехода фермента из одной конформации в другую. Таким образом, в ходе ферментативного процесса перенос ионов натрия и калия осуществляется одним и тем же ионным центром фермента, последовательно изменяющим свое сродство к переносимым ионам при изменении конформации Na/K-АТФазы. Таким образом, за полный гидролитический цикл происходят выброс из клетки трех ионов натрия, обогащение цитоплазмы двумя ионами калия и гидролиз одной молекулы АТФ. Так происходит активный транспорт ионов натрия из клетки и калия в клетку, а энергия АТФ тратится на оплату перехода фермента из одной конформации в другую. Таким образом, в ходе ферментативного процесса перенос ионов натрия и калия осуществляется одним и тем же ионным центром фермента, последовательно изменяющим свое сродство к переносимым ионам при изменении конформации Na/K-АТФазы.Ионные центры фермента расположены в петле между 2 и 3 α-спиральными участками фермента, пересекающими мембрану. Взаимодействие ионов с этими центрами обеспечивается благодаря координационным связям с атомами кислорода, принадлежащими дикарбоновым аминокислотам белка – аспарагиновой и глутаминовой. В образовании координационных связей с ионами должны принимать участие 12 атомов кислорода карбоксильных групп дикарбоновых аминокислот белка. Точная упаковка этой петли не установлена, однако в ее состав входят 15 дикарбоновых аминокислот, так что выбор групп для образования центра связывания ионов вполне достаточен. Кислород способен осуществлять координационные взаимодействия с лигандами, образуя решетку одного из двух типов. В одном случае получается рыхлая и доступная для молекул воды структура, а в другом атомы упакованы более плотно и не доступны для гидрофильных группировок. В первом случае ионный центр может связать три иона натрия, а во втором – два иона калия. Этим и объясняется тот факт, что при гидролизе одной молекулы АТФ фермент обменивает три иона натрия на два иона калия (рис. 12). Активность Na/K-АТФазы в клетке регулируется многими факторами. На первом месте стоят соотношение Na/K и доступность АТФ – это факторы так называемой краткосрочной регуляции активности. Содержание АТФ в клетке, как правило, мало изменяется в нормальных условиях, хотя может резко снижаться при патологических нарушениях. В таком случае снижение уровня АТФ будет критическим для поддержания достаточной активности Na/K-насоса. Соотношение Na/K в клетках зависит от многих факторов и, в свою очередь, является фактором, регулирующим функционирование Na/K-насоса. |