пп. Федеральное государственное бюджетное образовательное учреждение высшего образования Саратовский государственный аграрный университет имени Н. И. Вавилова
 Скачать 170.96 Kb. Скачать 170.96 Kb.
|
OOС–СН2СН2–СOONa 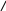   N–СН2–СН2–N N–СН2–СН2–N NaOOС–СН2 СН2–СOOМеn+ Раствор ЭДТА всегда является титрантом, т.е. помещается в бюретку. На протекание реакции существенно влияет кислотность среды. Так, при определении катионов Mg2+, Ca2+ титрование проводится в щелочной среде, которая создается аммиачным буферным раствором (смесь NH4OH + NH4Cl). Катионы Fe3+ титруются в кислом растворе. Индикаторы в комплексонометрииКомплексонометрическое титрование проводится в присутствие специальных индикаторов – органических красителей. Их называют металлоиндикаторами, т.к. они образуют интенсивно окрашенные комплексные соединения с металлами. Наиболее распространенные из них: эриохром черный Т и мурексид. При добавлении индикатора эриохрома черного Т к анализируемому раствору, например раствору соли кальция в щелочной среде, образуется металлоиндикаторный комплекс винно-красного цвета. При титровании раствором ЭДТА металлоиндикаторный комплекс разрушается и образуется более прочный комплекс металла с комплексоном. Индикатор, выделяясь в свободном виде, сообщает раствору синюю окраску. Схематично эти процессы можно изобразить: Ca2+ + Ind → CaInd (металлоиндикаторный комплекс, винно-красный) CaInd + ЭДТА → CaЭДТА + Ind (индикатор, синий) Индикатор мурексид также образует окрашенные комплексы с металлами. Так с катионами Ca2+ образуется соединение красного цвета, с катионами Cu2+, Co2+, Ni2+ - желтого. Окраска индикатора в точке эквивалентности фиолетовая (щелочная среда). Рабочий раствор комплексонометрииРабочий раствор ЭДТА готовят растворением Na2H2C10H12O8N22H2O в воде. Точную концентрацию раствора устанавливают по раствору сульфата магния из фиксанала или хлорида цинка, полученного растворением точной навески металлического цинка в соляной кислоте. Часто растворы ЭДТА готовят из фиксанала. Растворы устойчивы при хранении. Применение комплексонометрииПоскольку комплексоны образуют координационные соединения почти со всеми катионами, комплексонометрия применима для определения большого числа катионов металлов. Классическим примером комплексонометрического анализа служит нахождение общей жесткости воды (сумма Ca2+ и Mg2+) с индикатором эриохромом черным Т. Кальций и магний определяют в почве, минеральных водах, молоке, при анализе минералов (известняк, доломит, магнезит). При раздельном определении этих элементов кальций титруется в щелочной среде с мурексидом, а содержание магния рассчитывают по разности. Кроме этого прямым титрование раствором ЭДТА определяются Cu2+, Zn2+, Co2+, Ni2+, Pb2+, Fe3+ и др. |
