пп. Федеральное государственное бюджетное образовательное учреждение высшего образования Саратовский государственный аграрный университет имени Н. И. Вавилова
 Скачать 170.96 Kb. Скачать 170.96 Kb.
|
Лекция 4СТАДИИ ГРАВИМЕТРИЧЕСКОГО АНАЛИЗА ОсаждениеОсаждение– стадия гравиметрического анализа, цель которой – перевод определяемого компонента из раствора в малорастворимое соединение. Условия осаждения различаются в случае образования кристаллических и аморфных осадков. Для первых необходимо создавать условия, чтобы осадок получился достаточно крупнокристаллическим. Это уменьшает возможность потери осадка при прохождении через поры фильтра. Вообще, с такими осадками удобно работать во всех отношениях: они легко фильтруются и промываются. Для получения крупнокристаллического осадка необходимо низкое пересыщение раствора в процессе осаждения и небольшая скорость образования осадка. Для достижения этой цели используют следующие приемы: Осаждение проводят из разбавленных растворов. Осадитель прибавляют медленно, по каплям. Осаждение проводят при постоянном перемешивании для предотвращения сильных местных пересыщений. Осаждение ведут из горячего раствора, т.к. растворимость большинства осадков увеличивается с повышением температуры. Осаждение ведут при наименьшем значении рН, при котором возможно осаждение. Многие осадки растворимы в относительно более кислой среде, поэтому скорость образования осадка ниже. Образовавшемуся осадку дают определенное время постоят для созревания или старения. При этом происходит рост более крупных кристаллов за счет мелких, являющихся более растворимыми. За счет их растворения и перекристаллизации на более крупные кристаллы происходит также совершенствование кристаллической структуры. При этом происходит частичное освобождение осадка от примесей, осадок получается более чистый. Для аморфных осадков следует создавать условия, препятствующие их пептизации переходу в коллоидный раствор. Кроме того, обладая развитой поверхностью, объемистые аморфные осадки сильно адсорбируют примеси. Условия образования аморфных осадков во многом противоположны тем, которые требуются для получения кристаллических осадков: Осаждение проводят в присутствие электролита-коагулятора. Осаждение проводят из концентрированных растворов концентрированным раствором осадителя, который следует прибавлять быстро. В этих условиях аморфные осадки образуется не столь рыхлыми, лучше оседают на дно, легче отмываются от примесей. Аморфным осадкам после осаждения не дают стоять, и сразу подвергают дальнейшим операциям – фильтрованию и промыванию. При стоянии такой осадок легко загрязняется примесями. Выбирая осадитель, предпочтение отдают летучим веществам. В этом случае его остаток, не удаленный при промывании, улетучиться при прокаливании. Поэтому, например, Fe3+ осаждают действием NH4OH, а не NaOH или KOH; Ba2+ осаждают действием H2SO4, а не Na2SO4 или K2SO4. Осадитель обычно берут в некотором избытке по сравнению со стехиометрическим количеством (обычно в полуторократном). Это необходимо для достижения полноты осаждения. Так растворимость осадка хлорида серебра подавляется добавлением избытка нитрата серебра, т.к. равновесие реакции: AgCl ↔ Ag+ + Cl- при увеличении концентрации Ag+ смещается влево. Однако слишком большой избыток осадителя использовать нельзя, т.к. в этом случае возможно наоборот увеличение растворимости осадка вследствие протекания реакций образования комплексных соединений, кислых солей, растворимости амфотерных соединений. Так при избытке NH4OH при осаждении алюминия в виде Al(OH)3 возможно образование растворимого алюмината вследствие амфотерности гидроксида алюминия: Al(OH)3 + OH- = AlO2- + 2H2O. При осаждении свинца в виде сульфата серной кислотой, в избытке осадителя возможно образование растворимого гидросульфата: PbSO4 + H2SO4 = Pb(HSO4)2. Фильтрование и промывание осадкаФильтрование– стадия гравиметрического анализа, цель которой – отделение образовавшегося осадка от раствора. Для фильтрования применяют так называемые беззольные фильтры, которые изготавливаются из специально обработанной фильтровальной бумаги. При сгорании таких фильтров образуется очень мало золы (масса золы указывается на упаковке фильтров). Масса золы настолько мала, что ею можно пренебречь. Однако, если она сопоставима с массой осадка, то ее вычитают из массы осадка. Фильтры бывают различной плотности. Плотность фильтра обозначается цветом бумажной ленты на упаковке. Фильтры с красной (или черной) лентой крупнопористые, они применяются для студенистых аморфных осадков. Для фильтрования большинства осадков берут фильтры средней плотности (белая лента). Фильтры с синей лентой («баритовые») наиболее плотные, применяются для мелкокристаллических осадков (например, BaSO4). Фильтр вкладывают в стеклянную воронку, которую вставляют в кольцо штатива, под воронку подставляют химический стакан. Применяются также специальные фильтрующие воронки из стекла и впаянной пористой стеклянной пластинкой, которая является фильтрующим слоем. Фильтрование проводят, используя водоструйный или вакуум-насос. Цель промыванияосадка– удаление с него адсорбированных примесей. Редко промывают осадок на фильтре. Чаще осадок промывают декантацией, т.е. в воронку с фильтром осторожно сливают жидкость, находящуюся над осадком, стараясь его не взмучивать. Жидкость следует сливать по стеклянной палочке, ее конец следует держать ближе к трехслойной части фильтра, но не касаясь его. В стакан с осадком прибавляют промывную жидкость, перемешивают, дают частицам осадка осесть и снова сливают жидкость на фильтр. Промывание проводят несколько раз небольшими порциями промывной жидкости. Последнюю порцию промывной жидкости анализируют на содержание следов примеси. После этого осадок количественно(т.е. без потерь) переносят на фильтр, взмутив его с порцией промывной жидкости. Стакан и палочку обмывают из промывалки промывной жидкостью. Последние частицы снимают кусочком беззольного фильтра, который также помещают на фильтр. 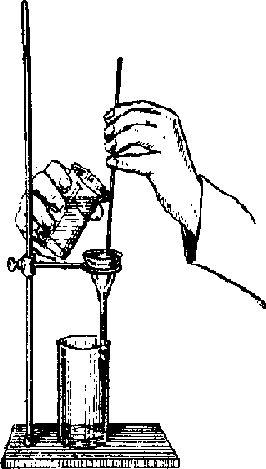 Рисунок 3. Фильтрование осадка При промывании осадка следует исключить потери за счет растворения. При выборе промывной жидкости руководствуются следующим: Промывание дистиллированной водой применимо лишь в случае практически нерастворимых осадков, не склонных к гидролизу, пептизации. Например, дистиллированной водой промывают осадок BaSO4. Обычно осадок промывают разбавленным раствором осадителя. Введение осаждающего иона подавляет растворимость осадка. Так, осадок CaC2O4, заметно растворимый в воде, промывают разбавленным раствором осадителя (NH4)2C2O4. Склонные к пептизации осадки промывают разбавленным раствором электролита-коагулятора. Например, аморфный осадок Fe(OH)3 промывают разбавленным раствором NH4NO3. Высушивание и прокаливание осадкаВ результате этой стадии осаждаемая форма переходит в весовую. Высушивание проводят, помещая воронку с фильтром и осадком в сушильный шкаф (t = 90-1050С). Высушивание может быть использовано как анализ на содержание в образце влаги. Проба образца обычно высушивается в стеклянном бюксе. Высушивают также осадки, полученные при реакциях с органическими веществами. Для прокаливания фильтр с осадком помещают в фарфоровый или платиновый тигель. При прокаливании сгорает фильтр и удаляются летучие компоненты. Прокаливать можно на газовой горелке, поместив тигель в специальный фарфоровый треугольник или в муфельной печи (температура зависит от типа печи и составляет обычно от 800 до 12000С). Горячий тигель помещают остывать в эксикатор – сосуд с пришлифованной крышкой, в нижней части которого находится водоотнимающее средство (например, прокаленный CaCl2). Эксикатор защищает осадок от влаги воздуха. ВзвешиваниеПосле охлаждения осадок взвешивают. Взвешивание проводится на аналитических весах с точностью до четырех цифр после запятой. Взвешивание и прокаливание тигля с осадком проводят до постоянной массы. Т.е. снова прокаливают, охлаждают и взвешивают до тех пор, пока различия в результатах составит не более 0,0002 г. Вычисления в гравиметрииФормула расчета результата гравиметрического анализа выводится из пропорции: Мвес.ф. – Mопред. в-ва mвес.ф. – mопред. в-ва mопред. в-ва = mвес.ф. Mопред.вва M вес.ф. Отношение молекулярной массы определяемого вещества к молярной массе весовой формы называется факторпересчетаилигравиметрическийфактор: F = Mопред.вва Mвес.ф. Таблица 5 – Примеры вычислений некоторых факторов пересчета
Факторы пересчета приведены в справочниках. Для вычисления результата анализа нужно умножить соответствующий фактор пересчета на массу полученной весовой формы: mопред. в-ва = mвес.ф.. F. Вопросы для самоконтроляКакие условия необходимо соблюдать при осаждении кристаллических и аморфных осадков? Выбор осадителя. Какое из предложенных веществ: NaCl, KCl, HCl – вы выберете для осаждения ионов серебра в виде AgCl? Фильтрование и промывание осадка. Что такое декантация? Объясните смысл понятия «прокаливание до постоянной массы». Фактор пересчета. Задача: Вычислите факторы пересчета при определении: а) Ca по массе CaO, б) CaCO3 по массе CaO, в) Ca3(PO4)2 по массе CaO. Задача:Из навески типографского сплава массой 3,2485 г при гравиметрическом определении свинца в виде сульфата получено 3,5655 г PbSO4. Найти процентное содержание свинца в сплаве. Задача: Из навески удобрения - суперфосфата массой 0,4533 г при гравиметрическом определении фосфора получили 0,3240 г Mg2P2O7. Сколько процентов фосфора содержит суперфосфат? СПИСОК ЛИТЕРАТУРЫ Основная Сергеева И.В. Практикум по аналитической химии: учебное пособие/ И.В.Сергеева, Н.Н.Гусакова . т.в. Холкина, Т.Н. Сердюкова/ ФГБОУ ВПО «Саратовский ГАУ».- Саратов: Буква, 2015.-176 с. Основы аналитической химии: в 2-х кн. Т.1. Общие вопросы. Методы разделения: учебник / ред.: Ю.А. Золотов. – М.: Академия, 2010. – 384 с. Основы аналитической химии. В 2-х кн. Кн.2. Методы химического анализа: учебник / ред.: Ю.А. Золотов. – М.: Академия, 2010. – 408 с. Дополнительная Васильев, В. П. Аналитическая химия. Лабораторный практикум: пособие для вузов / В.П. Васильев, Р.П. Морозова, Л.А. Кочергина. – М.: Дрофа, 2004. – 416 с. Отто, М. Современные методы аналитической химии / М. Отто. – М.: Техносфера, 2006. – 416 с.  Практикум по аналитической химии: учебное пособие для студентов агрономических специальностей / ред. Г.Е. Рязанова. – Саратов: Изд-во СГАУ, 2003. – 163 с. Практикум по аналитической химии: учебное пособие для студентов агрономических специальностей / ред. Г.Е. Рязанова. – Саратов: Изд-во СГАУ, 2003. – 163 с.Харитонов, Ю. Я. Аналитическая химия (аналитика). В 2-х кн. Кн. 1. Общие теоретические основы. Качественный анализ / Ю.Я. Харитонов. – М.: Высшая школа, 2010. – 616 с. Харитонов, Ю. Я. Аналитическая химия (аналитика). В 2-х кн. Кн. 2. Количественный анализ. Физико-химические (инструментальные) методы анализа / Ю.Я. Харитонов. – М.: Высшая школа, 2010. – 560 с. Васильев, В. П. Аналитическая химия. В 2 кн. Кн. 1: Титриметрические и гравиметрический методы анализа: учебник для студентов вузов, обучающихся по химико-технологическим специальностям / В.П. Васильев. – М.: Дрофа, 2005. – 366 с. Лекция 5ТИТРИМЕТРИЯ Основы методаТитриметрическийанализ(титриметрия)основан на измерении объема раствора вещества, вступившего в реакцию с раствором другого вещества, концентрация которого известна. Таким образом проводится реакция между растворами двух веществ: один раствор с известной концентрацией, второй раствор является исследуемым, его концентрация определяется. При анализе один из растворов помещают в измерительный сосуд – бюретку, а другой в коническую колбу. Раствор из бюретки по каплям прибавляют к раствору, помещенному в коническую колбу до тех пор, когда количество одного из реагирующих веществ станет эквивалентно количеству другого в соответствии с уравнением химической реакции. Процесс называется титрование. Определив по результатам титрования количество одного из веществ, вступившее в химическую реакцию, рассчитывают количество определяемого вещества.  Рисунок 4. Оборудование титриметрического анализа: 1 – бюретка, 2 – коническая колба. Раствор в бюретке, которым титруют, называется титрант или рабочий раствор. Раствор в конической колбе, который подвергается титрованию, называется титруемый раствор. Момент, когда количество титранта эквивалентно количеству титруемого вещества называется точка эквивалентности. В этот момент титрование заканчивают, т.е. титруют до точки эквивалентности. Для установления точки эквивалентности используют индикаторы.Это вещества, которые в момент точки эквивалентности претерпевают какое-либо видимое изменение, обычно – изменение окраски. Классификация методов титриметрического анализаМетоды титриметрии классифицируют по типу химических реакций, лежащих в основе определения. Кислотно-основное титрование (метод нейтрализации). В его основе лежит реакция взаимодействия кислоты с основанием (т.е. реакция нейтрализации): H+ + OH- = H2O. Окислительно-восстановительноетитрование(редоксиметрия)основывается на окислительно-восстановительных реакциях. Здесь различают несколько методов, среди которых наиболее распространены: а) Перманганатометрия– применяется реакция окисления веществ раствором перманганата калия KMnO4; б) Йодометрия–окислителем служит раствор йода; в) Дихроматометрия– окисление раствором дихромата калия K2Cr2O7. Осадительное титрование. Основано на использовании реакций образования малорастворимых соединений. Примером может служить аргентометрия – вариант тириметрического анализа, основанный на реакции осаждения галогенидов серебра: Ag+ + Cl- = AgCl↓. Методыкомплексообразования. Наиболее распространенный вариант здесь – комплексонометрия. Этот метод основан на реакции между органическими веществами комплексонами и катионами металлов с образованием прочных металлоорганических комплексов. Способы выполнения титрованияПрямое титрование – представляет собой непосредственное титрование одного раствора другим. Обратноетитрование– заключается в том, что к исследуемому раствору добавляют заведомо избыточное количество реагента, и его непрореагировавший остаток титруют подходящим рабочим раствором. Например, к раствору хлорида прибавляют избыток нитрата серебра AgNO3. Его не вступивший в реакции избыток титруют раствором роданида аммония : Ag+ + SCNl- = AgSCN↓. Заместительное титрование – заключается в том, что к исследуемому раствору добавляют реагент, вступающий с ним в реакцию, и продукт взаимодействия титруют подходящим титрантом. Например, при йодометрическом определении меди (II) к анализируемому раствору добавляют йодид калия. Происходит реакция: 2Cu2+ + 4I- = 2CuI + I2. Выделившийся йод титруют раствором тиосульфата натрия Na2S2O3. Рабочие растворы в титриметрииРастворы для проведения титриметрического анализа могут готовиться разными способами. По способу приготовления различают стандартные (приготовленные) растворы и стандартизированные (установленные) растворы. Стандартные растворы готовят из точной навески вещества растворением ее в мерной колбе. Этот способ применим не к любым веществам, а лишь к тем, которые удовлетворяют требованиям: Вещество должно быть химически чистым; Его состав должен строго соответствовать химической формуле; Вещество должно быть устойчиво при хранении. Этим требованиям удовлетворяют: карбонат натрия Na2CO3, тетраборат натрия (бура) Na2B4O7, оксалат натрия Na2C2O4, щавелевая кислота H2C2O4 . 2H2O. Стандартные растворы нередко готовят из фиксаналов. Это стеклянные запаянные ампулы, содержащие точно отмеренные количества вещества. Для приготовления раствора содержимое ампулы количественно переносят в мерную колбу. Стандартизированные растворы готовят приблизительно нужной концентрации с последующим установлением ее точного значения путем титрования соответствующим стандартным раствором. К растворам, требующим стандартизации относятся растворы: гидроксиды натрия и калия (стандартизируются по щавелевой кислоте), серная и соляная кислоты (стандартизируются по тетраборату натрия). Концентрации растворов, применяемые в титриметрииМолярная концентрация СМ, моль/л – показывает число моль растворенного вещества в 1 л раствора и представляет собой отношение количества растворенного вещества к объему раствора. СМ = mMV Молярная концентрация эквивалента СН – показывает число моль эквивалентов растворенного вещества в 1 л раствора. СН = mMэквV ТитрТ, г/мл – показывает число г растворенного вещества в 1 мл раствора. Т = m V Вычисления в титриметрииВ основе вычислений лежит положение: при титровании вещества реагируют в эквивалентных количествах. Основная формула при титриметрических расчетах: СН1V1 = СН2V2, где СН – молярные концентрации эквивалента, V – объемы двух реагирующих веществ, отмеченных индексами 1 и 2. Например, если на титрование 10 мл раствора NaOH израсходовано 12,4 мл 0,1 н раствора H2C2O4, то молярная концентрация эквивалента раствора гидроксида натрия составит: СН(NaOH).V(NaOH) = СН(H2C2O4). V(H2C2O4); СН(NaOH) = CH(H2C2O4 )V(H2C2O4 ) = V(NaOH) 0,112,4 = 0,12 н. 10 Вопросы для самоконтроляВ чем заключается сущность титриметрического метода анализа? Основные понятия титриметрии: титрант, титруемое вещество, точка эквивалентности, индикатор. Оборудование титриметрического анализа. Какие реакции применяются в титриметрии, как называются основанные на них титриметрические методы? Стандартные и стандартизированные растворы, способы их приготовления. Вычисления в титриметрии. Задача:Какова молярная концентрация эквивалента раствора серной кислоты, если на титрование 10 мл его расходуется 9,5 мл 0,0952 н раствора NaOH? СПИСОК ЛИТЕРАТУРЫ Основная Сергеева И.В. Практикум по аналитической химии: учебное пособие/ И.В.Сергеева, Н.Н.Гусакова . т.в. Холкина, Т.Н. Сердюкова/ ФГБОУ ВПО «Саратовский ГАУ».- Саратов: Буква, 2015.-176 с. Основы аналитической химии: в 2-х кн. Т.1. Общие вопросы. Методы разделения: учебник / ред.: Ю.А. Золотов. – М.: Академия, 2010. – 384 с. Основы аналитической химии. В 2-х кн. Кн.2. Методы химического анализа: учебник / ред.: Ю.А. Золотов. – М.: Академия, 2010. – 408 с. Дополнительная Васильев, В. П. Аналитическая химия. Лабораторный практикум: пособие для вузов / В.П. Васильев, Р.П. Морозова, Л.А. Кочергина. – М.: Дрофа, 2004. – 416 с. Отто, М. Современные методы аналитической химии / М. Отто. – М.: Техносфера, 2006. – 416 с.  Практикум по аналитической химии: учебное пособие для студентов агрономических специальностей / ред. Г.Е. Рязанова. – Саратов: Изд-во СГАУ, 2003. – 163 с. Практикум по аналитической химии: учебное пособие для студентов агрономических специальностей / ред. Г.Е. Рязанова. – Саратов: Изд-во СГАУ, 2003. – 163 с.Харитонов, Ю. Я. Аналитическая химия (аналитика). В 2-х кн. Кн. 1. Общие теоретические основы. Качественный анализ / Ю.Я. Харитонов. – М.: Высшая школа, 2010. – 616 с. Харитонов, Ю. Я. Аналитическая химия (аналитика). В 2-х кн. Кн. 2. Количественный анализ. Физико-химические (инструментальные) методы анализа / Ю.Я. Харитонов. – М.: Высшая школа, 2010. – 560 с. Лекция 6КИСЛОТНО-ОСНОВНОЕ ТИТРОВАНИЕ (МЕТОД НЕЙТРАЛИЗАЦИИ) Кислоты и щелочи как рабочие растворы методаВ основе метода нейтрализациииликислотно-основного титрованиялежит реакция взаимодействия катионов H+ с анионами OH-: H+ + OH- = H2O (реакция нейтрализации). По этому методу определяют вещества щелочного характера, титруя их кислотами (ацидиметрия)или вещества кислотного характера, титруя их щелочами (алкалиметрия). Рабочими растворами метода являются растворы сильных кислот (обычно HCl, H2SO4) и щелочей (NaOH, KOH). Эти вещества не удовлетворяют требованиям, предъявляемым к стандартным растворам, поэтому их растворы нельзя приготовить по точной навеске. Для установления точной концентрации кислот обычно применяют тетраборат натрия (буру) Na2B4O7, карбонат натрия (соду) Na2CO3, а для растворов щелочей – щавелевую кислоту H2C2O4 . 2H2O, янтарную кислоту. Для приготовления рабочих растворов пользуются также фиксаналами. Это позволяет сразу получить титрованный раствор. Но следует помнить, при долгом хранении фиксаналов возможно взаимодействие щелочей со стеклом ампулы. Кроме этого, при хранении растворов щелочей, они поглощают углекислый газ из воздуха. Растворы кислот, напротив, устойчивы при хранении. Кислотно-основные индикаторыВ качестве индикаторов в методе нейтрализации применяются вещества, изменяющие окраску при смене кислотности среды. Наиболее распространенными среди них являются метиловый оранжевый и фенолфталеин. Кислотно-основные индикаторы представляют собой органические вещества, существующие в виде таутомерных форм, находящихся в равновесии друг с другом и имеющим разную окраску. Изменение окраски индикатора происходит в результате обратимой внутримолекулярной перегруппировки – таутомерного превращения, происходящего под действием кислотности среды. Окраска кислотно-основного индикатора обусловлена таутомерной формой, преобладающей в растворе при данном значении рН. Например, для индикатора метилового оранжевого: CH3 H+  3       N N N SO - N N N SO - CH3 |
