пп. Федеральное государственное бюджетное образовательное учреждение высшего образования Саратовский государственный аграрный университет имени Н. И. Вавилова
 Скачать 170.96 Kb. Скачать 170.96 Kb.
|
желтыйOH-    CH3 CH3 CH3 CH33  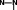   H HкрасныйSO - Глаз человека имеет ограниченную способность к восприятию окраски и перестает замечать присутствие одной из окрашенных форм в присутствие с другой, если ее концентрация примерно в 10 раз меньше. Поэтому окраска индикатора изменяется не при определенном значении рН, а в пределах интервала значений рН. Интервал рН, в пределах которого индикатор меняет свою окраску, называется интервалом перехода индикатора. Для метилового оранжевого его значение 3,1-4,4. При рН 3,1 и меньше глаз человека видит красную окраску, при значении 4,4 и выше – желтую. Индикатор фенолфталеин имеет интервал перехода 8,0-10,0. При этом окраска меняется из бесцветной в малиновую. Метиловый красный меняет окраску из красной в желтую в интервале рН 4,2-6,2. Бромтимоловый синий – в интервале 6,0-7,6 (желтая – синяя). Кривая титрованияГрафическая зависимость, выражающая изменение рН титруемого раствора при изменении объема прибавленного титранта, называется кривойтитрования.Эту кривую можно рассчитать теоретически, используя формулы расчета рН или построить экспериментально, измеряя рН в ходе титрования. Построим кривую титрования сильной кислоты раствором сильного основания. Пусть титруется 10 мл 0,1 н раствора HCl 0,1 н раствором NaOH: HCl + NaOH = NaCl + H2O. От начала титрования и до точки эквивалентности рН определяется концентрацией в растворе сильной кислоты – HCl. В точке эквивалентности в растворе присутствуют соль NaCl и вода, рН раствора нейтральный. После точки эквивалентности, когда вся кислота оттитрована, рН определяется концентрацией добавленной щелочи NaOH. Результаты вычислений представлены в таблице 3 (для упрощения расчетов разбавление растворов при титровании не учитывается). Таблица 6 – Расчет рН при титровании 0,1 н раствора HCl 0,1 н раствором NaOH
Продолжение таблицы 6
Вид полученной кривой титрования представлен на рисунке 5. 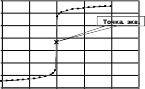 рН 14 рН 1412 10 8 6 4 2 0 0 5 10 15 20 25 V,мл Рисунок 5. Кривая титрования 0,1 н HCl (10 мл) 0,1 н раствором NaOH Сначала рН изменяется медленно: когда оттитрована половина содержащейся в растворе кислоты, изменение рН произошло только на 0,3 единицы по сравнению с первоначальным. Когда оттитровано 90%, изменение рН составляет лишь единицу. Заметное изменение рН наблюдается после того, как оттитровано более 99% кислоты. Такое же изменение рН наблюдается при введении 0,1% избытка щелочи. Резкое изменение рН в области точки эквивалентности называется скачоктитрования.Точка на кривой, соответствующая объему титранта 10 мл, когда кислота полностью оттитрована щелочью – точка эквивалентности (в данном случае при рН 7). Выбор индикатораПостроение кривой титрования позволяет решить проблему выбора индикатора. У неправильно выбранного индикатора изменение окраски может происходить до наступления точки эквивалентности или после нее. Правильно выбранный индикатор изменяет окраску в области скачка титрования. Графический способ выбора индикатора представлен на рисунке 6. На кривую титрования наносят интервал перехода индикатора. Для данного титрования применим тот индикатор, интервал перехода которого лежит в пределах скачка титрования. 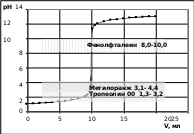 Рисунок 6. Выбор индикатора по кривой титрования Среди индикаторов, представленных на рис. 6, для титрования можно использовать фенолфталеин и метиловый оранжевый. Это несмотря на то, что интервалы их перехода не совпадают с точкой эквивалентности при рН 7. Так при титровании с метиловым оранжевым рН 4 достигается в тот момент, когда оттитровано 9,99 мл раствора кислоты, поэтому индикаторная ошибка титрования будет незначительная. Индикатор тропеолин 00 не подходит для данного титрования, интервал его перехода находится за пределами скачка титрования. Применение метода нейтрализацииМетод применим для определения кислот, щелочей, а также солей, имеющих кислую или щелочную реакцию среды вследствие гидролиза, например солей аммония, карбонатов. Примерами титрования по методу нейтрализации могут служить: определение временной жесткости воды, определение кислотности пищевых продуктов (молока, кефира, творога, хлеба), кислотности фруктов, кислотности и щелочности почвы. Вопросы для самоконтроляСущность кислотно-основного титрования, область применения. Рабочие растворы метода нейтрализации, их приготовлении, установление концентрации. Кислотно-основные индикаторы, механизм смены окраски. Интервал перехода индикатора. Кривые титрования. Выбор индикатора по кривой титрования. Задача: Некоторое количество образца калийной щелочи растворили в мерной колбе емкостью 500 мл. На титрование 20 мл полученного раствора расходуется 21,8 мл 0,2078 мл раствора HCl. Сколько г КОН содержал образец? Задача:Сколько % HNO3 содержит концентрированная азотная кислота, если после растворения 9,7770 г ее в мерной колбе на 1 л на титрование 25 мл 0,1040 н раствора NaOH израсходовано 25,4 мл полученного раствора HNO3? СПИСОК ЛИТЕРАТУРЫ Основная Сергеева И.В. Практикум по аналитической химии: учебное пособие/ И.В.Сергеева, Н.Н.Гусакова . т.в. Холкина, Т.Н. Сердюкова/ ФГБОУ ВПО «Саратовский ГАУ».- Саратов: Буква, 2015.-176 с. Основы аналитической химии: в 2-х кн. Т.1. Общие вопросы. Методы разделения: учебник / ред.: Ю.А. Золотов. – М.: Академия, 2010. – 384 с. Основы аналитической химии. В 2-х кн. Кн.2. Методы химического анализа: учебник / ред.: Ю.А. Золотов. – М.: Академия, 2010. – 408 с. Дополнительная Васильев, В. П. Аналитическая химия. Лабораторный практикум: пособие для вузов / В.П. Васильев, Р.П. Морозова, Л.А. Кочергина. – М.: Дрофа, 2004. – 416 с. Отто, М. Современные методы аналитической химии / М. Отто. – М.: Техносфера, 2006. – 416 с.  Практикум по аналитической химии: учебное пособие для студентов агрономических специальностей / ред. Г.Е. Рязанова. – Саратов: Изд-во СГАУ, 2003. – 163 с. Практикум по аналитической химии: учебное пособие для студентов агрономических специальностей / ред. Г.Е. Рязанова. – Саратов: Изд-во СГАУ, 2003. – 163 с.Харитонов, Ю. Я. Аналитическая химия (аналитика). В 2-х кн. Кн. 1. Общие теоретические основы. Качественный анализ / Ю.Я. Харитонов. – М.: Высшая школа, 2010. – 616 с. Харитонов, Ю. Я. Аналитическая химия (аналитика). В 2-х кн. Кн. 2. Количественный анализ. Физико-химические (инструментальные) методы анализа / Ю.Я. Харитонов. – М.: Высшая школа, 2010. – 560 с. Лекция 7ПЕРМАНГАНАТОМЕТРИЯ Окислительные свойства перманганата калияПерманганатометрия– метод титриметрического анализа, основанный на применении реакции окисления веществ раствором перманганата калия KMnO4. Перманганат калия проявляет окислительные свойства в кислой, щелочной и нейтральной средах. В кислой среде Mn+7, входящий в состав перманганат-иона MnO4-, восстанавливается до Mn+2. Например, если в качестве восстановителя выступает FeSO4, то окисление протекает по уравнению: 2KMnO4 + 10FeSO4 + 8H2SO4 = 2MnSO4 + 5Fe2(SO4)3 + K2SO4 + 8H2O. В результате реакции наблюдается обесцвечивание малиновой окраски перманганата. При этом перманганат-ион принимает 5 электронов: Mn+7 + 5e = Mn+2 . Молярная масса эквивалента KMnO4 в этом случае равна: Mэкв.(KMnO4) = M(KMnO4 ) = 158,03 = 31,61. 5 5 В нейтральной среде Mn+7восстанавливается до Mn+4, входящего в состав бурого осадка оксида MnO2, например: 2KMnO4 + 3Na2SO3 + H2O = 2MnO2 + 3Na2SO4 + 2KOH. Марганец (+7) принимает 3 электрона: Mn+7 + 3e = Mn+4. Молярная масса эквивалента KMnO4 в этом случае равна: Mэкв.(KMnO4) = M(KMnO4 ) = 158,03 = 52,68. 3 3 В щелочной среде происходит восстановление перманганат-иона MnO4- до манганат-иона MnO4-2, окрашенного в зеленый цвет: 2KMnO4 + NaNO2 + 2KOH = 2K2MnO4 + NaNO3 + H2O. В реакции восстановления участвует 1 электрон: Mn+7 + e = Mn+6. Молярная масса эквивалента KMnO4 в этом случае равна: Mэкв.(KMnO4) = M(KMnO4 ) = 158,03. 1 В пермаганатометрическом титровании преимущественно используется реакция окисления раствором KMnO4 в кислой среде, которая создается раствором серной кислоты. KMnO4 как рабочий раствор и индикатор методаРаствор KMnO4 нельзя приготовить по точной навеске. После приготовления раствора в нем начинают протекать реакции окисления примесей, вследствие чего в первое время его концентрация несколько меняется. Поэтому точную концентрацию раствора устанавливают не ранее чем через 7-10 дней после приготовления. В это время его рекомендуется выдерживать в темноте (в шкафу), т.к. свет способствует разложению KMnO4. По этой же причине хранят раствор перманганата в склянках из темного стекла. Стандартизацию раствора KMnO4 проводят по щавелевой кислоте. Реакция протекает по уравнению: 2KMnO4 + 5H2C2O4 + 3H2SO4 = 2MnSO4 + 10CO2 + K2SO4 + 8H2O. Раствор KMnO4 всегда помещается в бюретку, т.е. он всегда является титрантом. Особенностью перманганатометрии является то, что метод не требует применения специального индикатора. Его роль выполняет раствор KMnO4, который в ходе титрования меняет окраску. При титровании раствором KMnO4 происходит обесцвечивание капель титранта. После достижения точки эквивалентности лишняя капля перманганата окрашивает раствор в бледно-розовый цвет. Это является сигналом конца титрования. Определение восстановителей и окислителейЯвляясь вариантом редоксиметрии, перманганатометрия находит применение для определения восстановителей и окислителей. Восстановители определяются прямым титрованием раствором KMnO4 в сернокислой среде. Так, например, проводится определение железа (II), оксалатов, нитритов, пероксида водорода. Окислители определяются методом обратного титрования. В этом случае к раствору окислителя прибавляют избыточное количество раствора восстановителя, вступающего с ним в реакцию. Оставшийся после реакции избыток восстановителя титруют раствором перманганата. Например, при анализе минерала пиролюзита (содержит MnO2) пробу растворяю в сернокислом растворе щавелевой кислоты, избыток которой оттитровывают перманганатом калия. Аналогично анализируют диоксид свинца, сурик и другие окислители. Вопросы для самоконтроляПерманганатометрия, сущность метода, применение. Как вычисляется молярная масса эквивалента для веществ-участников окислительно- восстановительных реакций? Определите молярные массы эквивалента окислителя и восстановителя в реакции: KMnO4 + Na2SO3 + H2SO4 = MnSO4 + Na2SO4 + K2SO4 + H2O. Условия приготовления рабочего раствора KMnO4. Стандартизация рабочего раствора KMnO4. Почему перманганатометрию относят к безиндикаторным методам титриметрического анализа? Задача:Определите нормальность и титр раствора KMnO4, если на титрование 10 мл 0,02н раствора щавелевой кислоты израсходовалось 13,2 мл раствора перманганата. СПИСОК ЛИТЕРАТУРЫ Основная Сергеева И.В. Практикум по аналитической химии: учебное пособие/ И.В.Сергеева, Н.Н.Гусакова . т.в. Холкина, Т.Н. Сердюкова/ ФГБОУ ВПО «Саратовский ГАУ».- Саратов: Буква, 2015.-176 с. Основы аналитической химии: в 2-х кн. Т.1. Общие вопросы. Методы разделения: учебник / ред.: Ю.А. Золотов. – М.: Академия, 2010. – 384 с. Основы аналитической химии. В 2-х кн. Кн.2. Методы химического анализа: учебник / ред.: Ю.А. Золотов. – М.: Академия, 2010. – 408 с. Дополнительная Васильев, В. П. Аналитическая химия. Лабораторный практикум: пособие для вузов / В.П. Васильев, Р.П. Морозова, Л.А. Кочергина. – М.: Дрофа, 2004. – 416 с. Отто, М. Современные методы аналитической химии / М. Отто. – М.: Техносфера, 2006. – 416 с.  Практикум по аналитической химии: учебное пособие для студентов агрономических специальностей / ред. Г.Е. Рязанова. – Саратов: Изд-во СГАУ, 2003. – 163 с. Практикум по аналитической химии: учебное пособие для студентов агрономических специальностей / ред. Г.Е. Рязанова. – Саратов: Изд-во СГАУ, 2003. – 163 с.Харитонов, Ю. Я. Аналитическая химия (аналитика). В 2-х кн. Кн. 1. Общие теоретические основы. Качественный анализ / Ю.Я. Харитонов. – М.: Высшая школа, 2010. – 616 с. Харитонов, Ю. Я. Аналитическая химия (аналитика). В 2-х кн. Кн. 2. Количественный анализ. Физико-химические (инструментальные) методы анализа / Ю.Я. Харитонов. – М.: Высшая школа, 2010. – 560 с. Лекция 8КОМПЛЕКСОНОМЕРИЯ Понятие о комплексонахКомплексонометрия – метод титриметрического анализа, в основе которого лежит реакция образования внутрикомплексных соединений с органическими веществами, называемыми комплексонами. Среди этих веществ в титровании наибольшее распространение получил так называемый комплексон III – двунатриевая соль этилендиаминтетрауксусной кислоты (кратко ЭДТА), известный также под торговым названием трилон Б. Формула этого соединения: HOOС–СН2 СН2–СOONa   N–СН2–СН2–N NaOOС–СН2 N–СН2–СН2–N NaOOС–СН2СН2–СOOH ЭДТА образует прочные растворимые внутрикомплексные соединения со многими катионами металлов. При этом металл замещает атомы водорода карбоксильных групп, а также связывается с атомами азота посредством координационной связи: |
