Лабораторные фх. Лабник по ф и к химии. Физическая и коллоидная химия сборник лабораторных работ СанктПетербург 2008 удк 541 076 (075. 83) Физическая и коллоидная химия. Сборник лабораторных работ
 Скачать 4.14 Mb. Скачать 4.14 Mb.
|
Фазовые равновесия в двухкомпонентных системахКраткие теоретические сведенияСвойства двухкомпонентных систем определяются тремя независимыми переменными: давлением Р, температурой Т (внешние переменные), а также составом системы при условии его выражения в долях или процентах (по массе или мольных). Двухкомпонентные системы условно разделяют на две категории: неконденсированные систем (газ − жидкость) и конденсированные (жидкость – кристаллы твердых фаз). Основное уравнение, описывающее гетерогенные фазовые равновесия – уравнение правила фаз Гиббса записывается в следующем виде: S = K – F + 2, где S – число степеней свободы системы, т.е. число параметров состояния, которые можно изменять в определенных пределах без изменения фазового состава системы; K – число компонентов системы, т.е. минимальное число составных частей системы, необходимое для ее полного описания; F – количество фаз системы, т.е. число ее гомогенных частей, разделенных между собой поверхностями раздела. Процессы, протекающие в двухкомпонентных системах, взаимное влияние температуры и состава на фазовые равновесия и др. принято отображать в виде диаграмм состояния. В большинстве случаев они строятся по экспериментальным данным, например, по кривым охлаждения. Наиболее распространены диаграммы состояния, характеризующие зависимость между исходным составом систем и температурой фазовых превращений, протекающих в этих системах. Изучение подобных диаграмм позволяет легко определить взаимную растворимость компонентов системы в различных агрегатных состояниях, наличие у них полиморфных превращений, состав и свойства химических соединений, образованных компонентами, температуру и давление всех фазовых превращений в системах заданного состава, изменение состава и относительного количества находящихся в равновесии фаз при изменении температуры или давления, выбрать состав наиболее легкоплавкой или тугоплавкой системы и т.д. Одним из простейших частных случаев диаграмм состояния является изображение системы с полной растворимостью компонентов в обеих равновесных фазах. Следует отметить, что внешний вид и общие принципы чтения таких диаграмм состояния одинаковы как для конденсированных, так и для неконденсированных систем. В данном случае можно выделить три основных вида диаграмм состояния (рис. _____). При анализе таких диаграмм на них надо, прежде всего, выделить гомогенные области, т.е. зоны существования непрерывных фаз: твердых, жидких или газообразных растворов. Выше верхней линии (для равновесий «твердое тело – жидкость» она называется линией ликвидуса), выражающей зависимость состава высокотемпературной фазы от температуры равновесия, расположена более высокотемпературная фаза. Для равновесий «жидкость – пар» – это пар, а для равновесий «твердое тело – жидкость» – жидкость. Ниже нижней линии (для равновесий «твердое тело – жидкость» она называется линией солидуса), выражающей зависимость состава низкотемпературной фазы от температуры равновесия, расположена более низкотемпературная фаза. Для равновесий «жидкость – пар» – это жидкость, а для равновесий «твердое тело – жидкость» – твердое тело. 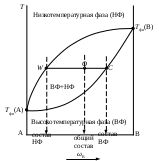 Рис. ____. Изобарическая диаграмма состояния двухкомпонентной системы с неограниченной растворимостью веществ. На рис. _______ показаны экстремальные точки М, в которых смеси кипят (или плавятся) как индивидуальное вещество, т.е. при кипении или плавлении состав системы остается постоянным. Для неконденсированных систем такой состав называется азеотропным. Азеотропную смесь невозможно разделить на индивидуальные компоненты методом простой перегонки. Смеси, составы которых находятся слева от точки М, могут быть в принципе разделены на компонент А и азеотропную смесь. Если состав исходной смеси находится левее точки М, то такую смесь можно разделить на компонент В и азеотропную смесь. Сказанное справедливо и для конденсированных систем. Полностью компоненты А и В методом дробной кристаллизации разделить также не возможно. 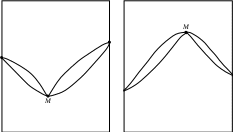 Рис. ____. Изобарическая диаграмма состояния двухкомпонентной системы с неограниченной растворимостью веществ с экстремальными точками При перегонке бинарной смеси парциальные давления компонентов рА и рВ обоих компонентов в паровой фазе определяются законом Рауля (в приближении, что пары подчиняются законам идеальных газов) где Поскольку в бинарной системе хВ = 1 – хА, отношение парциальных давлений в паровой фазе определяется уравнением 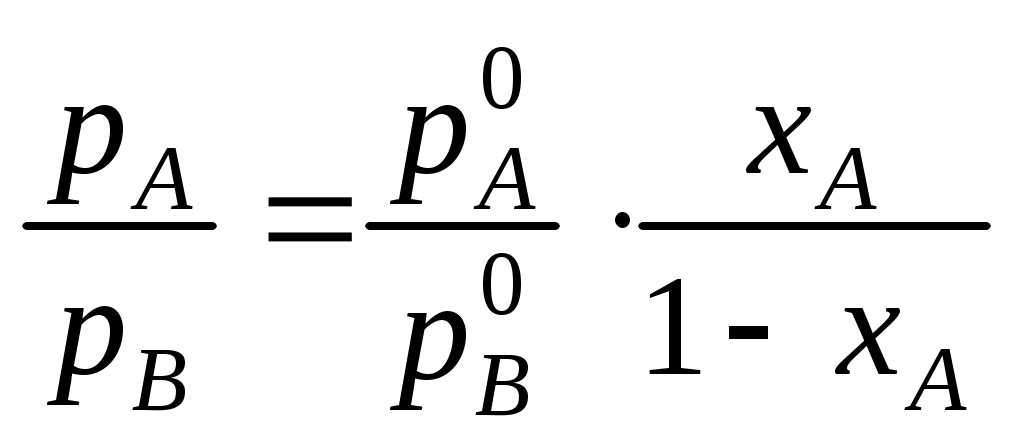 . .Парциальное давление компонента в газовой фазе pi кроме того связано с общим давлением пара РΣ через мольные доли обоих компонентов в паровой фазе уi: Тогда 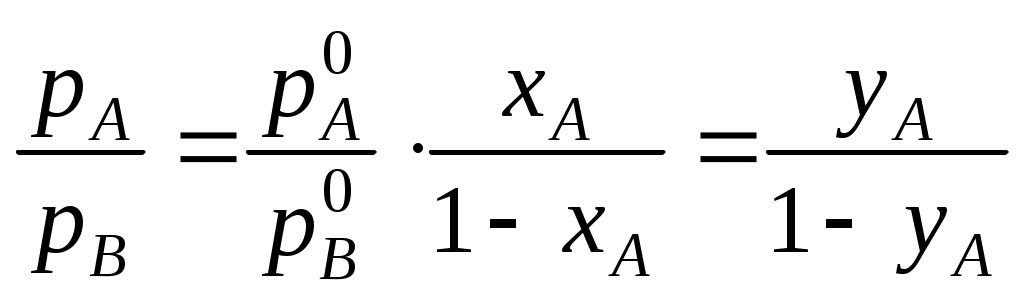 . .Если компонент А более летуч, чем компонент В, то индекс при обозначении мольной доли его в жидкой и газовой фазе можно опустить: где Последнее уравнение представляет зависимость между относительными концентрациями легкокипящего компонента в парах и в жидкости. Пар и жидкость различны по составу только тогда, когда α > 1. И лишь в этом случае возможно разделение компонентов при перегонке. Обогащение паров легко летучим компонентом чем больше, чем больше α, т.е. чем больше различаются давления насыщенных паров чистых компонентов. Если разделяемые соединения отличаются по своей летучести незначительно, то их невозможно удовлетворительно разделить методом простой перегонки. В таких случаях процесс испарения и конденсации следует повторять многократно, т.е. применять методы ректификации или фракционированной перегонки. При выборе метода разделения можно руководствоваться следующим эмпирическим правилом: ректификационная перегонка должна применяться в тех случаях, когда температура кипения разделяемых соединений отличаются менее чем на 80°С. Контрольные вопросы1. Какими независимыми переменными определяются свойства двухкомпонентных систем? 2. Какие системы называют неконденсированными? 3. Какое основное уравнение описывает гетерогенные фазовые равновесия? 4. Какие показатели двухкомпонентной системы можно определить на основании изучения диаграмм состояния? 5. Что показывают линии ликвидуса и солидуса? 6. Возможно ли разделение компонентов азеотропной смеси методом простой перегонки? 7. Как при помощи диаграммы состояния определить состав равновесных фаз? 8. Для чего применяется правило рычага при расшифровке диаграмм состояния? 9. Какие особенные свойства имеет точка эвтектики? 10. Какие самые распространенные способы построения диаграмм состояния? 11. В чем суть аналитического метода? 12. Каковы основные принципы метода построения диаграммы состояния конденсированной системы на основании изучения кривых охлаждения? 13. Каким законом определяются парциальные давления компонентов при перегонке бинарной смеси? 14. Каким уравнением связано парциальное давление компонента в паровой фазе с общим давлением пара? 15. Каким уравнением определяется отношение парциальных давлений компонентов в паровой фазе? 16. Каким компонентом обогащена паровая фаза при перегонке? |
