Лабораторные фх. Лабник по ф и к химии. Физическая и коллоидная химия сборник лабораторных работ СанктПетербург 2008 удк 541 076 (075. 83) Физическая и коллоидная химия. Сборник лабораторных работ
 Скачать 4.14 Mb. Скачать 4.14 Mb.
|
Лабораторная работа № 7. Получение диаграммы состояния двухкомпонентной неконденсированной системыЦель работы: построить диаграммы состояния «жидкость-пар» для двухкомпонентной системы, состоящей из двух легко кипящих жидкостей. Сущность метода. Для построения диаграммы состояния в данном случае используется аналитический метод. В ходе эксперимента следует измерить температуры кипения смесей различного состава бинарной системы при атмосферном давлении, определить равновесные концентрации пара и жидкости для каждой смеси рефрактометрическим методом и построить диаграммы состояния системы в координатах температура — состав и состав пара — состав жидкости. Для работы используются системы, в которых оба компонента значительно отличаются по температуре кипения (при наличии азеотропных смесей это не столь существенно) и по показателю преломления. Например: бензол – ацетон; бензол – хлороформ; дихлорэтан – толуол; четыреххлористый углерод – ацетон; ацетон – хлороформ; пропиловый спирт – четыреххлористый углерод; этиловый спирт – вода; четыреххлористый углерод – этиловый спирт; этиловый спирт – бензол. Ниже приведены характеристики перечисленных веществ.
Оборудование и реактивы. Рефрактометр; штатив с лапками и кольцом; штатив для пробирок; спиртовка; круглодонная двугорлая колба объемом 100 мл (или круглодонная колба объемом 100 мл с двурогим форштоссом); холодильник Либиха длиной 30 см; алонж; мерный цилиндр объемом 50 мл – 2 шт., плоскодонные колбы с притертой пробкой объемом 50 мл – 4 шт.; пробирки с пробками – 8 шт. Выполнение работы1. Получить у преподавателя состав изучаемой системы. 2. Определить компоненты «А» и «В». За компонент «А» обычно принимают более летучее вещество. 3. В четырех сухих колбах с притертыми пробками объемом 50 мл приготовить растворы выбранных компонентов общим объемом 40 мл с содержанием вещества «В»: 10, 20, 30, 40, 50, 60, 70, 80 и 90 % (об.).
4. При помощи рефрактометра измерить показатели преломления всех приготовленных растворов. Данные измерений занести в таблицу экспериментальных данных. По ниже описанной схеме определить температуры кипения всех приготовленных проб. 5. Раствор перелить в перегонную колбу. 6. Бросить в раствор «кипелки» – мелкие кусочки кирпича или неглазурованного фарфора. 7. Собрать установку, изображенную на рис. 6. Внимание! Термометр должен быть расположен на 1 см ниже горла с холодильником! 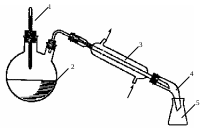 Рис. 6. Схема перегонной установки. 1 – термометр; 2 – перегонная колба; 3 – холодильник Либиха; 4 – алонж; 5 – приемник. Стрелками показано направление течения охлаждающей воды. 8 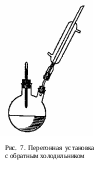 . Привести холодильник в вертикальную позицию (рис. 7). Получается установка с обратным холодильником, что предотвращает потери компонентов системы до установления процесса кипения 9. Пустить воду в холодильник. 10. Нагреть жидкость в колбе на колбонагревателе до установления постоянной температуры кипения. 11. Полученное значение температуры записать в таблицу экспериментальных данных. 12. Привести холодильник в прямую позицию и отогнать некоторое количество дистиллята в приемник – пробирку. При получении дистиллята следует внимательно следить за температурой перегонки – она не должна изменяться более, чем на 1°С! Как только температура кипения начнет повышаться приемник следует немедленно убрать. 13. Убрать от установки нагревательный элемент. 14. Пробирку с дистиллятом подписать. Подпись удобно сделать на полоске бумаги, которую можно закрепить между пробкой и горлом пробирки. 15. После того, как перегонная колба остынет, отобрать пробу оставшегося в колбе раствора (кубового остатка) в пробирку. Пробирку подписать. 16. При помощи рефрактометра определить показатель преломления для всех проб дистиллята и кубового остатка. Результаты занести в таблицу экспериментальных данных. Содержание протокола лабораторной работыКомпонент «А»: наименование, химическая формула, плотность, показатель преломления, температура кипения. Компонент «В»: наименование, химическая формула, плотность, показатель преломления, температура кипения. Таблица экспериментальных данных
Обработка экспериментальных данных1. По результатам измерения показателя преломления исходных растворов, построить градуировочный график в координатах показатель преломления – объемная доля φ компонента «В». 2. По градуировочному графику определить состав дистиллята и кубового остатка для каждой пробы. Состав дистиллята соответствует содержанию компонента «В» в равновесной паровой фазе, Содержание компонента «В» в кубовом остатке соответствует составу равновесной жидкой фазы. 3. Вычислить массовую ω и мольную х долю компонента «В» в равновесных паре и жидкости. Объемная доля вещества в растворе определяется формулой: где Vi – объем компонента в растворе, VΣ – объем раствора. Массовая доля компонента в растворе определяется уравнением: где mi – масса компонента в растворе, mΣ – масса раствора; для бинарной системы mΣ = mA + mB. Масса вещества связана с его объемом соотношением: m = dV, где d – плотность вещества, г/см3. Мольная доля вычисляется по формуле: где ni – количество вещества компонента в растворе, моль; Σni – суммарное количество вещества по всем компонентам раствора; для бинарной системы Σni = nA + nB. Количество вещества и его масса связаны соотношением: mi = niMi, где Мi – молярная масса компонента, г/моль. 4. Заполнить таблицу:
5. Построить диаграммы состояния изучаемой системы в координатах «температура кипения – состав» и «состав пара – состав жидкости», на которых указывают давление, при котором проводился опыт. Полученную диаграмму кипения анализируют, пользуясь правилом фаз Гиббса. Содержание отчета по лабораторной работе1. Название работы. 2. Цель работы. 3. Ход эксперимента. 4. Экспериментальные данные (см. протокол к лабораторной работе). 5. Обработка экспериментальных данных. 6. Вывод. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
