Лабораторные фх. Лабник по ф и к химии. Физическая и коллоидная химия сборник лабораторных работ СанктПетербург 2008 удк 541 076 (075. 83) Физическая и коллоидная химия. Сборник лабораторных работ
 Скачать 4.14 Mb. Скачать 4.14 Mb.
|
Лабораторная работа № 9. Экстракция цветных металлов нафтеновой кислотойЦель работы: определить зависимость коэффициента распределения сульфата металла между водным раствором и карбоновой кислотой в зависимости от рН водной фазы. Сущность работы: по экспериментальной зависимости коэффициента распределения катиона металла между органической и водной фазами от рН определить значение сольватного числа и константу равновесия процесса экстракции. Оборудование и реактивы. Экстрактор; рН-метр; штатив с кольцами – 1 шт.; стакан химический объемом 200 мл; делительная воронка объемом 250 мл – 4 шт.; воронка – 4 шт.; химические стаканы объемом 50 мл – 8 шт. (для отбора проб – 4 шт., для отбора раствора соли металла – 1 шт., для нафтеновой кислоты – 1 шт., для трилона Б – 1 шт., для хлорида аммония – 1 шт.); мерные цилиндры для экстрагента и раствора соли металла объемом 50 мл – 2 шт.; мерный цилиндр для дозирования хлорида аммония объемом 10 мл – 1 шт.; градуированная пипетка или бюретка объемом 5 мл для дозирования щелочи – 1 шт.; пипетка Мора объемом 10 мл для отбора проб соли металла на титрование – 1 шт.; колбы конические для титрования объемом 250 мл – 2 шт.; бюретка для титрования объемом 25 мл – 1 шт.; гидроксид натрия – 1 н. раствор; Трилон Б – 0,05 М раствор; мурексид; хлорид аммония – 1 М раствор; гидроксид аммония – разбавленный 1:1; растворы сульфатов меди, никеля, кобальта – 0,05 М. Выполнение работы1. Настроить блок управления мешалки: = нажать кнопку «сеть», = нажать кнопку «установка» для входа в режим настройки блока управления = кнопками «выбор» и ▲▼ установить число оборотов (1200) и продолжительность перемешивания (5-10 минут) = нажать кнопку «установка» для выхода из режима настройки. 2. В стакан для перемешивания внести 30 мл раствора сульфата металла и 15 мл нафтеновой кислоты. 3. Погрузить мешалку в стакан, нажать кнопку «пуск» (должно происходить интенсивное перемешивание содержимого стакана). 4. Добавить по каплям при перемешивании!!! 1 мл раствора гидроксида натрия. 5. После того, как вся щелочь добавлена продолжать перемешивание еще 5 мин. Остановить мешалку (кнопкой «стоп» или она остановится автоматически). 6. Перелить смесь в делительную воронку для расслаивания фаз. 7. Повторить п.п. 2 – 6 изменяя количество добавляемой щелочи: 1,5 мл, 2 мл, 2,5 мл. 8. После того, как органическая фаза отделилась, водную фазу (внизу) через бумажный фильтр слить в химический стаканчик. Органическую фазу вылить в емкость для органических отходов!!! 9. Измерить рН водной фазы на рН-метре для каждой пробы: = вынуть электрод рН-метра из стаканчика с дистиллированной водой, протереть кусочком фильтра, = погрузить электрод в исследуемый раствор, следя за тем, чтобы отводка электрода была покрыта жидкостью, = считать значение рН на табло рН-метра, = вынуть электрод, протереть кусочком фильтра, сполоснуть дистиллированной водой, вытереть насухо и погрузить в следующий раствор и.т.д. 10. Проанализировать содержание металла в водном растворе (исходный раствор и растворы после экстракции). Анализ содержания меди (2+) Отобрать мерной пипеткой в 2 конические колбы аликвоты объемом 10 мл. Приливать по каплям при перемешивании аммиак до получения ярко-синего раствора аммиаката меди. Добавить немного сухого индикатора «мурексид». Титровать раствором трилона Б до перехода окраски индикатора в эквивалентной точке от желто-красной к фиолетовой. Анализ содержания кобальта и никеля Отобрать мерной пипеткой в две конические колбы аликвоты объемом 10 мл. Прилить в каждую колбу по 10 мл хлорида аммония (с помощью мерного цилиндра) и дистиллированную воду до объема 40-50 мл. Добавить немного сухого индикатора «мурексид». Титровать раствором трилона Б до переход окраски индикатора в эквивалентной точке от желтой к фиолетовой. Примечание: желтую окраску раствора в ходе титрования поддерживают добавлением NH4OH, т.е., если в ходе титрования раствор краснеет, то следует добавить несколько капель аммиака и он снова станет желтым. 10. Результаты эксперимента (рН и результаты титрования) занести в таблицу. Содержание протокола лабораторной работыНазвание экстрагента: Концентрация экстрагента: Растворитель: Название соли металла: Химическая формула соли металла: Концентрация раствора щелочи (NaOH) СNaOH = _________ Концентрация раствора трилона Б СТ = ___________ Объем аликвоты, взятый для анализа Vа = _______мл. Таблица экспериментальных данных
Обработка результатов эксперимента1. Рассчитать исходную и равновесные концентрации металла (2+) по уравнению: где VT и СТ – объем, мл и концентрация, моль/л трилона Б, Va – объем аликвоты, мл. 2. Вычислить концентрацию металла (2+) в органической фазе по уравнению: где 3. Рассчитать коэффициент распределения 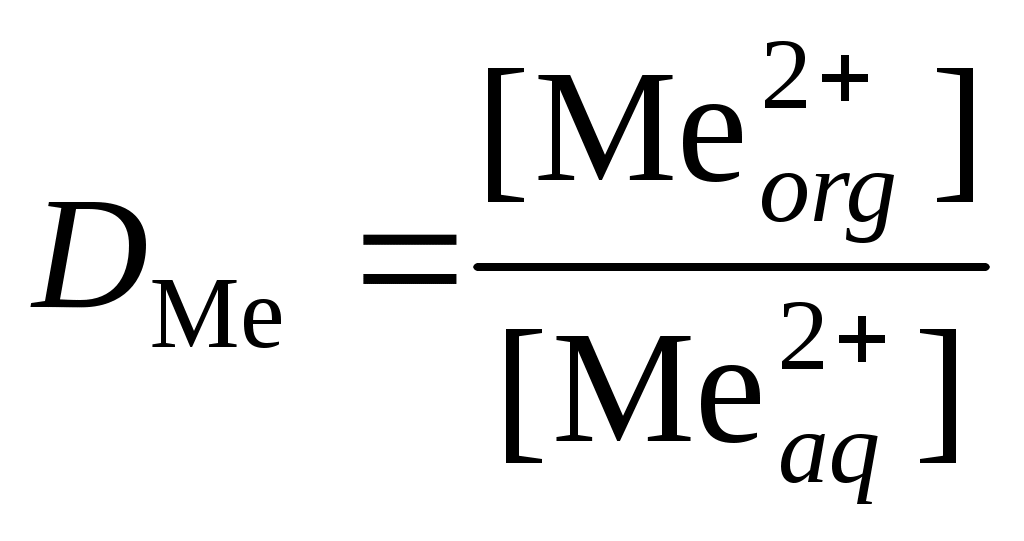 . .4. Заполнить таблицу:
5. Построить график зависимости lgDMe = f(pH). 6. По графику определить коэффициенты K (константу равновесия) и z уравнения зависимости логарифма коэффициента распределения от рН: lgD = lgK + zpH 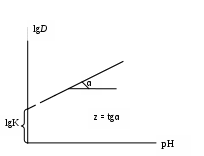 7. Сравнить полученную величину z с зарядом иона и сделать вывод о справедливости принятой модели. 8. Сравнить значения lgK для других металлов и сделать вывод о сравнительной экстрагируемости катионов металлов нафтеновыми кислотами. Содержание отчета по лабораторной работе1. Название работы. 2. Цель работы. 3. Ход эксперимента. 4. Экспериментальные данные (см. протокол к лабораторной работе). 5. Обработка экспериментальных данных. 6. Вывод. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
