Лабораторные фх. Лабник по ф и к химии. Физическая и коллоидная химия сборник лабораторных работ СанктПетербург 2008 удк 541 076 (075. 83) Физическая и коллоидная химия. Сборник лабораторных работ
 Скачать 4.14 Mb. Скачать 4.14 Mb.
|
Лабораторная работа № 10. Определение степени диссоциации слабого электролита кондуктометрическим способомЦель работы: определить степень и константу диссоциации слабой кислоты путем измерения электропроводности раствора. Сущность работы: электропроводность раствора электролита зависит от концентрации ионов в растворе и их подвижности. В растворах слабых электролитов концентрация ионов зависит от степени диссоциации. Получив зависимость электропроводности от концентрации электролита, вычисляют его степень диссоциации и константу диссоциации слабого электролита. Оборудование и реактивы. Кондуктометр или кондуктометр – иономер; магнитная мешалка; химический стакан объемом 100 мл – 5 шт.; химический стакан объемом 50 мл – 1 шт.; химический стакан объемом 250 мл – 1 шт.; мерные колбы объемом 250 мл – 4 шт.; мерная пипетка объемом 50 мл – 1 шт.; мерная пипетка объемом 10 мл – 1 шт.; бюретка для титрования объемом 25 мл – 1 шт.; гидроксид натрия – раствор (концентрация указана на емкости с реактивом); слабая кислота – СН3СООН или НСООН – раствор (примерное значение концентрации указано на емкости с реактивом). Выполнение работыI. Анализ концентрации раствора слабой кислоты методом кондуктометрического титрования. 1. Получить от преподавателя раствор слабой кислоты. 2. Отобрать аликвоту 10 мл в химический стакан объемом 250 мл. 3. В бюретку залить раствор гидроксида натрия и «занулить» бюретку. 4. Поставить пробу на магнитную мешалку и поместить в раствор якорь магнитной мешалки. 5. Погрузить в стакан с пробой электрод кондуктометра. 6. Долить в стакан для титрования дистиллированную воду до закрытия щели электрода раствором. 7. Включить магнитную мешалку. 8. Зафиксировать показания кондуктометра. 9. Приливать гидроксид натрия из бюретки порциями по 0,5 мл, фиксируя после каждой порции щелочи значение электропроводности раствора. 10. Титрование продолжать до получения изменения хода зависимости удельной электропроводности от объема щелочи. 11. Данные занести в таблицу 1. II. Получение зависимости удельной электропроводности от содержания слабого электролита в растворе 1. Приготовить серию из 4 последовательно разбавленных растворов слабого электролита: 1) мерной пипеткой объемом 50 мл отобрать исходный раствор, поместить его в мерную колбу № 1 на 250 мл, довести до метки дистиллированной водой; закрыть колбу пробкой и перемешать раствор, переворачивая колбе не менее 40 раз; 2) из колбы № 1 в колбу № 2 перенести при помощи мерной пипетки 50 мл раствора, довести объем в колбе № 2 дистиллированной водой до метки, закрыть колбу пробкой и перемешать раствор, переворачивая колбе не менее 40 раз; 3) повторить с колбами № 3 и № 4. 2. Пробы приготовленных растворов отобрать в маркированные химические стаканы объемом 100 мл. 3. Измерить удельную электропроводность приготовленных растворов слабой кислоты путем погружения электрода кондуктометра в стакан с раствором. Начинать измерения следует с самого разбавленного раствора. При погружении электрода в раствор необходимо следить за тем, чтобы щель электрода была полностью закрыта раствором. При переходе от одного раствора к другому электрод следует насухо протереть кусочком фильтровальной бумаги. 4. Результаты измерений занести в таблицу 2. Содержание протокола лабораторной работы1. Название слабого электролита. 2. Химическая формула слабого электролита. 2. Ориентировочное значение концентрации слабого электролита (указано на емкости с этим электролитом) С. 3. Концентрация раствора гидроксида натрия (титранта) СNaOH. Объем пробы слабого электролита, взятый для титрования Vа. Таблица 1. Данные для построения кривой кондуктометрического титрования
Таблица 2 Зависимость удельной электропроводности слабого электролита от его концентрации
Обработка экспериментальных данныхI. Определение точного значения концентрации слабого электролита 1. По данным таблицы 1 построить кривую кондуктометрического титрования, которая будет иметь вид, показанный на рис. 1 2. Обработать графически кривую титрования, как показано на рис. 2. 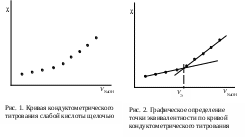 3. От места пересечения прямых опустить перпендикуляр с оси абсцисс и определить значение эквивалентного объема щелочи (см. рис. 2). 3. От места пересечения прямых опустить перпендикуляр с оси абсцисс и определить значение эквивалентного объема щелочи (см. рис. 2).4. Точное значение концентрации слабого электролита вычислить по формуле: где VЭ – эквивалентный объем щелочи, определенный по кривой титрования, мл; СNaOH – концентрация раствора щелочи, экв./л; Va – объем пробы слабого электролита, мл. II. Определение константы и степени диссоциации слабого электролита Далее в расчетах используется точное значение концентрации слабого электролита, определенное в п. I. 1. Вычислить эквивалентную электропроводность каждого раствора по формуле: 2. Заполнить таблицу:
3. По данным таблицы построить графики зависимостей = f(C) и 1/λ = f(λС). 4. По графику 1/λ = f(λС) найти 1/λ∞ посредством экстраполяции зависимости на ось ординат 1/λ и вычислить λ∞. 5. Рассчитать значение степени диссоциации по уравнению: 6. Вычислить значение константы диссоциации по уравнению: 7. Результаты вычислений занести в таблицу:
8. Среднее квадратичное отклонение σ рассчитывают по уравнению: 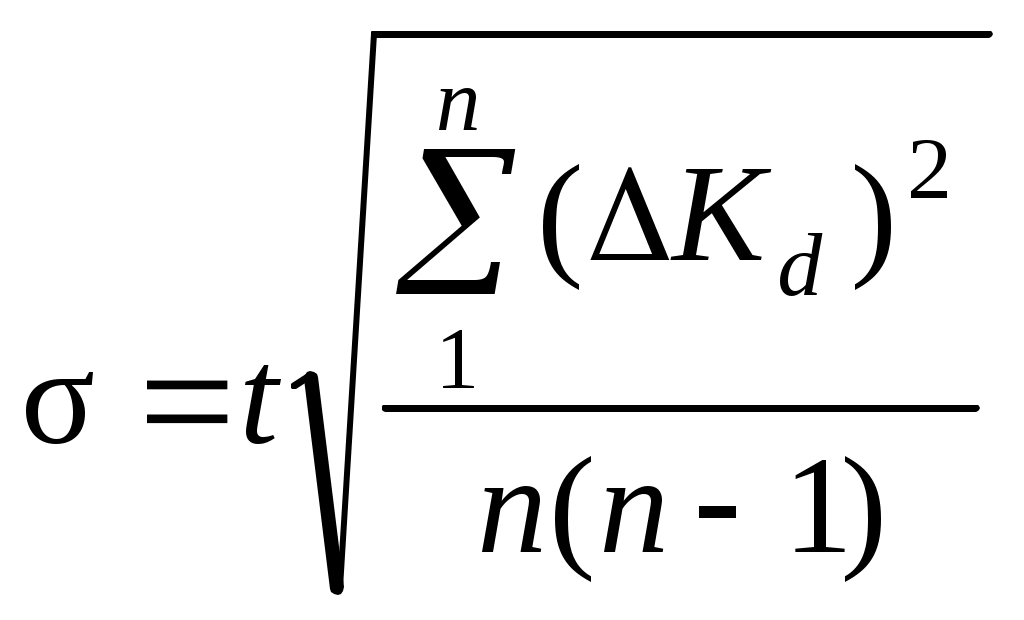 , , где t – коэффициент Стьюдента. Для доверительной вероятности 0,95t = 2,57. 9. Окончательный результат представляют в виде: Kd = Kd среднее ± σ. Содержание отчета по лабораторной работе1. Название работы. 2. Цель работы. 3. Ход эксперимента. 4. Экспериментальные данные (см. протокол к лабораторной работе). 5. Обработка экспериментальных данных. 6. Вывод. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
