Лабораторные фх. Лабник по ф и к химии. Физическая и коллоидная химия сборник лабораторных работ СанктПетербург 2008 удк 541 076 (075. 83) Физическая и коллоидная химия. Сборник лабораторных работ
 Скачать 4.14 Mb. Скачать 4.14 Mb.
|
Распределение вещества в двухфазной системе. ЭкстракцияКраткие теоретические сведенияС распределением вещества между двумя фазами встречаются во многих технологических процессах – растворения, выщелачивания, экстракции, сорбции и т.д. Экстракция – процесс переноса растворенного вещества из одной жидкой фазы в другую, при условии, что обе жидких фазы не смешиваются друг с другом. Обычно распределение (перенос) растворенного вещества осуществляется между водным и органическим растворами. Жидкостная экстракция используется для разделения компонентов гомогенных жидких систем. В случае системы с физическим распределением компонентов отсутствует химическое взаимодействие между распределяемым веществом и экстрагентом. Экстракция идет за счет различной растворимости компонентов в органической и водной фазах. В процессах физического распределения, как правило, участвуют простые вещества или соединения с малополярными ковалентными связями. Такие экстракционные системы чаще используют для разделения смеси органических веществ или выделения органических компонентов из водных растворов, грунтов и др. Экстракция за счет химического взаимодействия сопровождается образованием сложных комплексных соединений экстрагируемого вещества с органическим компонентом. Эффективность процесса определяется прочностью комплексов, образуемых компонентами. Данный метод в основном используется для извлечения и разделения ионов металлов. Здесь экстрагент – органический раствор экстракционного реагента, способного к образованию химических соединений с ионами или молекулами извлекаемого вещества, в органическом растворителе. Образующееся химическое соединение должно быть нерастворимо в воде и хорошо растворяться в выбранном органическом растворителе. Молекула экстракционного реагента должна иметь гетерополярное строение и состоять из неполярного углеводородного радикала и полярной функциональной группы. Углеводородный радикал обеспечивает малую растворимость в воде и высокую растворимость в разбавителе, а функциональная группа – образование химической связи с целевым компонентом. В качестве разбавителей обычно применяют ароматические или алифатические углеводороды, хлорпроизводные углеводородов, спирты, нитробензол и др. В зависимости от реакции, лежащей в основе процесса экстракции различают следующие основные типы химических экстракционных систем. Катионообменная экстракция экстракция металлов, находящихся в водных растворах в виде катионов (простых и комплексных) за счет обмена экстрагируемого катиона на протон или другой катион экстрагента. Экстрагенты – карбоновые кислоты или их соли Анионообменная экстракция – экстракция металлов, находящихся в водных растворах в виде анионов за счет обмена экстрагируемого аниона на анион экстрагента. Экстрагенты – органические основания и их соли. Экстракция с образованием хелатных комплексов или координационная экстракция. Экстрагируемое соединение образуется в результате комплексообразования между молекулами или ионами экстракционного агента и ионом экстрагируемого металла-комплексообразователя. Экстракция ионных ассоциатов – экстракция неорганических молекул из водного раствора нейтральными молекулами экстрагента за счет образования в экстракте ионных ассоциатов (солей), состоящих из органических катионов и неорганических анионов. Экстракция посредством сольватации катионов металла или водорода. Экстрагенты содержат полярный атом кислорода, связанный либо с углеродом, либо с фосфором. Вместо кислорода в этих соединениях может быть любой другой донорный атом. Для количественной характеристики полноты и селективности извлечения целевого компонента в процессе экстракции используют следующие показатели. 1. Коэффициент распределения, который подчиняется закону распределения Нернста: «каждое из растворенных веществ распределяется между жидкими несмешивающимися фазами со своим индивидуальным коэффициентом распределения». Коэффициент распределения представляет собой соотношение активностей вещества в органической и водной фазе: При небольших концентрациях растворов и отсутствии процессов диссоциации, ассоциации и других химических превращений активность вещества можно заменить на его концентрацию: Если D>1, то растворенный компонент будет концентрироваться в органической фазе. Для определения коэффициента распределения в широком диапазоне концентраций и предельной емкости экстрагента части используют изотерму экстракции, представляющую собой зависимость равновесной концентрации целевого компонента в экстракте (Сorg) от равновесной концентрации в рафинате (Сaq). 2. Степень извлечения. Представляет собой отношение количества вещества в органической фазе к его общему содержанию в системе. 3. Если при экстракции происходит химическая реакция растворенного вещества с экстрагентом, количественным показателем процесса экстракции, также является константа равновесия процесса экстракции. Для физико-химической характеристики процесса экстракции следует знать, какие параметры будут влиять на экстракционное равновесие и, как следствие, на величину коэффициента распределения. Например, при экстракции ионов металла Mez+ нафтеновой кислотой HR, не смешивающейся с водой, можно записать такую схему реакции: При не слишком высоких концентрациях ионов можно считать 1. Тогда константу равновесия можно записать в виде уравнения: 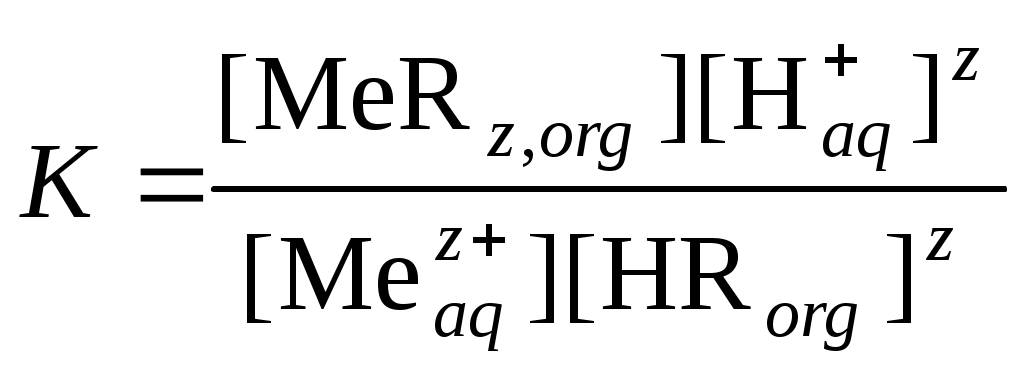 . .тогда 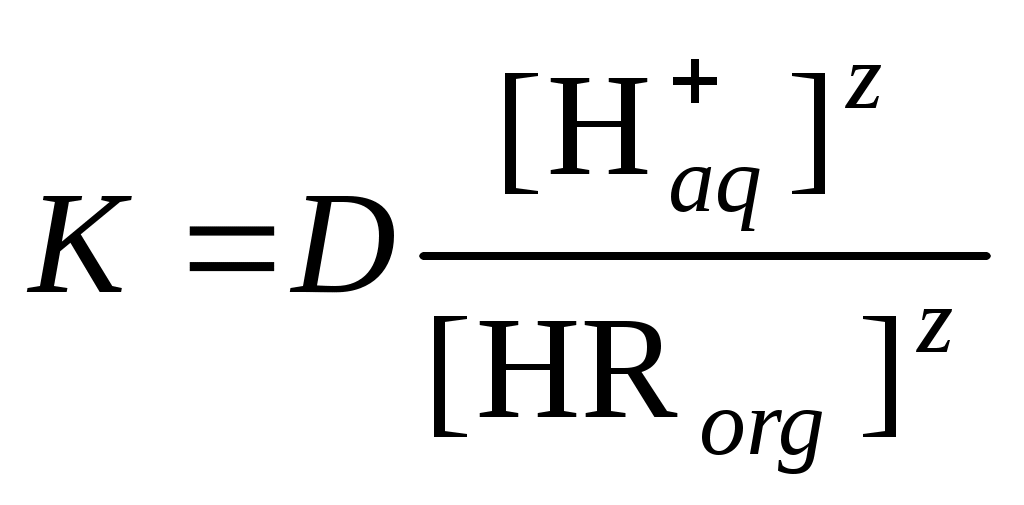 . . После логарифмирования и небольших преобразований получаем уравнение которое связывает константу равновесия и коэффициент распределения, а также показывает зависимость коэффициента распределения от концентрации экстрагента и рН. Получив экспериментальную зависимость коэффициента распределения от, например, рН при постоянной концентрации экстрагента можно определить сольватное число z и константу равновесия процесса экстракции. Контрольные вопросы1. В чем сущность процесса экстракции? 2. Чем характеризуется состояние экстракционного равновесия? 3. Что означает «физическое распределение» и «химическое распределение» компонента в экстракционной системе? 4. Какая характеристика вещества лежит в основе физической экстракции? 5. Области применения метода физической экстракции. 6. За счет чего протекает «химическая экстракция»? 7. Чем определяется эффективность процесса химической экстракции? 8. Что представляет собой экстрагент в химической экстракции? 9. Строение химического экстрагента. 10. Основные типы химических экстракционных систем и реакции, лежащие в их основе. 11. Основные количественные характеристики процесса экстракции: коэффициент распределения, степень извлечения, константа равновесия. 12. Взаимосвязь константы равновесия и коэффициента распределения при экстракции карбоновыми кислотами. 13. Как определить сольватное число и константу равновесия на основании экспериментальных данных? |
