Лабораторные фх. Лабник по ф и к химии. Физическая и коллоидная химия сборник лабораторных работ СанктПетербург 2008 удк 541 076 (075. 83) Физическая и коллоидная химия. Сборник лабораторных работ
 Скачать 4.14 Mb. Скачать 4.14 Mb.
|
Лабораторная работа № 26. Определение размеров частиц дисперсных систем турбидиметрическим методомКраткие теоретические сведенияУравнение Рэлея может быть использовано для определения размеров частиц формы, близкой к сферической, если их радиус R не превышает 0,1 длины волны падающего света. Уравнение Рэлея определяет интенсивность рассеянного света от размера частиц, угла рассеяния и длины волны падающего света: где I0 – интенсивность падающего света, I – интенсивность рассеянного света, С – концентрация частиц в единице объема, V – объем частицы, - длина волны падающего света, r – расстояние частицы от источника света (оптический путь), β – угол рассеяния. F – функция показателей преломления дисперсной и дисперсионной среды: 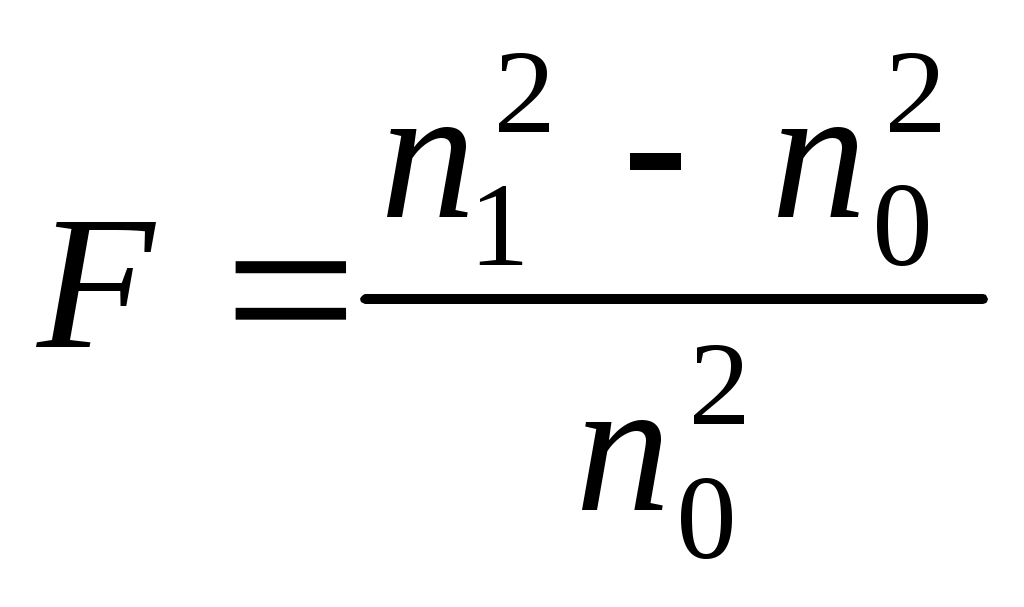 , ,где n1, n0 – показатели преломления дисперсной и дисперсионных фаз соответственно. Из уравнения Рэлея радиус частицы равен: где С – концентрация взвешенных частиц, – мутность системы, Необходимым условием использования уравнения Релея для дисперсных систем является отсутствие поглощения света, а также минимум вторичного светорассеяния. Поэтому уравнение Рэлея применимо только для «белых» золей, т.е., не поглощающих свет дисперсных систем при очень низких концентрациях дисперсной фазы. Для дисперсных сред, неудовлетворяющих уравнению Рэлея используют турбидиметрические измерения. Турбидиметрические методы основаны на измерении интенсивности проходящего через дисперсную среду света. Рассеянный свет можно считать фиктивно поглощенным, поэтому для дисперсных сред закон Бугера –Ламберта – Бера связывает мутность среды с кажущейся оптической плотностью: где d – средний диаметр поглощающих свет частиц; При постоянных значениях среднего диаметра частиц d, характера суспензии где K – молярный коэффициент мутности. Мутность = I/I0 и оптическая плотность D пропорциональна концентрации и квадрату объема частиц. Это позволяет определять размеры частиц и их концентрацию по кажущейся оптической плотности системы с помощью турбидиметрических измерений. При увеличении размеров частиц закон Рэлея не выполняется, и интенсивность рассеянного света становится обратно пропорциональной длине волны в степени меньше чем четвертая. В общем случае для поглощающих золей степень при длине волны становится дробной, что делает невозможным использование уравнения Рэлея. Если размер (диаметр) взвешенных частиц составляет от 1/10 до 1/3 длины световой волны и показатели преломления частиц и среды не сильно различаются, то в случае турбидиметрических измерений можно пользоваться эмпирическим уравнением Геллера: D = k−n и = k’−n, где k и k’ – константы, не зависящие от длины волны. Зависимость lgD или lg от lg представляет собой прямую, тангенс угла наклона которой равен –n. Показатель степени связан с длиной волны и размером частиц эмпирическим соотношением: которое табулировано для n < 4 (табл. 1). С увеличением z значение n уменьшается в пределе к 2 для частиц, радиус которых больше длины волны. При малых значениях z показатель степени n стремится к 4 и выполняется уравнение Рэлея. Контрольные вопросы1. Как формулируется закон Рэлея для дисперсных систем? 2. Какова формула закона Бугера-Ламберта-Бэра для кажущейся оптической плотности? 3. Как зависят свойства дисперсных систем в от размера частиц? 4. Что такое дисперсионный анализ серий измерений? 5. Как влияет ошибка определения Z на расчет радиуса частиц? 6. Как влияет длина волны на точность определения радиуса частиц золя? Цель работы: определение размеров дисперсных частиц, не подчиняющихся закону Рэлея. Сущность работы. Экспериментально измеряют кажущуюся оптическую плотность дисперсной системы при различных длинах волн (в достаточно узком интервале ) и строят график в координатах lgD – lg. Затем рассчитывают средний (наиболее вероятный) радиус частиц исследуемой дисперсной системы. Оборудование и реактивы. Фотоэлектроколориметр; кюветы толщиной 1 см – 2 шт.; пипетка градуированная объемом 1 мл – 3 шт.; пипетка градуированная объемом 2 мл – 3 шт.; пипетка градуированная объемом 5 мл – 3 шт.; стакан химический или колба объемом 50 мл – 6 шт.; сульфат натрия – 1,1 г Na2SO410H2O растворена в 50 мл глицерина (раствор I); хлорид бария – 2,45 г BaCl22H2O растворены в 50 мл глицерина (раствор II). Выполнение работы1. Приготовить золь BaSO4 по варианту «а», «b» или «с» по описанной ниже методике. В химическом стакане или колбе объемом 50 мл приготовить смесь 1 на основе раствора I. В другом химическом стакане или колбе объемом 50 мл приготовить смесь 2 на основе раствора II. Смесь 1 осторожно вылить в смесь 2.
В зависимости от соотношения спирта и воды при разбавлении получают золи с разной величиной частиц. 2. В кювету толщиной 1 см налить до метки дистиллированную воду и насухо протереть стенки кюветы кусочком фильтровальной бумаги. 3. Кювету с водой (раствор сравнения) поместить в дальнее отделение кюветодержателя. 4. В другую кювету толщиной 1 см налить до метки пробу золя сульфата бария и насухо протереть стенки кюветы кусочком фильтровальной бумаги. 5. Кювету с золем поместить в ближнее отделение кюветодержателя. 6. Кюветодержатель поместить в кюветное отделение прибора. 7. Измерить оптическую плотность раствора при различных длинах волн в диапазоне от 400 до 700 нм с шагом 50 нм, следуя инструкции к пользованию прибором. Результаты измерений занести в таблицу 1. Содержание протокола лабораторной работыВариант приготовления золя – «а», «b» или «с» Таблица зависимости кажущейся оптической плотности от длины волны
Обработка результатов эксперимента1. По данным таблицы зависимости кажущейся оптической плотности от длины волны заполнить таблицу данных к графическому нахождению констант k и n в уравнении Геллера:
2. По данным таблицы данных к графическому нахождению констант k и n в уравнении Геллера построить график в координатах lg - lgD и по тангенсу угла наклона определить показатель степени n уравнения Геллера: D = k-n 3. По данным табл. 3 определить зависимость z = f(n), рассчитать относительную погрешность полученного аппроксимирующего уравнения для z = f(n) от табличных значений с помощью «Пакета анализа» Excel. Показатель степени n в уравнении Геллера в зависимости от параметра z
4. По найденному значению n определить параметр z. 5. Определить среднее значение длин волн: 6. Рассчитать средний радиус частиц по формуле: 7. Провести измерения с разными концентрациями золя и сравнить полученные значения, рассчитав относительную погрешность каждой серии с помощью дисперсионного анализа. Содержание отчета по лабораторной работе1. Название работы. 2. Цель работы. 3. Ход эксперимента. 4. Экспериментальные данные (см. протокол к лабораторной работе). 5. Обработка экспериментальных данных. 6. Вывод. СодержаниеВведение 3 Обработка результатов физико-химических измерений 5 Термохимия 15 Лабораторная работа № 1. Определение интегральной теплоты растворения соли и теплоты гидратообразования 23 Лабораторная работа № 2. Определение энтальпии диссоциации слабого электролита 28 Лабораторная работа № 3 Определение изменения энтальпии реакции нейтрализации 33 Коллигативные свойства растворов 38 Лабораторная работа № 4. Криометрия 44 Фазовые равновесия в однокомпонентных системах 48 Лабораторная работа №5. Давление насыщенного пара 54 Фазовые равновесия в двухкомпонентных системах 60 Лабораторная работа №6. Получение кривой разгонки 67 Лабораторная работа № 7. Получение диаграммы состояния двухкомпонентной неконденсированной системы 74 Распределение вещества в двухфазной системе. Экстракция 82 Лабораторная работа № 9. Экстракция цветных металлов нафтеновой кислотой 89 Электропроводность растворов электролитов 96 Лабораторная работа № 10. Определение степени диссоциации слабого электролита кондуктометрическим способом 104 Лабораторная работа №11. Определение чисел переноса ионов 110 Термодинамика электрохимических систем 118 Лабораторная работа № 12. Определение стандартных электродных потенциалов 126 Лабораторная работа № 13. Определение коэффициента активности электролита 133 Ионометрия и рН-метрия 138 Лабораторная работа № 14. Определение константы диссоциации слабого электролита потенциометрическим методом 143 Строение вещества. Молекулярные спектры 149 Лабораторная работа № 15. Определение константы нестойкости тиоцианата (роданида) железа фотометрическим методом 156 Химическая кинетика 160 Лабораторная работа № 16. Определение константы скорости реакции окисления иодида калия персульфатом аммония 163 Лабораторная работа № 17. Исследование кинетики омыления сложного эфира 169 Коллоидная химия 170 Поверхностные явления. Сорбция 170 Молекулярная адсорбция 178 Ионообменная адсорбция 190 Лабораторная работа № 18. Исследование поверхности раздела фаз: раствор ПАВ - воздух 201 Лабораторная работа № 19. Исследование молекулярной адсорбции растворенного вещества из растворов на активированном угле 208 Лабораторная работа № 20. Исследование обменной адсорбции ионов 214 Лабораторная работа № 21. Исследование кинетики ионообменной адсорбции 219 Лабораторная работа №22. Разделение меди и цинка на катионите 228 Устойчивость дисперсных систем 233 Лабораторная работа № 23. Получение лиофобных золей 245 Лабораторная работа № 24. Определение порога коагуляции визуальным методом 250 Лабораторная работа № 25. Изучение коагуляции гидрозоля железа 257 Лабораторная работа № 26. Определение размеров частиц дисперсных систем турбидиметрическим методом 261 Содержание 269 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
