Лабораторные фх. Лабник по ф и к химии. Физическая и коллоидная химия сборник лабораторных работ СанктПетербург 2008 удк 541 076 (075. 83) Физическая и коллоидная химия. Сборник лабораторных работ
 Скачать 4.14 Mb. Скачать 4.14 Mb.
|
Устойчивость дисперсных системКраткие теоретические сведенияЗоли – это свободнодисперсные коллоидные системы с неупорядоченным расположением в пространстве частиц дисперсной фазы размером 10−5 – 10−7 см. Для получения лиофобных коллоидно-дисперсных систем необходимы три условия: 1) наличие взаимно нерастворимых веществ; 2) достижение необходимой степени дисперсности; 3) присутствие стабилизатора. Необходимую степень дисперсности частиц можно достичь двумя методами: дисперсионным и конденсационным. Дисперсионный метод основан на измельчении дисперсной фазы механическим способом (в коллоидных мельницах, с помощью ультразвука, в пламени вольтовой дуги и т.п.) или методом пептизации – физико-химическим дроблением рыхлых осадков, в которых частицы дисперсной фазы разделены прослойками дисперсионной среды. Перевести такой осадок в коллоидный раствор можно создавая условия для появления сил взаимного отталкивания частиц осадка друг от друга. Конденсационный метод основан на укрупнении частиц, агрегации молекул или ионов в истинных растворах в более крупные образования – ядра, гранулы, мицеллы – частицы новой фазы образующейся ультрамикрогетерогенной системы, отделенные от среды высокоразвитой поверхностью раздела. Условия для возникновения зародышей новой фазы возникают лишь в нестабильной системе (пересыщенных растворах, пересыщенном паре) в местах, где образуются местные пресыщения – флуктуации концентрации или плотности. Размеры образующихся частиц зависят от условий проведения конденсации, от соотношения между скоростями двух одновременно идущих процессов: образования зародышей и их роста. Для получения мелких частиц, т.е. частиц дисперсной фазы будущего коллоидного раствора, необходимо, чтобы скорость первого процесса превышала скорость второго. Практически такие условия создаются в весьма разбавленных растворах, в которых скорость роста частиц весьма невелика и частицы под действием броуновского движения практически не оседают, находясь во взвешенном состоянии. Различают физическую и химическую конденсацию. Одним из примеров физической конденсации является метод замены растворителя: раствор какого-либо вещества постепенно при перемешивании прибавляют к жидкости, в которой это вещество нерастворимо. Таким способом, например, можно получить гидрозоли серы, фосфора, канифоли, вливая их спиртовые растворы в воду. Химическая конденсация основана на проведении химических реакций (окислительно-восстановительных, обмена, гидролиза), в результате которых образуются малорастворимые соединения. Чтобы получить их в виде коллоидного раствора нужно: 1) вести реакцию в разбавленных растворах для обеспечения необходимой дисперсности частиц и их седиментационной устойчивости; 2) одно из реагирующих веществ необходимо взять в избытке – для создания на поверхности частиц двойного электрического слоя и обеспечения агрегативной устойчивости. Основным свойством лиофобных дисперсных систем является их термодинамическая неустойчивость, неравновесность, связанная с большим запасом избыточной свободной энергии на высокоразвитой поверхности раздела фаз. Поэтому в таких системах самопроизвольно протекает процесс слипания дисперсной фазы – коагуляция. Для придания лиофобным золям агрегативной устойчивости (устойчивость против коагуляции) необходимо создать на поверхности частиц защитные слои. 1) образующийся на поверхности твердой частицы двойной электрический слой: при избирательной адсорбции ионов определенного знака, появляются силы электростатического отталкивания одноименно заряженных частиц дисперсной фазы; 2) образование на поверхности частицы сольватных слоев, которые в силу своих особых структурно-механических свойств препятствуют соприкосновению и слипанию частиц. Таким образом, стабилизаторами лиофобных золей тонких суспензий могут служить ионы в растворе а также поверхностно-активные вещества, создающий на поверхности раздела фаз сольватно-адсорбционные слои. Способов образования ДЭС или сольватного слоя несколько. 1. Достройка кристаллической решетки. В этом случае на поверхности твердой фазы сорбируются ионы, теоретически способные принять участие в строительстве кристаллической решетки. Таким образом, ионы должны быть идентичны ионам, входящим в состав твердой фазы либо являться изоморфными (подходящий радиус иона и похожие химические свойства): 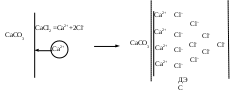 2. Принцип образования малорастворимого соединения. В этом случае на поверхности кристалла сорбируются ионы, которые теоретически могут создать малорастворимое соединение с элементами, входящими в состав осадка: 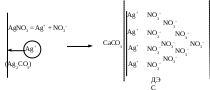 3. Принцип поверхностной диссоциации. С поверхности в раствор диссоциируют те или иные ионы. Тип иона определяется величиной изоэлектрической точки (ИЭТ), т.е. концентрации потенциалопределяющих ионов, при которой суммарный заряд (поверхности) равен нулю. 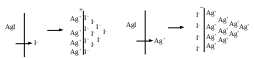 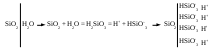 ИЭТ+ = −lgC+; ИЭТ− = −lgС−. Для малорастворимых соединений ИЭТ определяется величиной произведения растворимости L. Малорастворимое соединение диссоциирует по схеме: 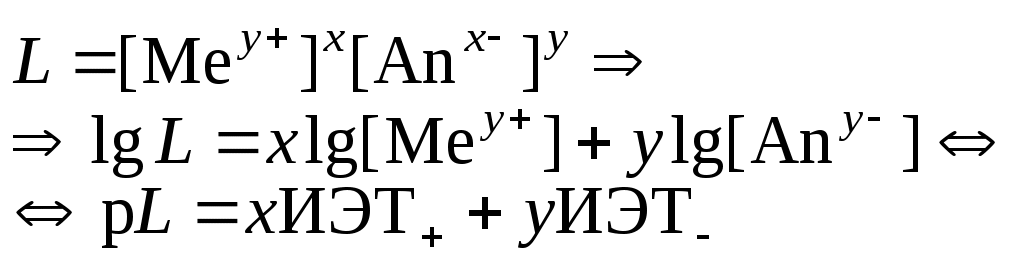 . .Положительный заряд поверхности получается при р[Me] > ИЭТ+; p[An] < ИЭТ−. Отрицательный заряд поверхности получается при р[Me] < ИЭТ+; p[An] > ИЭТ−. Для слабых не растворимых кислот и оснований ИЭТ = рН«0». Например, для слабой двухосновной кислоты H2An pHИЭТ = 0,5(рK1 + pK2). 4. Сорбция твердой поверхностью ионов с высоким сорбционным потенциалом, например, ионов H+, OH− и др. 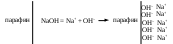 5. Ориентирование полярных молекул.  Двойной электрический слой имеет довольно сложную структуру (рис. 20). Первый слой состоит из потенциалопределяющих ионов – тех ионов, которые создают заряд поверхности φ0. Потенциалопределяющие ионы удерживаются на поверхности за счет сил хемосорбции. К потенциалопределяющим ионам за счет сил электростатического взаимодействия из раствора притягиваются противоионы, которые создают слой II и слой III. Слой II называется плотным слоем (слоем Штерна, слоем Гельмгольца). Ионы плотного слоя примыкают к заряженной поверхности. Внутри плотного слоя противоионы распределены равномерно. Плотный слой обычно имеет толщину порядка диаметра гидратированного иона d. Ионы плотного слоя примыкают к заряженной поверхности и связаны с нею двумя видами сил: адсорбционными и электростатическими. При движении коллоидной частицы в дисперсионной среде плотный слой остается связанным с дисперсной частицей. Эту часть ДЭС можно рассматривать, как плоский конденсатор, потенциал которого с увеличением расстояния от поверхности снижается линейно. Слой III называется диффузным (или слоем Гуи). Диффузный слой имеет некоторую толщину δ. Толщина плотного слоя d мала (< 1 нм) и постоянна. Толщина диффузного слоя δ существенно больше (может больше 10 нм) и сильно зависит от концентрации электролитов. При высоких концентрациях электролитов или при введении многозарядных ионов δ мала и стремится к нулю. В пределе δ = 0 и частица не заряжена. В этом случае, противоионы адсорбционного слоя полностью компенсируют поверхностный заряд ядра. В результате достигается так называемое изоэлектрическое состояние, часто сопровождающиеся потерей агрегативной устойчивости системы. В 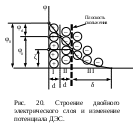 слое Гуи ионы распределены не равномерно, связаны только за счет сил электростатического взаимодействия. По теории Гуи-Чепмена противоионы диффузной части ДЭС распределяются в поле поверхностного потенциала в соответствии с законом Больцмана. Потенциал в диффузной части слоя снижается с расстоянием по экспоненте. При перемещении коллоидной частицы в дисперсионной среде ионы диффузного слоя могут отрываться. При отрыве ионов диффузного слоя возникает электрокинетический или ζ-потенциал. Гипотетическая поверхность отрыва ионов диффузного слоя называется плоскостью скольжения. ζ-потенциал является важнейшей характеристикой ДЭС. Он определяет скорость относительного перемещения дисперсной фазы и дисперсионной среды; интенсивность электрокинетических явлений (электроосмос, электрофорез); устойчивость золей. слое Гуи ионы распределены не равномерно, связаны только за счет сил электростатического взаимодействия. По теории Гуи-Чепмена противоионы диффузной части ДЭС распределяются в поле поверхностного потенциала в соответствии с законом Больцмана. Потенциал в диффузной части слоя снижается с расстоянием по экспоненте. При перемещении коллоидной частицы в дисперсионной среде ионы диффузного слоя могут отрываться. При отрыве ионов диффузного слоя возникает электрокинетический или ζ-потенциал. Гипотетическая поверхность отрыва ионов диффузного слоя называется плоскостью скольжения. ζ-потенциал является важнейшей характеристикой ДЭС. Он определяет скорость относительного перемещения дисперсной фазы и дисперсионной среды; интенсивность электрокинетических явлений (электроосмос, электрофорез); устойчивость золей. Под действием электрического поля могут двигаться дисперсная фаза относительно дисперсионной среды (электрофорез) или дисперсионная среда относительно дисперсной фазы (электроосмос). Механическое движение дисперсной фазы относительно дисперсионной среды (седиментация) вызывает возникновение электрической разности потенциалов (потенциал седиментации). Если электрическая разность потенциалов возникает при движении дисперсионной среды относительно дисперсной фазы, то такое явление называют потенциалом протекания. Наибольшее распространение из электрокинетических явлений получили электроосмос и электрофорез. Значение электрокинетического потенциала, возникающего при электроосмосе или электрофорезе можно рассчитать по уравнению Гельмгольца-Смолуховского: Линейная скорость взаимного перемещения фаз под действием электрического поля определяется уравнением Гельмгольца-Смолуховского: где ε – диэлектрическая проницаемость среды; ζ - электрокинетический потенциал; η – вязкость дисперсионной среды; Н - напряженность электрического поля, где Е – разность потенциалов, В; L – расстояние между электродами, м. Коагуляция лиофобных коллоидно-дисперсных систем чаще всего вызывается электролитами. Коагуляцию вызывают ионы, противоположные по знаку заряду коллоидных частиц. Минимальная концентрация электролита, начиная с которой за определенный промежуток времени в коллоидном растворе наблюдается видимый эффект коагуляции (изменение цвета, помутнение, появление хлопьевидного осадка) называется порогом коагуляции или критической концентрацией Скр. Эта величина служит сравнительной мерой агрегативной устойчивости дисперсной системы и коагулирующей способностью ионов электролита. Величина порога коагуляции вычисляется по формуле: где СЭЛ – концентрация раствора электролита, применяемого для коагуляции, VЭЛ – наименьший объем раствора электролита, V – суммарный объем коллоидного раствора с электролитом. В соответствии с правилом Шульце-Гарди пороги коагуляции уменьшаются с увеличением заряда иона-коагулянта и, согласно теории Дерягина-Ландау обратно пропорционально шестой степени этого заряда. Например, пороги коагуляции для одно- двух- и трехвалентных ионов а их коагулирующая способность Р (величина, обратная порогу коагуляции) соответственно относится как PI:PII:PIII = 1:64:729. Для прогноза устойчивости дисперсных систем и выбора коагулянта необходимо представлять строение коллоидной частицы – мицеллы. В состав мицеллы входит ядро, состоящее из агрегата атомов, молекул или ионов (от ста до миллионов), на поверхности которого образуется двойной электрический слой. Ядро + слой потенциалопределяющих ионов + плотный слой противоионов составляет гранулу мицеллы. Гранула имеет заряд который совпадает по знаку с зарядом потенциалобразующих ионов. Противоионы диффузного слоя уравновешивают заряд гранулы, таким образом, мицелла в целом нейтральна.  Строение коллоидных частиц принято выражать с помощью мицеллярных формул. Ниже приведен пример мицеллярной формулы золя AgI, полученного по реакции AgNO3 + KI = AgI + KNO3 при избытке KI: 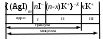 Следует отметить, что состав мицеллы может изменяться как количественно, так и качественно при изменении состава среды. Так, если бы в приведенном выше примере средой был бы раствор нитрата серебра (при избытке AgNO3), мицелла имела бы следующую формулу:  Контрольные вопросы1. Что такое золь? 2. Какие условия нужны для получения лиофобного золя? 3. Какими методами обычно получают лиофобные золи? 4. Что такое физическая и химическая конденсация? 5. Какова основная особенность лиофобных дисперсных систем? 6. Какие возникают на поверхности коллоидной частицы? 7. Какие существуют варианты образования двойного электрического слоя? 8. Какова структура двойного электрического слоя? 9. Как изменяется потенциал ДЭС с расстоянием от поверхности? 10. Какие явления называются электрокинетическими и в чем их сущность? 11. Что такое электрокинетический потенциал, и от каких параметров зависит его величина? 12. По какому уравнению можно определить значение электрокинетического потенциала на основании изучения процессов электроосмоса или электрофореза? 13. Что вызывает коагуляцию лиофобных золей? 14. Что называется порогом коагуляции? 15. Какова формулировка и математическая запись правила Шульце-Гарди? 16. Каково строение мицеллы? |
