Лабораторные фх. Лабник по ф и к химии. Физическая и коллоидная химия сборник лабораторных работ СанктПетербург 2008 удк 541 076 (075. 83) Физическая и коллоидная химия. Сборник лабораторных работ
 Скачать 4.14 Mb. Скачать 4.14 Mb.
|
Лабораторная работа № 21. Исследование кинетики ионообменной адсорбцииЦель работы: исследовать процесс очищения воды ионообменным методом. Определить величину статической обменной емкости и лимитирующую стадию процесса ионного обмена. Сущность работы: величину статической обменной емкости определяют по величине максимального поглощения, которую получают перемешивая заданное количество катионита и раствор соли металла до состояния равновесия. Лимитирующую стадию процесса определяют, изучая зависимость изменения концентрации металла от продолжительности перемешивания. Оборудование и реактивы. Тубус (реактор); мешалка; мерный цилиндр объемом 500 мл; мерный цилиндр объемом 10 мл; пипетка мерная объемом 10 мл; колба коническая объемом 250 мл – 2 шт.; кобы конические объемом 100 мл – 10 шт.; бюретка объемом 25 мл – 1 шт.; трилон Б – 0,05 М раствор; мурексид; хлорид аммония – 1 н. раствор; гидроксид аммония – разбавленный 1:1; сульфаты меди, кобальта, никеля – 0,1 М растворы. Выполнение работы1. Получить от преподавателя раствор соли металла для исследования. 2. Отобрать пробу раствора соли металла в маркированный химический стакан объемом 100 мл. 3. Провести анализ исходного раствора соли металла. Анализ содержания меди (2+): отобрать мерной пипеткой в конические колбы аликвоту объемом 5 мл; прилить дистиллированную воду до объема 20-30 мл; добавить по каплям при перемешивании аммиак до получения прозрачного синего раствора, добавить немного сухого индикатора «мурексид»; отобрать раствор трилона Б в химический стакан объемом 50 мл; из стакана раствор трилона Б налить в бюретку, выпустить воздух из носика бюретки, для чего поднять носик бюретки, подставить стакан с трилоном Б и нажать на шарик; довести объем трилона Б в бюретке до отметки «0»; титровать одну из колб с пробой раствором трилона Б до перехода окраски до перехода окраски индикатора в эквивалентной точке от желтой (хаки) к сиренево-фиолетовой; довести объем щелочи в бюретке до отметки «0»; провести титрование пробы во второй конической колбе. Анализ содержания кобальта и никеля: отобрать мерной пипеткой в конические колбы аликвоту объемом 5 мл; прилить дистиллированную воду до объема 20-30 мл; с помощью мерного цилиндра добавить 5 мл раствора хлорида аммония; добавить немного сухого индикатора «мурексид» отобрать раствор трилона Б в химический стакан объемом 50 мл; из стакана раствор трилона Б налить в бюретку, выпустить воздух из носика бюретки, для чего поднять носик бюретки, подставить стакан с трилоном Б и нажать на шарик; довести объем трилона Б в бюретке до отметки «0»; титровать одну из колб с пробой раствором трилона Б до перехода окраски до перехода окраски индикатора в эквивалентной точке от желтой к фиолетовой; довести объем щелочи в бюретке до отметки «0»; провести титрование пробы во второй конической колбе. Желтую окраску раствора поддерживают аммиаком: если в процессе титрования раствор краснеет, то добавить несколько капель аммиака. 4. Заполнить реактор установки катионитом (10 мл катионита перенести в реактор в виде водной взвеси). 5. Залить в реактор 450 мл раствора соли металла. 6. Настроить блок управления мешалки: = нажать кнопку «сеть»; = нажать кнопку «установка» для входа в режим настройки блока управления; = кнопками «выбор» и ▲▼ установить число оборотов (1200); = нажать кнопку «установка» для выхода из режима настройки; = погрузить мешалку в реактор и нажать кнопку «пуск». 7. Через каждые 3 минуты отбирать пробы раствора объемом 10 мл (Vп), которые хранят в конических колбах объемом 100 мл. Всего отобрать 10 проб. 8. Определить концентрацию соли металла в каждой пробе, отбирая для анализа 2 аликвоты по 5 мл. Анализ выполнять, используя конические колбы объемом 250 мл. Внимание!!!! Основная ошибка – неаккуратное проведение аналитических работ. Для избежания этого при анализе проб отбирать аликвоту 5 мл, ее анализировать, показывать результаты анализа преподавателю и только потом анализировать вторую аликвоту 5 мл, которая должна оставаться в конической колбе на 100 мл. Содержание протокола лабораторной работы= название соли металла и ее химическая формула; = ориентировочное значение концентрации соли металла, указанное на емкости с раствором; = объем раствора соли металла; = объем катионита; = объем аликвоты при титровании раствора соли металла Va = 5 мл; = Объем раствора трилона Б, израсходованного на титрование исходного раствора VТ,1 = ………….мл VТ,2 = ………….мл VТ, ср = ………….мл = концентрация раствора трилона Б Таблица экспериментальных данных
Обработка результатов экспериментаПо данным п. 8 заполнить таблицу:
α − текущая степень очистки воды, которую вычислить по уравнению где Сz – текущая концентрация катиона металла в растворе, моль/л; С0 – исходная концентрация катиона металла в растворе, моль/л. Концентрации катиона металла (С0 и Сz) в растворе вычислить по формуле: где СТ – концентрация трилона Б (0,05 моль/л); VТ – эквивалентный объем трилона Б, мл; Va – объем пробы, взятый для определения концентрации катиона металла, мл, Va = 5 мл. Сτ − текущая концентрация соли металла в пробе, приведенная к исходному объему, моль/л, которую вычислить по формуле: где nτ – количество моль катионов металла, оставшихся в растворе на текущий момент времени, nτ рассчитывается по формуле: где Vпр – объем пробы, отобранный для последующего определения концентрации катиона металла, Vпр = 10 мл; z – номер пробы. Построить зависимость концентрации соли металла от продолжительности перемешивания Сz = f(τ). Построить зависимость степени очистки воды от продолжительности перемешивания α = f(τ). Вычислить величину статической обменной емкости: где VK – объем катионита, м3; n∞ − количество молей катионов металла, оставшихся в растворе на момент равновесия, Построить зависимость ln(C0/Cτ) = f(τ). Построить зависимость Определить характер лимитирующей стадии процесса. При прямолинейной зависимости ln(C0/Cτ) = f(τ) стадией, определяющей скорость процесса обмена ионов, является диффузия обменивающихся ионов в тонком слое раствора в непосредственной близости от зерна ионита («пленочная кинетика» или внешнедиффузионная кинетика). Кинетическая зависимость процесса адсорбции в этом случае подчиняется уравнению первого порядка. В данном случае можно константа скорости реакции ионного обмена соответствует тангенсу угла наклона зависимости ln(C0/Cτ) = f(τ). При прямолинейной зависимости 8. Определить константу скорости процесса ионного обмена. =Для графика ln(C0/Cτ) = f(τ) или = Выбрать на графике две точки подальше друг от друга. = По осям координат определить значения ln(C0/Cτ) (или = 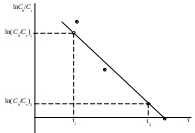 Рис. 17. Обработка графической зависимости ln(C0/Cτ) = f(τ) Содержание отчета по лабораторной работе1. Название работы. 2. Цель работы. 3. Ход эксперимента. 4. Экспериментальные данные (см. протокол к лабораторной работе). 5. Обработка экспериментальных данных. 6. Вывод. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
