Лабораторные фх. Лабник по ф и к химии. Физическая и коллоидная химия сборник лабораторных работ СанктПетербург 2008 удк 541 076 (075. 83) Физическая и коллоидная химия. Сборник лабораторных работ
 Скачать 4.14 Mb. Скачать 4.14 Mb.
|
Лабораторная работа № 15. Определение константы нестойкости тиоцианата (роданида) железа фотометрическим методомЦель работы. Определение константы нестойкости и энергии Гиббса образования тиоцианатного комплекса железа (III). Сущность работы. С помощью фотометрического исследования окрашенных комплексов в растворах можно определить их состав и константу нестойкости. Оборудование и реактивы. Фотоколориметр; мерная колба объемом 100 мл – 1 шт.; мерные колбы объемом 50 мл – 8 шт.; пипетки градуированные объемом 10 мл – 2 шт.; пипетка мерная объемом 5 мл – 1 шт.; пипетка мерная объемом 1 мл – 1 шт.; маркированные химические стаканы объемом 100 мл – 3 шт.; химический толстостенный стакан объемом 75 мл – 1 шт.; груша или шприц – 1 шт.; стандартный раствор соли железа (концентрация реактива указана на емкости с раствором); азотная кислота – раствор, разбавленный 1:1; роданид аммония (или роданид калия) – 1 М раствор. Выполнение работы1. Приготовить рабочий раствор соли железа. В маркированный химический стакан отобрать порцию стандартного раствора соли железа. Из химического стакана в мерную колбу объемом 100 мл мерной пипеткой отобрать 5 мл стандартного раствора соли железа, довести уровень жидкости в мерной колбе дистиллированной водой до метки, закрыть колбу пробкой и перемешать раствор, переворачивая мерную колбу не менее 40 раз. 2. Вычислить объем рабочего раствора соли железа (III) необходимый для получения 50 мл раствора с концентрацией по железу от 0,8104 до 1,6104 моль/л (по заданию преподавателя). 3. В 7 мерных колб на 50 мл отбирают рассчитанный объем стандартного раствора железа, по 1 мл азотной кислоты и раствор роданида калия от 2 до 8 мл с шагом в 1 мл. 4. В отдельной мерной колбе объемом 50 мл приготовить раствор сравнения, содержащий 4 мл 1 М раствора роданида калия (или аммония) и 1 мл азотной кислоты. 5. Объем жидкости во всех колбах на 50 мл довести до метки дистиллированной водой. 6. Колбы закрыть пробками и хорошо перемешать. 7. При приготовлении раствора сравнения необходимо иметь в виду, что это раствор не должен быть окрашен. Присутствие окраски указывает на неверное приготовление раствора. 8. Измерить оптические плотности растворов в кюветах толщиной 1 см при длине волны 480 нм относительно раствора сравнения. 9. Результаты эксперимента занести в таблицу. Содержание протокола лабораторной работыКонцентрация стандартного раствора соли железа Объем стандартного раствора соли железа, взятый для приготовления рабочих растворов в колбах на 50 мл Концентрация раствора роданида калия (аммония) Толщина кюветы Длина волны Таблица 1 Зависимость оптической плотности от количества роданида калия
Обработка результатов эксперимента1. Заполнить таблицу:
где СKSCN = 1 моль/л; 50 – объем мерной колбы, мл; VKSCN – берется из условий эксперимента, мл; где С(Fe)ст. – концентрация стандартного раствора соли железа, моль/л, в пересчете на железо; V(Fe)ст – объем стандартного раствора соли железа, взятый для приготовления рабочих растворов, мл; 50 – объем мерной колбы, мл. 2. По данным таблицы построить график в координатах: 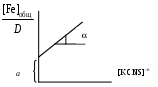 где n = 1, 2 или 3. т.е. требуется построить три графика и выделить тот, где зависимость будет наиболее прямолинейная для дальнейшей работы. 3. Выделить линейный участок графической зависимости и экстраполировать его до пересечения с осью ординат. Найти tg и а, по значениям которых вычислить Kn и по формулам 4. Определить значение 5. Сделать вывод об устойчивости роданидного комплекса железа. |
