Лабораторные фх. Лабник по ф и к химии. Физическая и коллоидная химия сборник лабораторных работ СанктПетербург 2008 удк 541 076 (075. 83) Физическая и коллоидная химия. Сборник лабораторных работ
 Скачать 4.14 Mb. Скачать 4.14 Mb.
|
Лабораторная работа № 17. Исследование кинетики омыления сложного эфираЦель работы: определить константу скорости реакции омыления сложного эфира щелочью. Сущность работы: Реакциями омыления называют реакции разложения сложных эфиров под действием щелочей, например, взаимодействие уксусно-этилового эфира и гидроксида натрия протекает по реакции: CH3COOC2H5 + NaOH = CH3COONa + C2H5OН, которая протекает по суммарному второму порядку (по первому порядку для каждого из компонентов). Кинетическое уравнение реакции описывается формулой: Если в начальный момент времени τ = 0 обозначить концентрацию щелочи где х – изменение концентрации в результате протекания реакции омыления. Оборудование и реактивы. Секундомер; мерная колба объемом 500 мл – * шт.; бюретка, коническая колба объемом 200 мл – 5 шт.; реактор объемом 1000 мл (банка с притертой пробкой) – 1 шт.; мерная пипетка объемом 50 мл – 1 шт.; колба круглодонная объемом 500 мл – 1 шт.; обратный холодильник длиной….. мм – 1 шт.; соляная кислота – 0,1 М раствор (от 0,025 до 0,35 М); гидроксид натрия – 0,1 М раствор (от 0,025 до 0,35 М); уксусно-этиловый эфир; Выполнение работыСПРОСИТЬ У ТАМАРЫ АЛЕКСЕЕВНЫ!!! Коллоидная химияПоверхностные явления. СорбцияКраткие теоретические сведенияСостояние находящихся в поверхностном слое молекул иное по сравнению с молекулами, находящимися в объеме фазы. Молекулы в объеме равномерно окружены такими же молекулами и поэтому их силовые поля полностью скомпенсированы. Молекулы поверхностного слоя взаимодействуют как с молекулами одной фазы, так и с молекулами другой фазы, в результате чего равнодействующая молекулярных сил не равна нулю и направлена внутрь той фазы, с которой взаимодействие больше. Таким образом, возникает поверхностное натяжение σ, стремящееся сократить поверхность. Поверхностное натяжение можно представить как энергию переноса молекул из объема тела на поверхность: Отсюда следует, что поверхностное натяжение есть энергия Гиббса, приходящаяся на единицу поверхности. Поскольку поверхностное натяжение определяется энергией, приходящейся на единицу площади, его единицами измерения являются Дж·м−2 = Н·м−1. Способность веществ влиять на поверхностное натяжение получила название поверхностная активность g (П.А. Ребиндер). Математически поверхностная активность представляет собой производную поверхностного натяжения по активности (концентрации) компонента в растворе: Поверхностная активность представляет собой силу, удерживающую молекулы вещества в поверхностном слое. Вещества, снижающие при растворении поверхностное натяжение (dσ/dС < 0, g > 0), называются поверхностно-активными (ПАВ). Их поверхностная активность является положительной величиной. Поверхностно-активными будут вещества менее полярные, чем растворитель. Молекулы ПАВ обычно состоят из углеводородного радикала R и полярной функциональной группы А (−NO2, −NH2, −OH, −COOH и др.). Такие молекулы называются дифильными. Схематически дифильные молекулы принято изображать символом  , в котором кружочком обозначается функциональная группа, а черточкой – неполярная часть (углеводородный радикал). Если в данном растворителе полярная часть ПАВ способна диссоциировать, то такое поверхностно-активное вещество называется ионогенным. , в котором кружочком обозначается функциональная группа, а черточкой – неполярная часть (углеводородный радикал). Если в данном растворителе полярная часть ПАВ способна диссоциировать, то такое поверхностно-активное вещество называется ионогенным.При добавлении веществ более полярных, чем растворитель, поверхностное натяжение раствора увеличивается (dσ/dС > 0, g < 0). Концентрация более полярного компонента в поверхностном слое меньше, чем в объеме раствора. Такие вещества называются поверхностно-инактивными (ПИВ). К ПИВ относятся практически все водные растворы неорганических электролитов: кислот, щелочей, солей. 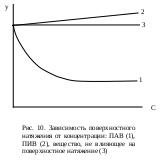 На рис. 10 приведены изотермы поверхностного натяжения – кривые, характеризующие изменение поверхностного натяжения при повышении концентрации вещества. Как можно видеть, при повышении концентрации ПАВ изотерма сначала круто падает почти по прямой. Наличие этого участка на изотерме определяется тем, что вначале вся поверхность раздела фаз жидкость – воздух свободна от поверхностно-активного вещества и небольшие его количества, присутствующие в растворе, почти целиком уходят на поверхность. Затем следует криволинейный участок изотермы, отвечающий средним концентрациям поверхностно-активного вещества. В этих условиях значительная часть поверхности уже занята молекулами поверхностно-активного вещества, что снижает дальнейшую его адсорбцию на границе раздела. Наконец, большим концентрациям поверхностно-активного вещества на изотерме отвечает почти горизонтальный участок, показывающий, что поверхностное натяжение мало зависит от концентрации. При этих условиях на поверхности жидкости, образуется сплошной мономолекулярный слой поверхностно-активного вещества и дальнейшая адсорбция уже невозможна. При повышении концентрации ПИВ в растворе изотерма полого поднимается. Это объясняется тем, что поверхностно-инактивные вещества благодаря большому поверхностному натяжению и хорошей растворимости уходят в объем, а на границе раздела жидкость — воздух имеется лишь сравнительно небольшая часть этого вещества, попадающая туда в результате диффузии из объема раствора. Наконец, при повышении концентрации веществ, не влияющих на поверхностное натяжение, изотерма, естественно, представляет собой прямую, параллельную оси концентраций. Сорбцией называется концентрирование какого-либо вещества в поверхностном слое в результате самопроизвольного перехода его из объема фазы. Более плотную фазу называют сорбентом; адсорбированное вещество называют сорбат или адсорбат. Сорбционное равновесие определяется двумя процессами: притяжением молекул к поверхности под действием межмолекулярных сил и тепловым движением, стремящимся восстановить равенство концентраций в поверхностном слое и объеме фазы. Различают два случая адсорбции: адсорбция на твердой поверхности и адсорбция в поверхностном слое жидкости. В первом случае следует учитывать энергетическую неоднородность поверхности и неопределенность оценки ее поверхности. Во втором случае поверхность предполагается однородной с известной площадью, однако прямое измерение количества вещества в поверхностном слое крайне затруднительно в экспериментальном отношении. Величину адсорбции выражают двумя способами. 1. Абсолютная величина адсорбции или количество вещества в поверхностном слое А, приходящееся на единицу площади поверхности или единицу массы адсорбента: где Cs – концентрация компонента в поверхностном слое, имеющем объем Vs и толщину h. 2. Величина адсорбции по Гиббсу Г или избыточная адсорбция представляет собой избыток компонента в поверхностном слое (на единицу площади поверхности) по сравнению с его количеством в равном объеме объемной фазы: где СV – равновесная концентрация компонента в объеме; С0 – исходная концентрация компонента в объеме; V – объем фазы. Абсолютная величина адсорбции и избыточная адсорбция связаны уравнением: Г = А − СVh. При экспериментальном исследовании процесса адсорбции обычно получают величину избыточной или Гиббсовской адсорбции. При малых концентрациях адсорбтива Гиббсовская адсорбция близка к абсолютной величине адсорбции, при больших концентрациях адсорбтива величина Г отличается от А. В случаях, когда по тем или иным причинам концентрация адсорбтива в поверхностном слое меньше его концентрации в объеме, величина Г отрицательна, а само явление называется отрицательной адсорбцией. Адсорбцию чаще всего характеризуют зависимостью количества адсорбированного вещества а от равновесного давления (или концентрации) при постоянной температуре; графики Г = f(p) или Г = f(C) при Т = const называются изотермами адсорбции. Изотермы имеют особенно большое значение при изучении адсорбции. Схематически вид обычных изотерм адсорбции изображен на рис. 11. 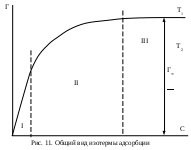 Изотерму адсорбции можно разделить на три участка. Участок I (рис. 11) называется областью Генри, т.к. при очень малых концентрациях сорбируемого вещества выполняется закон Генри: величина адсорбции при малых давлениях газа или концентрации вещества в растворе прямо пропорциональна давлению газа (концентрации растворенного вещества) Г = KГС, где KГ – константа Генри. В области Генри значительной часть поверхности адсорбента свободна. Крутой подъем изотермы при малых равновесных концентрациях хорошо согласуется с тем, что последние количества адсорбтива десорбируются с поверхности адсорбента с большим трудом. Почти горизонтальный участок, соответствующий большим давлениям или концентрациям (участок III рис. 11), отвечает поверхности адсорбента, полностью насыщенной адсорбтивом – предельная адсорбция Г∞. В этих условиях, если на поверхности адсорбента может образоваться лишь мономолекулярный слой адсорбтива, количество адсорбированного вещества перестает практически зависеть от давления или концентрации. Средний участок кривой соответствует промежуточным степеням заполнения поверхности. Математическое описание второго участка зависит от типа адсорбции и условий ее проведения. |
