Лабораторные фх. Лабник по ф и к химии. Физическая и коллоидная химия сборник лабораторных работ СанктПетербург 2008 удк 541 076 (075. 83) Физическая и коллоидная химия. Сборник лабораторных работ
 Скачать 4.14 Mb. Скачать 4.14 Mb.
|
Строение вещества. Молекулярные спектрыКраткие теоретические сведенияСпектры возникают при переходе системы (например, молекулы) из одного стационарного состояния в другое. При этом система поглощает или испускает энергию в виде кванта, величина которого равна разности энергий двух состояний: h = E2 − E1, где h – постоянная Планка, - частота света. Благодаря поглощению веществом лучистой энергии в определенной области спектра свет, прошедший через индивидуальную жидкость или раствор, имеет в этой области интенсивность I меньшую, чем интенсивность падающего света I0. Уменьшение интенсивности светового потока зависит от числа поглощающих молекул, т.е. от толщины светопоглощающего слоя l и концентрации вещества в растворе С. Для монохроматического излучения зависимость интенсивности поглощаемого света от числа поглощающих молекул описывается законом Бугера-Ламберта-Бера: или где - коэффициент поглощения, зависящий от единиц измерения концентрации и толщины слоя: если концентрация выражена в моль/л, то называют молярным коэффициентом поглощения; численно равен обратной толщине слоя жидкости с единичной концентрацией (например, 1 моль/л), уменьшающей интенсивность света в 10 раз. D – оптическая плотность, соотношение (I/I0) называется пропусканием. Закон Бугера-Ламберта-Беера справедлив только для газов и достаточно разбавленных растворов в инертных растворителях. Оптическая плотность зависит от длины волны поглощаемого света. График этой зависимости называется спектром поглощения. Спектр поглощения вещества обычно представляет собой набор полос различной интенсивности и ширины. Каждая полоса связана с электронными переходами внутри молекулы поглощающего свет вещества. Положение максимума определяется происходящим при поглощении изменением энергии системы. Чем меньше энергия, требуемая для переноса электрона, тем ниже частота поглощенного кванта света, и максимум поглощения находится в более длинноволновой части спектра. Вещества, избирательно поглощающие свет в области 380 – 780 нм, окрашены. С помощью фотометрического исследования окрашенных комплексов в растворах можно определить состав и константу нестойкости этих комплексов. Константой нестойкости называют константу равновесия диссоциации комплекса на составляющие его ионы или молекулы. При этом различают ступенчатые и общие Kn константы нестойкости. Ступенчатые константы описывают процессы последовательного, постадийного отделения лигандов по схеме: 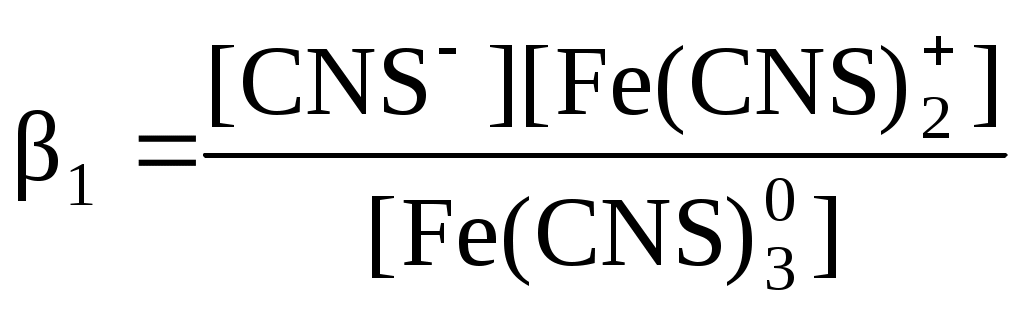 . .Суммарный процесс описывает уравнение: с общей константой нестойкости: В условиях избытка тиоцианат-иона, т.е. при и концентрация свободных ионов железа может быть вычислена по уравнению: Подставим полученные выражения для концентраций и в уравнение для константы нестойкости: 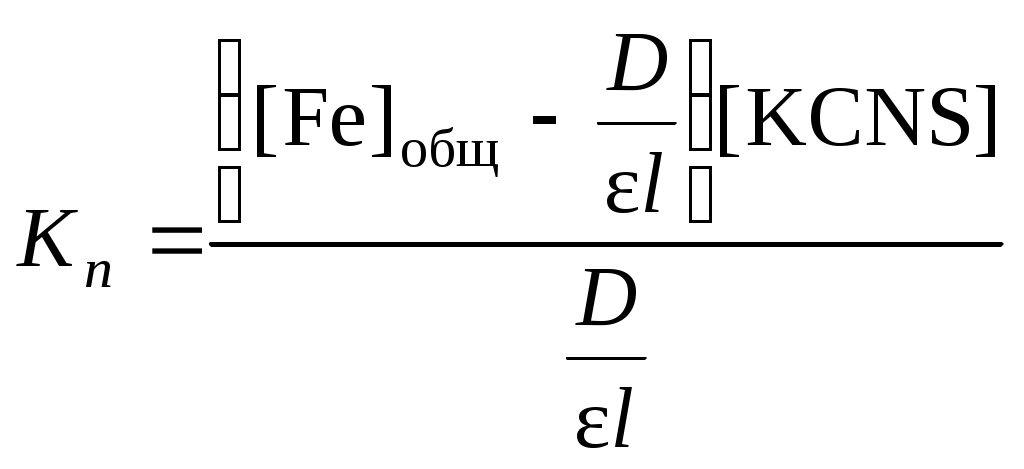 . .Данное уравнение можно привести к виду: З 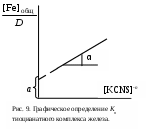 адавая ряд значений концентрации тиоцианата калия, строят графическую зависимость в координатах, указанных на рис. 9. Экстраполяцией линейной зависимости на нуль получают на оси ординат отрезок адавая ряд значений концентрации тиоцианата калия, строят графическую зависимость в координатах, указанных на рис. 9. Экстраполяцией линейной зависимости на нуль получают на оси ординат отрезок Следует отметить, что данная зависимость будет линейной только в той области концентраций тиоцианат-иона, в которой в растворе преобладает комплекс с определенным координационным числом n. В общем случае на графике по оси абсцисс следует откладывать значения [KSCN]−n, где n = 1, 2, 3, 4. Кривые будут иметь линейные участки в области преобладания в растворе комплексов с данным n, которым можно определить и Kn этих комплексов. По значениям констант нестойкости определяют энергии Гиббса образования тиоцианатных комплексов железа (III) по n ступеням: Свободная энергия диссоциации комплекса на ионы равна: С другой стороны, по закону Гесса: отсюда свободная энергия образования комплексов равна: Значения энергий Гиббса образования ионов железа (3+) и тиоцианат-иона берут из справочника. Таким образом, фотометрический метод позволяет определить константы нестойкости и энергии образования комплексных ионов в растворах, которые используют для расчета ионных равновесий, например, растворимости солей и минералов в присутствии комплексообразующих лигандов. Контрольные вопросы1. Какому состоянию атома (молекулы) соответствует наиболее низкий уровень энергии? 2. При каких условиях возникает спектр поглощения? 3. Каким уравнением описывается величина кванта света, поглощаемого молекулой? 4. Как связаны между собой частота, длина волны и волновое число? 5. К изменению каких энергетических параметров молекулы приводит поглощение ею квантов света? 6. Какова формула уравнения Бугера-Ламберта-Беера? 7. От каких параметров зависит величина оптической плотности? 8. Что такое молярный коэффициент поглощения? 9. Что такое спектр поглощения? 10. Что такое константа нестойкости? 11. От каких параметров зависит величина константы нестойкости? 12. В каких координатах строят зависимость для графического определения константы нестойкости? 13. Какую экспериментальную зависимость необходимо получить для экспериментального определения величины константы нестойкости тиоцианата железа (III)? |
