Лабораторные фх. Лабник по ф и к химии. Физическая и коллоидная химия сборник лабораторных работ СанктПетербург 2008 удк 541 076 (075. 83) Физическая и коллоидная химия. Сборник лабораторных работ
 Скачать 4.14 Mb. Скачать 4.14 Mb.
|
Лабораторная работа № 4. КриометрияЦель работы: определение молекулярной массы растворенного вещества; определение изотонического коэффициента и кажущейся степени диссоциации электролита. Сущность работы: По понижению температуры замерзания определить моляльную концентрацию вещества, а затем, зная массы растворенного вещества и растворителя, рассчитать молекулярную массу неизвестного растворенного вещества. Если известна молекулярная масса растворенного вещества до растворения, а эксперимент привел к отличному от нее значению, то рассчитать изотонический коэффициент, по значению которого сделать вывод о процессе диссоциации вещества в растворе или, наоборот, ассоциации. Оборудование и реактивы. Термометр Бекмана; криоскоп (внешняя пробирка, внутренняя пробирка с анализируемой жидкостью, стакан с охлаждающей смесью); мешалка; весы; мерная пипетка, объемом 50 мл; навеска изучаемого вещества (хлорид калия, хлорид натрия, мочевина). Выполнение работы1. Получить у преподавателя задание и навеску исследуемого вещества. 2. Взвесить внутреннюю пробирку криоскопа, налить 50 мл дистиллированной воды и снова взвесить. 3. приготовить охлаждающую смесь. Для этого во внешний стакан криоскопа поместить на 2/3 объема льда, поваренную соль и налить воды. 4. Собрать криоскоп. 5. Осторожно поместить термометр Бекмана во внутреннюю пробирку. 6. Непрерывно помешивая содержимое пробирки, наблюдать за охлаждением воды до ее замерзания. За температуру замерзания принимают такое показание термометра Бекмана, которое не меняется в течение 2 – 3 мин. 7. Вынуть пробирку из охлаждающей смеси. Расплавить весь лед и повторить измерение. Результаты опытов не должны отличаться более чем на 0,02°Б. 8. Всыпать в пробирку исследуемое вещество и определить температуру замерзания полученного раствора как описано в п.п. 6, 7. Содержание протокола лабораторной работыОбъем воды, V(H2O) = …, мл. Масса воды, m(H2O) = …, г. Температура замерзания чистой воды: Tкр(Н2О)1 = …; Tкр(Н2О)2 = …; Tкр(Н2О)средняя = … Название исследуемого вещества и его химическая формула. Масса навески mр.в., г. Температура кристаллизации раствора: Tкр(р-р)1 = …… Tкр(р-р)2 = …… Tкр(р-р)средняя = …… Обработка результатов экспериментаВ зависимости от задания (по указанию преподавателя) 1. рассчитать молярную массу растворенного вещества по уравнению: где mр.в. – масса растворенного вещества, г; mр-ля – масса растворителя (вода), кг; Kкр криоскопическая постоянная растворителя, 1,86 Ккг/моль; крТ – изменение температуры замерзания раствора. 2. Вычислить изотонический коэффициент по уравнению: где 3. Оценить относительную инструментальную погрешность измерения молярной массы растворенного вещества или изотонического коэффициента: 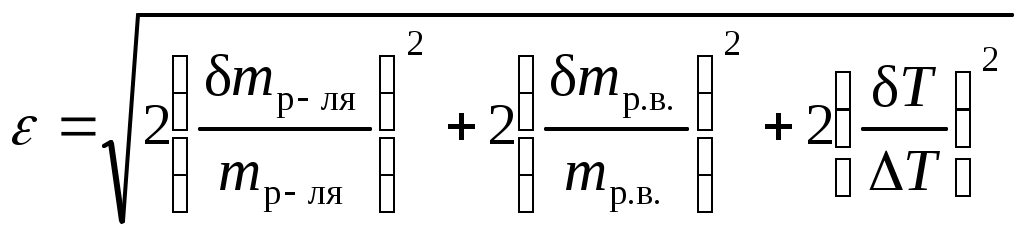 , , где – абсолютная погрешность измерения данной величины. 4. Определить абсолютную инструментальную погрешность отдельного измерения М и i и записать окончательно ответ в виде: Мр.в. = Мр.в. Мр.в. = ……., г/моль; i = i i = …….. 5. Сделать вывод о состоянии растворенного вещества в растворе. Содержание отчета по лабораторной работе1. Название работы. 2. Цель работы. 3. Ход эксперимента. 4. Экспериментальные данные (см. протокол к лабораторной работе). 5. Обработка экспериментальных данных. 6. Вывод. |
