Лабораторные фх. Лабник по ф и к химии. Физическая и коллоидная химия сборник лабораторных работ СанктПетербург 2008 удк 541 076 (075. 83) Физическая и коллоидная химия. Сборник лабораторных работ
 Скачать 4.14 Mb. Скачать 4.14 Mb.
|
Лабораторная работа № 3 Определение изменения энтальпии реакции нейтрализацииЦель работы: определение теплового эффекта процесса нейтрализации кислоты щелочью. Сущность работы: реакция нейтрализации любой сильной кислоты щелочью сопровождается экзотермическим тепловым эффектом. Для определения теплового эффекта реакции достаточно знать теплоемкость системы и вызванное реакцией изменение температуры системы. Оборудование и реактивы. Стеклянный стакан объемом 500 мл – 1 шт.; фарфоровый или стеклянный внешний стакан объемом 750 мл – 1 шт.; пипетка – 1 шт.; стеклянная палочка для перемешивания – 1 шт.; кристаллизатор – 1 шт.; штатив с лапками – 1 шт.; термометр Бекмана – 1 шт.; мерный цилиндр объемом 100 мл – 1 шт.; мерный цилиндр объемом 500 мл – 1 шт.; секундомер, весы, раствор серной кислоты; гидроксид натрия – раствор концентрацией 1 моль/л. Выполнение работы1. Получить у преподавателя наименование слабой кислоты, с которой будет выполняться эксперимент. 2. Взвесить на технических весах внутренний стакан калориметрической установки, пипетку и стеклянную палочку-мешалку. 3. Определить объем ртутного баллона термометра. Для этого опустить нос термометра в мерный цилиндр объемом 100 мл, куда предварительно налито 50 мл воды и, по разности уровней жидкости в цилиндре, определить объем ртути, VHg. 4. Во внутренний стакан калориметрической установки поместить 300 мл раствора серной кислоты Vк (отбирать цилиндром на 500 мл). Массу раствора определить по разности масс пустого стакана и стакана с раствором mр-р = mстакана с раствором mстакана. 5. Налить в пипетку около 20 мл раствора щелочи (3/4 объема пипетки) и взвесить. По разности определить массу щелочи mщ = mпипетки с раствором mпипетки. 6. Собрать калориметрическую установку, проверить герметичность пипетки!!! До окончания опыта пипетка остается в стакане с кислотой!!! 7. Пустить секундомер и через каждые 30 секунд записывать показания температуры (см. табл.) по термометру Бекмана в течение 5 минут (10 показаний) при постоянном перемешивании (начальный период). 8. Не прекращая отсчета времени и измерения температуры!!! Открыть пипетку и выпустить щелочь в кислоту. Промыть пипетку, приподнимая и опуская ее в стакане. По-прежнему через каждые 30 секунд записывать показания термометра Бекмана до установления постоянной температуры в калориметрической установке (главный период). 9. Получить еще 10 показаний при постоянной температуре (конечный период). Содержание протокола лабораторной работыНазвание слабой кислоты и ее химическая формула Концентрация раствора серной кислоты Ск Масса стеклянной палочки, г Масса внутреннего стакана калориметрической установки mстакана, г Масса стакана с раствором mстакана с раствором, г Масса раствора mр-ра, г Масса пипетки mпипетки, г Масса пипетки со щелочью mпипетки с раствором, г Масса щелочи mщ, г Объем раствора щелочи Vщ, мл Концентрация раствора щелочи Сщ, моль/л Объем ртутного баллона термометра VHg, мл Измерения температуры (таблица).
Обработка результатов эксперимента1. Построить график зависимости Т = f(τ), отражая показания температуры по начальному и конечному периодам. 2. Соединить последнюю точку начального периода с начальной точкой конечного периода. 3. Полученную линию разделить пополам. 4. Через точку середины провести перпендикуляр к оси абсцисс. 5. Продлить температурные зависимости начального и конечного периодов до пересечения с перпендикуляром – получим значение изменения температуры Т. 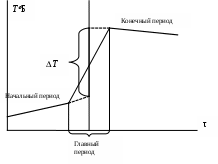 6. Рассчитать теплоемкость калориметрической установки по уравнению: Сcal = Cр-р(mp-p + mщ) + СHgVHg + Cстm, Дж/К, где Cр-р – удельная теплоемкость раствора, 4,18 Дж/гК; mp-p – масса раствора во внутреннем стакане, г; mщ – масса раствора щелочи в пипетке, г; СHg – объемная теплоемкость ртути и стекла, 1,92 Дж/см3К, VHg – объем баллона термометра, содержащего ртуть, мл; Cст – удельная теплоемкость стекла, 0,79 дж/гК; m – общая масса стеклянных частей калориметрической установки, г. 7. Вычислить тепловой эффект процесса нейтрализации по уравнению: где nщ – количество вещества щелочи в пипетке, моль. 8. Пользуясь справочными данными рассчитать Содержание отчета по лабораторной работе1. Название работы. 2. Цель работы. 3. Ход эксперимента. 4. Экспериментальные данные (см. протокол к лабораторной работе). 5. Обработка экспериментальных данных. 6. Вывод. | ||||||||||||||||||
