Лабораторные фх. Лабник по ф и к химии. Физическая и коллоидная химия сборник лабораторных работ СанктПетербург 2008 удк 541 076 (075. 83) Физическая и коллоидная химия. Сборник лабораторных работ
 Скачать 4.14 Mb. Скачать 4.14 Mb.
|
Коллигативные свойства растворовКраткие теоретические сведенияКоллигативные свойства раствора зависят только от концентрации растворенного вещества. К коллигативным свойствам относятся понижение давления насыщенного пара растворителя, повышение температуры кипения раствора, понижение температуры замерзания и осмотическое давление. Давление насыщенного пара растворителя над раствором всегда меньше, чем давление насыщенного пара растворителя над ним самим: 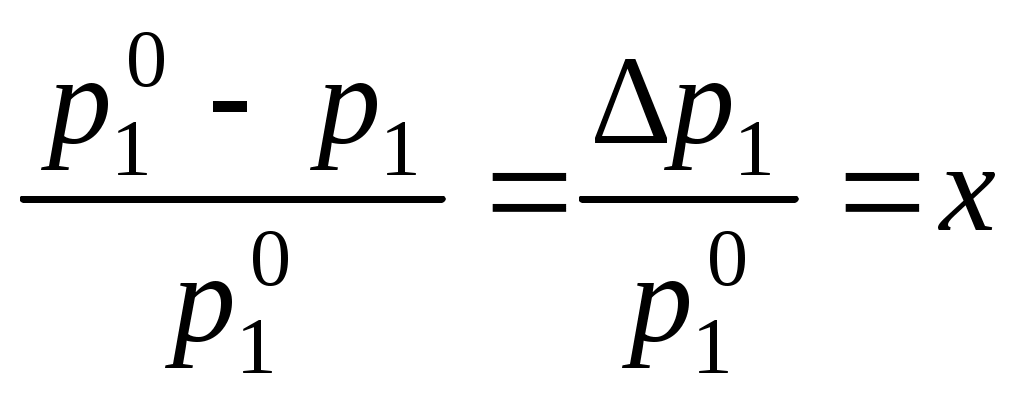 , ,где p1 – давление насыщенного пара растворителя над раствором, Раствор всегда кипит при температуре, большей, чем чистый растворитель: 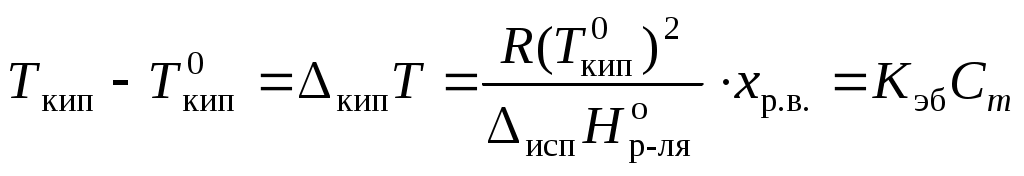 , , где Ткип – температура кипения раствора; 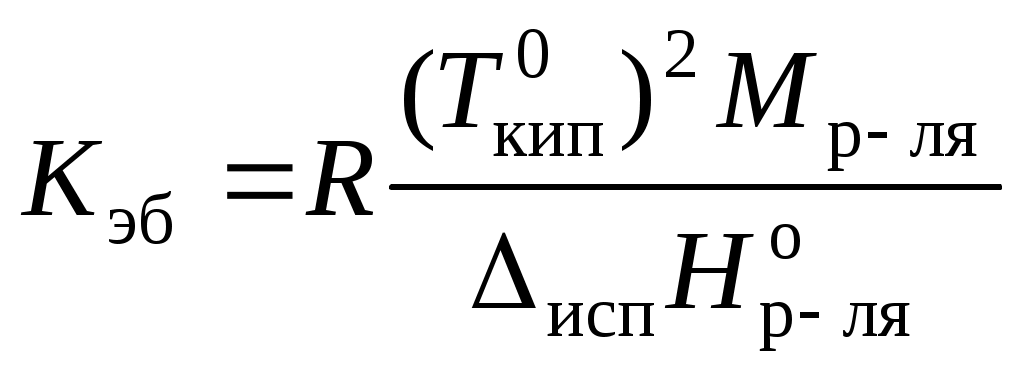 , , где Мр-ля – молярная масса растворителя, кг/моль. Раствор замерзает при температуре меньшей, чем чистый растворитель: 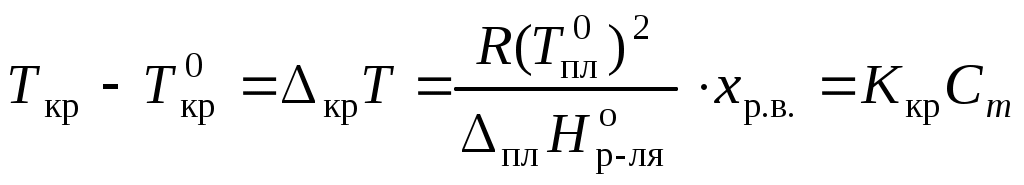 , ,где Ткр – температура кристаллизации раствора; 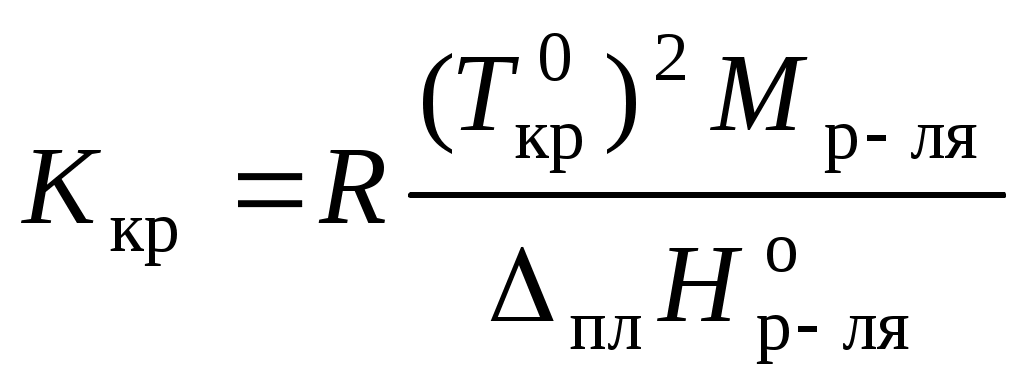 . .Например, для воды криоскопическая постоянная равна 1,86 K·кг/моль, для бензола – 5,07, диоксана – 4,71 и т.д. Осмотическое давление: где R – универсальная газовая постоянная; Т – температура; xр.в. – мольная доля растворенного вещества; СМ – молярная концентрация раствора; Коллигативные свойства определяются свойствами чистого растворителя и не зависят от свойств растворенного вещества. Для того, чтобы сделать существующие уравнения пригодными для расчетов растворов электролитов, Вант-Гофф ввел в них множитель i, названный изотоническим коэффициентом. Изотонический коэффициент является показателем увеличения (уменьшения) числа частиц вследствие диссоциации (ассоциации). Значение i >1 свидетельствует о наличии процесса диссоциации, а i < 1 – о процессе ассоциации. С учетом изотонического коэффициента для растворов электролитов получим: 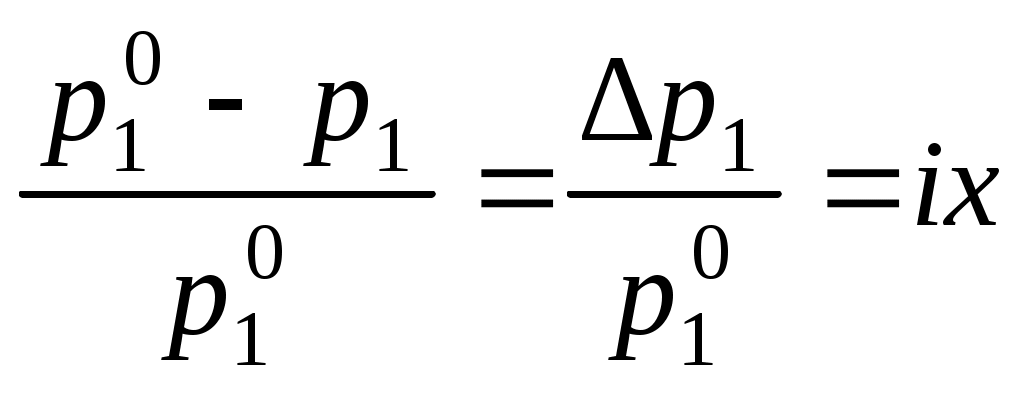 , ,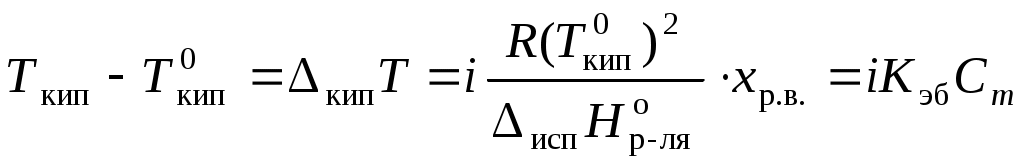 , ,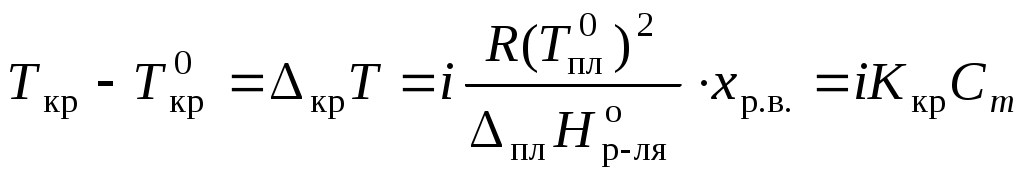 , ,Численное значение изотонического коэффициента позволяет для случая диссоциации вычислить степень диссоциации : для случая ассоциации вычислить степень ассоциации : где Коллигативные свойства растворов используются для определения молярной массы растворенных веществ, а также для определения изменения состояния вещества в растворе по сравнению с чистым веществом. Контрольные вопросы1. Какие свойства растворов называются коллигативными? 2. От величины какого параметра системы зависит значение коллигативного свойства? 3. На каких основных положениях основана теория коллигативных свойств растворов? 4. Как изменяется давление насыщенного пара растворителя при переходе от числого растворителя к раствору? 5. Как изменение давления насыщенного пара растворителя связано с концентрацией раствора? 6. Как сказывается изменение концентрации раствора на его температуре кипения? 7. Какое уравнение отображает зависимость температуры кипения раствора от концентрации растворенного вещества? 8. Как сказывается изменение концентрации раствора на его температуре кристаллизации? 9. Какое уравнение отображает зависимость температуры кристаллизации раствора от концентрации растворенного вещества? 10. Каким уравнением связаны криоскопическая постоянная растворителя и его термодинамические характеристики? 11. Каким уравнением связаны эбуллиоскопическая постоянная растворителя и его молярная масса? 12. Что такое осмотическое давление? 13. Каким уравнением описывается зависимость осмотического давления от концентрации раствора? 14. Свойствами какого компонента раствора определяются коллигативные свойства? 15. С какой целью в уравнения коллигативных свойств растворов был добавлен изотонический коэффициент? 16. Что показывает изотонический коэффициент? 17. Как изотонический коэффициент связан со степенью диссоциации или ассоциации вещества в растворе? 18. Какие свойства системы могут быть определены на основании измерения коллигативных свойств? |
