Физиология центральной нервной системы
 Скачать 2.85 Mb. Скачать 2.85 Mb.
|
|
Катехоламины (дофамин, норадреналин, адреналин) – производные аминокислоты тирозина. Дофаминергические нейроны находятся у млекопитающих животных в среднем мозге, в гипоталамической области, норадренергические – в среднем мозге, в варолиевом мосту, в продолговатом и промежуточном мозге. Самая значительная группа норадренергических клеток находится в голубом пятне, в составе периферической нервной системы в симпатической цепочке ганглиев и в некоторых интрамуральных ганглиях. Адренергические нейроны обнаружены у млекопитающих животных в продолговатом мозге. Серотонин (5-окситриптамин) – производное аминокислоты триптофана. Серотонинергические нейроны распространены в древних, стволовых частях головного мозга, их отростки не покидают центральную нервную систему. Тела нейронов лежат преимущественно в срединной области мозгового ствола в составе дорсального и медиального ядер шва продолговатого мозга, среднего мозга и варолиева моста. Серотонинергические волокна иннервируют обширные области ЦНС (новую кору, гиппокамп, бледный шар, миндалину и др.). Ацетилхолин относится к простым эфирам – уксуснокислый эфир холина. Ацетилхолинергические нейроны широко распространены в ЦНС, секреторные терминали которых лежат как в ЦНС, так и вне ЦНС. В качестве медиаторов в ЦНС выделен целый ряд свободных аминокислот: глутаминовая кислота, аспарагиновая кислота, гамма-амино- масляная кислота, глицин. Глицин является медиатором для некоторых интернейронов спинного и продолговатого мозга. Кроме того, в качестве медиаторов рассматриваются некоторые пептиды, например вещество Р, выделенное в 1931 году Эйлером и Гэбдумом из кишки кролика. Существует несколько форм пептидов, одна из которых, состоящая из 11 аминокислот, обнаружена в задних корешках спинного мозга. Гипоталамические нейрогормоны (вазопрессин, окситоцин и др.) признаются в качестве медиаторов, гистамин, производное аминокислоты гистидина, АТФ (пуринергические нейроны), аспарагиновая кислота также относятся к медиаторам; карнозин-дипептид предположительно является передатчиком в окончаниях обонятельного нерва на митральных клетках обонятельных луковиц и др. В результате многолетних исследований по проблемам синаптологии постепенно выделился ряд принципов: 1. Единство секреторного химизма (принцип Дейла). Одна из закономерностей, сформулированная Дейлом, заключается в том, что разные секреторные терминали одного нейрона выделяют один и тот же набор химических веществ. Прежде полагали, что разные терминали одного нейрона выделяют один и тот же медиатор. При этом имелось в виду, что нейрон метаболически един. Но современные данные показывают, что медиатор секретируется не изолированно, а вместе с веществами-спутниками, которые вместе с ним находятся внутри секреторных везикул (например, вместе с норадреналином – АТФ, с дофамином – бета-оксидаза и др.). 2. Амбивалентность медиатора. Противоположную точку зрения высказывал Экклс: «Нервная клетка не может быть амбивалентной по механизму своего действия на субсинаптическую мембрану». Современная наука это не подтвердила. Сейчас доказана амбивалентность медиатора и нейрона. Один и тот же медиатор может обеспечить разнообразные синаптические эффекты, различающиеся по знаку действия и по ионному механизму. Для большинства синапсов амбивалентность связана с наличием различных рецепторов как на постсинаптической мембране, так и на пресинаптической. Например, в норадренергическом синапсе выявлены α1-, α2-, β1- и β2-рецепторы, в холинергическом синапсе – М- и Н-рецепторы и т.д. Именно рецептор в большинстве случаев определяет, какой ионный канал будет открыт и какие ионные токи будут формировать постсинаптический потенциал. 3. Специфичность секреторного химизма нейрона. Каждому нейрону свойственен определенный тип химизма, который характеризуется набором секреторных органелл, ферментов, функциональных белков, нейропептидов и т.д. Представление о секреторной специфичности нервных клеток – это одно из крупных достижений современной физиологии. Для каждого синапса, исходя из его специфичности, найдены специфические блокаторы и активаторы его деятельности, влияющие на разные механизмы: на активность ферментов, на состояние рецепторов и на метаболизм. Например, кураре блокирует рецепторы постсинаптической мембраны в нервно-мышечном синапсе, токсин Cl. botulinum оказывает «функциональную денервацию» – блокирует высвобождение медиатора из пресинаптического окончания и т.д. Некоторые примеры механизмов действия трансмиттеров (ацетилхолин, глутамат, серотонин и др.) на различные типы рецепторов приведены в таблице 1.2. Таблица 1.2 Примеры механизмов действия трансмиттеров на различные типы рецепторов
2.3. Освобождение медиаторов В пресинаптическом нервном окончании в синаптических везикулах аккумулируются медиаторы (трансмиттеры). Потенциал действия, достигая нервного окончания, деполяризует его мембрану. Деполяризация вызывает открытие кальциевых каналов, по которым в окончание входит ток ионов Са2+. Ионы Са2+ вызывают процесс слияния везикул с пресинаптической мембраной с последующим открытием их и выбрасыванием своего содержимого в синаптическую щель. Для более полного описания процесса синаптической передачи рассмотрим холинергический синапс, в котором в качестве медиатора освобождается ацетилхолин (Ach) (рис. 1.5, 1.6). Синаптические везикулы фиксируются большей частью посредством протеина синапсина, который локализован на цитоплазматической поверхности каждой везикулы, к протеину спектрину, расположенному на волокнах F-актина цитоскелета, образуя тем самым трансмиттерный резервуар. Меньшая часть везикул связана специфическими протеинами с внутренней стороной пресинаптической мебраны. Это взаимодействие осуществляется посредством белка мембраны везикулы синаптобревина и белка пресинаптической мембраны синтаксина. Именно эти везикулы непосредственно поставляют медиатор для очередного выброса. 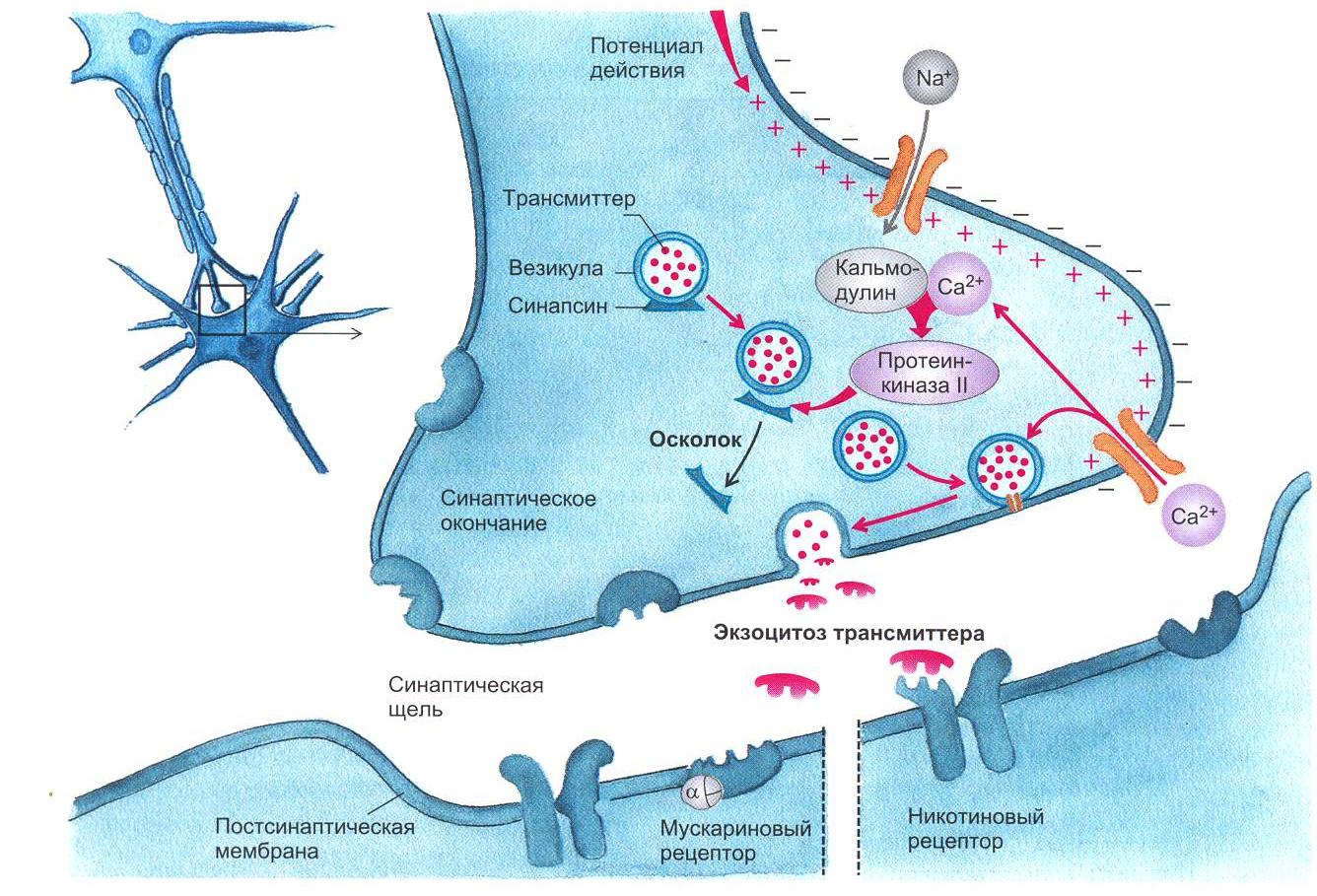 Рис. 1.5. Механизм освобождения трансмиттера из пресинаптического окончания. Потенциал действия, пришедший по аксону в пресинаптическую область, деполяризует мембрану. Открываются потенциалуправляемые Са+-каналы. Повышенная концентрация интратерминального Са+ открывает везикулы, лежащие на пресинаптической мембране клетки, что приводит к экзоцитозу их содержимого в синаптическую щель (рисунок взят из книги: Фундаментальная и клиническая физиология / под ред. А. Камкина и А. Каменского. М., 2004) 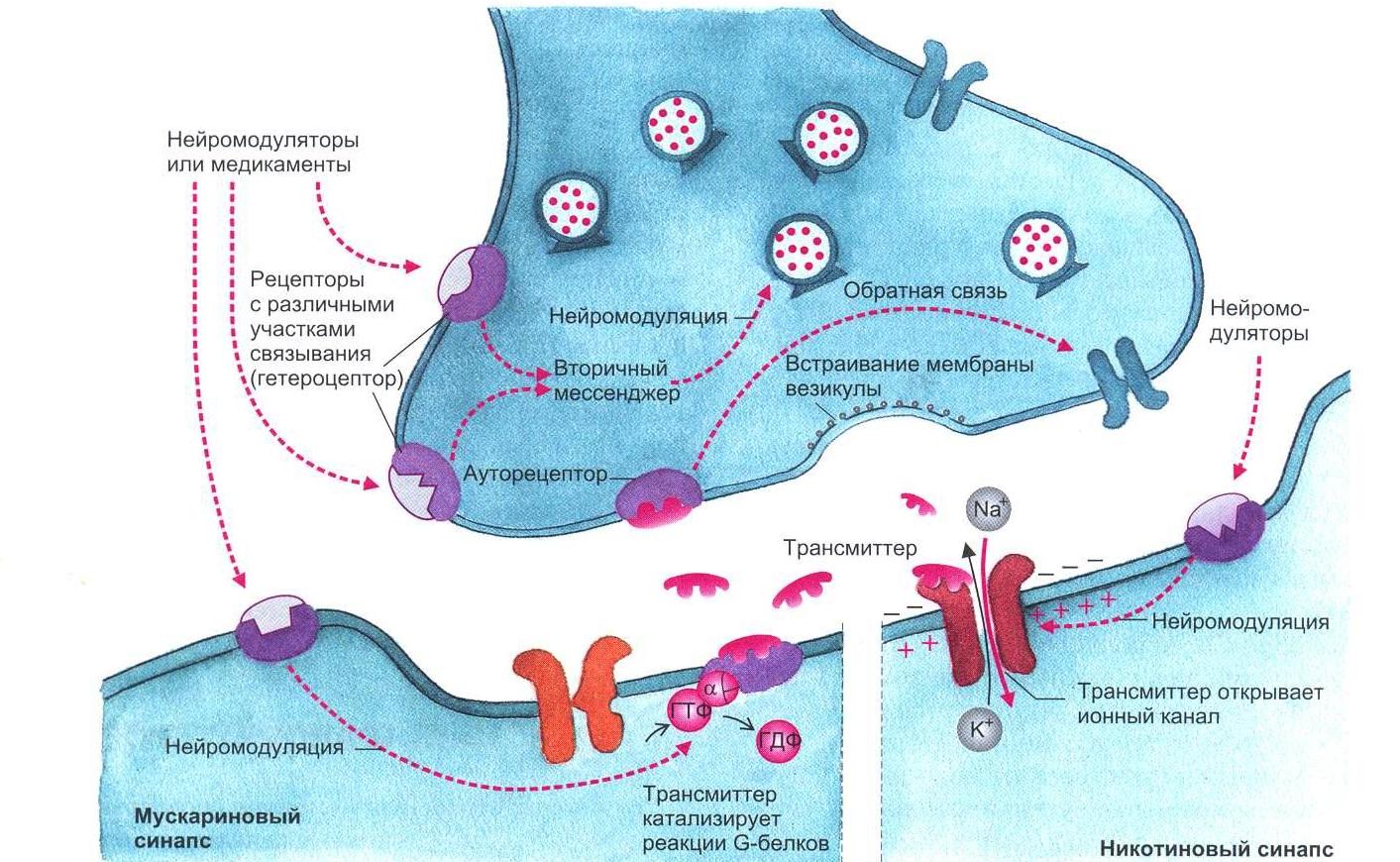 Рис. 1.6. Взаимодействие трансмиттерных молекул с их специфическими рецепторами. В правой части рисунка представлена постсинаптическая мембрана, имеющая никотиновый рецептор, ионный канал которого открывается сам при помощи лиганда; в левой части показана постсинаптическая мембрана, обладающая мускариновым рецептором. В этом случае ионный канал открывается только при помощи каскада химических реакций (рисунок взят из книги: Фундаментальная и клиническая физиология / под ред. А. Камкина и А. Каменского. М., 2004) Если потенциал действия достиг пресинаптической области и в пресинаптическом окончании концентрация Са2+ поднялась до необходимого уровня, то происходят следующие процессы. Са+2 связывается с протеином, входящим в состав мембран везикулов, – синаптотагмином. Это приводит к тому, что мембрана везикулы раскрывается. Одновременно комплекс полипептида синаптофизина сливается с неиндефицированными протеинами пресинаптической мембраны. При этом возникает пора, через которую осуществляется регулируемый экзоцитоз, т.е. выход трансмиттера в синаптическую щель. Протеин везикулы rab3A регулирует этот процесс. В одной везикуле сосредоточено примерно 6000-8000 молекул трансмиттера. Это наименьшее количество трансмиттера, освобожденного в синаптическую щель, называется «один квант трансмиттера». В совокупности локальная концентрация медиатора в синаптической щели после его освобождения относительно высока и находится в миллимолярном диапазоне. Повышенный уровень ионов Ca2+ в пресинаптическом окончании активирует Са2+-кальмодулинзависимую протеинкиназу П. В пресинаптическом окончании этот фермент фосфорилирует синапсин. После этого нагруженные трансмиттером везикулы освобождаются от цитоскелета и перемещаются на пресинаптическую мембрану для осуществления дальнейшего цикла, описанного выше. Главную роль для процесса выбрасывания медиатора в синаптическую щель играет входящий ток Са2+. Деполяризация окончания лишь открывает кальциевые каналы. Ионы Са2+ служат здесь в качестве вещества-посредника (вторичного мессенджера), которое запускает механизм слияния везикул с пресинаптической мембраной. Повышение концентрации экстрацеллюлярного Са2+ повышает входящий ток ионов Са2+, что увеличивает освобождение медиатора. Искусственное повышение концентрации экстрацеллюлярного Mg2+ посредством замещения им ионов Са2+ ведет к снижению входящего тока Са2+ и тем самым уменьшению освобождения трансмиттера. G-белки, вероятно, также участвуют в управлении везикулярным экзоцитозом. После прекращения пресинаптического потенциала действия ионы Са2+ удаляются из пресинаптической области посредством активного ионного транспорта с участием Са2+-АТФазы и 3Na+/Ca2+-обменника. Многоразовое сильное возбуждение пресинаптического нейрона ведет к увеличению концентрации ионов Са2+ и тем самым к повышению освобождения трансмиттера. Этот процесс называется синаптическим или посттетаническим потенцированием (после тетанического раздражения). Предполагают, что механизм посттетанического потенцирования лежит в основе памяти. Подобный процесс широко представлен в гиппокампе. Механизмы синаптического потенцирования повышают эффективность синапса. Входящим током ионов Са2+ можно управлять, влияя на Са2+-каналы. Они могут быть более или менее частыми, закрытыми или открытыми. Возможно фармакологическое воздействие на каналы. Например, конотоксин – яд улитки – блокирует каналы Са2+. Кроме того, ионы Mg2+, вытесняя ионы Са2+, уменьшают освобождение медиатора. Опорожнение везикул также может блокироваться посредством ядов. Так, ботулинический токсин при мясном отравлении действует на пресинаптическую мембрану, препятствуя скоплению везикул на ней за счет уменьшения необходимого для этого процесса протеина. Подобным образом действует тетанустоксин, который в переднем роге спинного мозга прекращает торможение мотонейрона клетки Реншоу, что приводит к судорогам. 2.4. Механизм действия медиаторов В постсинаптическую мембрану встроены протеины, которые образуют каналы для ионов (рис. 1.7). 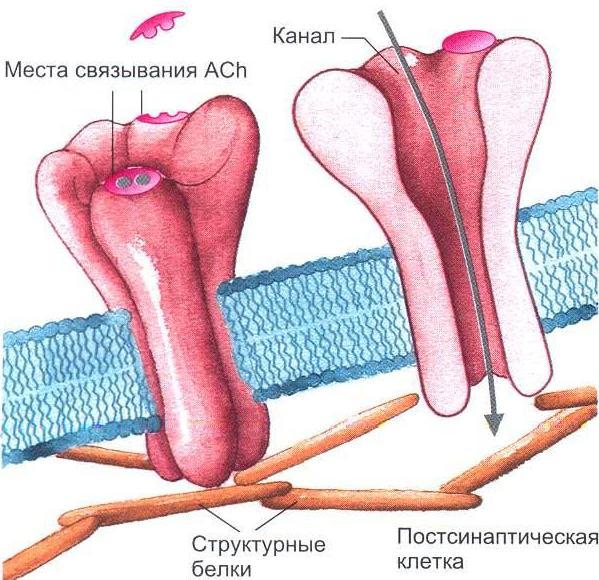 Рис. 1.7. Трехмерная модель никотиновых ацетилхолиновых рецепторов, плавающих в двойном липидном слое мембраны клетки. Протеин состоит из пяти субъединиц, из которых две идентичные имеют участки связывания с ацетилхолином. Если эти места заняты, открывается воронкообразный ионный канал (рисунок взят из книги: Фундаментальная и клиническая физиология / под ред. А. Камкина и А. Каменского. М., 2004) Открытие каналов определяется конформационными изменениями этих протеинов. Конформация протеинов зависит от связывания протеинов с молекулами трансмиттера. В постсинаптической мембране выделяют субсинаптическую зону, которая иначе называется активной зоной синапса, где находятся протеины, связывающиеся с медиатором. Их называют рецепторами. У холинергических синапсов есть два типа рецепторов – чувствительные к никотину (никотиновый Ach-рецептор) и к мускарину (мускариновый Ach-рецептор). На примере холинергического синапса с участием nACh-рецептора рассмотрим ацетилхолиновую передачу, например, в мионевральном синапсе. Рецепторный протеин для Ach состоит из пяти субъединиц, которые вместе образуют канал, пронизывающий клеточную мембрану. Каждый из таких каналов может находиться в двух состояниях – открытом или закрытом. В открытом состоянии каналы проницаемы для строго определенных ионов. Большую часть времени этот канал закрыт. Но если две молекулы Ach связываются с белком канала, то заряд внутри макромолекулы сдвигается и, как следствие, происходит аллостерическое изменение его формы. Центральный канал расширяется, его внутренний диаметр становится приблизительно равным 0,65 нм. Благодаря этому он становится проходимым для катионов Na+ и K+. Для анионов канал остается непроходимым из-за имеющихся на внутренней стенке зарядов. Рассмотренный тип рецептора называют ионотропным. Канал, который открывается при связывании трансмиттера-лиганда, – это канал, управляемый лигандами. На постсинаптической мембране есть и другой тип рецепторов. Это рецепторы, в которых открытие ионного канала связано с подключением других химических процессов. Такие рецепторы называются метаботропными. Примером может служить холинергический синапс мускаринового типа (рис. 1.8). В нормальном состоянии рецепторы для медиаторов находятся только в области субсинаптической мембраны. Это относится также и к нервно-мышечному синапсу. Однако крайне небольшое количество Ach-ре- цепторов встречается и на поверхности мышечного волокна. Но при повреждении двигательного нерва Ach-рецепторы образуются на всей поверхности мышечного волокна; мышца становится гиперчувствительной к ацетилхолину. Во многих синапсах рецепторы для медиатора находятся не только в постсинаптической, но и в пресинаптической мембране. Это так называемые ауторецепторы, например α2- и β2-рецепторы. При взаимодействии с ними медиатора его освобождение либо усиливается, либо прекращается в зависимости от типа синапса. На ауторецепторы может оказывать влияние также входящий ток Са+2 в пресинаптическом окончании. 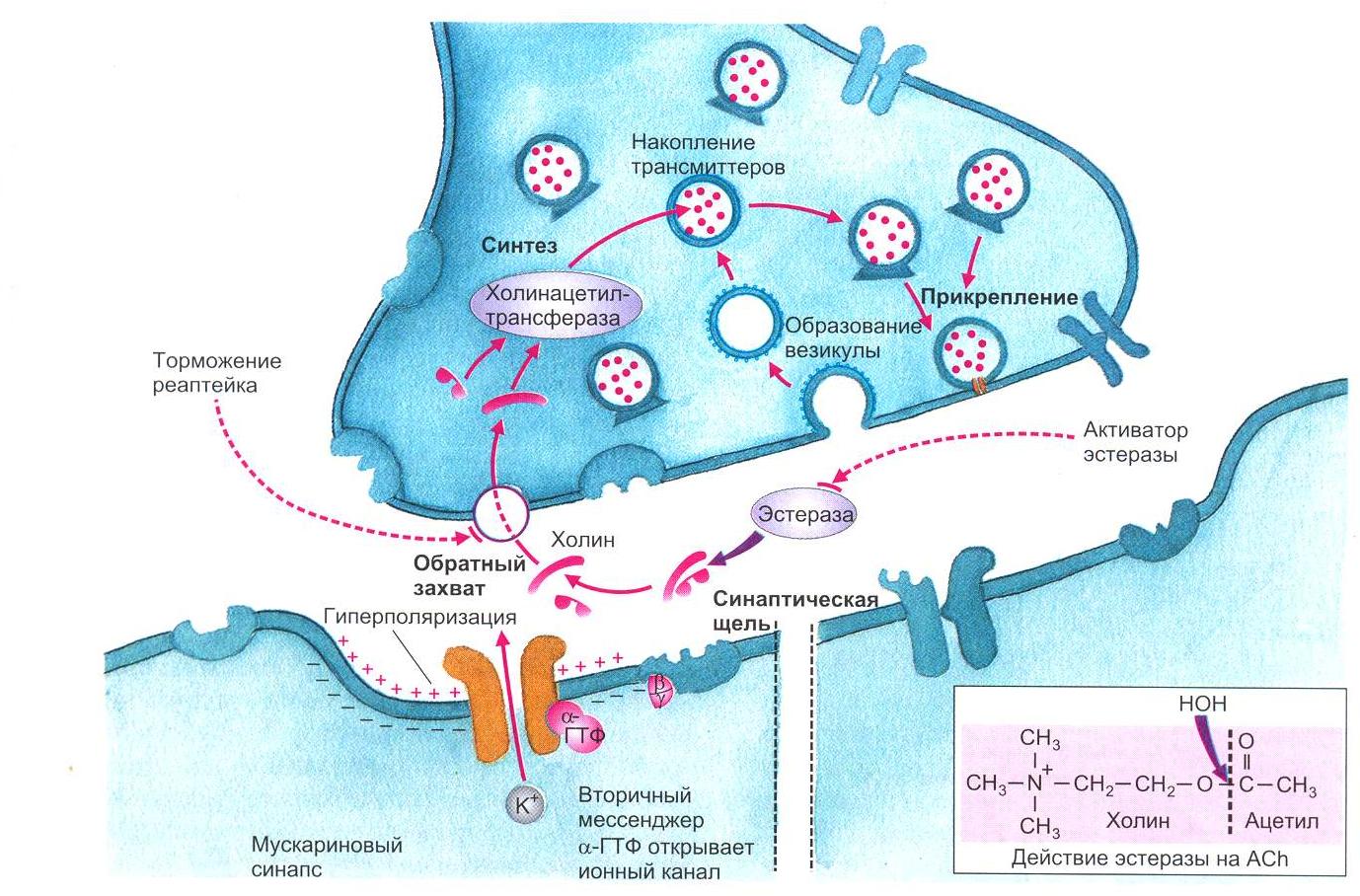 Рис. 1.8. Поздние процессы на синапсах. Вторичные мессенджеры открывают ионные каналы в cинапсах, рецептор которых сам собой не представляет ионный канал. В данном случае мускаринового синапса это субъединица G-белка, связанная с ГТФ (рисунок взят из книги: Фундаментальная и клиническая физиология / под ред. А. Камкина и А. Каменского. М., 2004) |
