Г. В. Плеханова (технический университет) к афедра общей и физической химии общая химия Сборник задач
 Скачать 2.09 Mb. Скачать 2.09 Mb.
|
2.1. Примеры решения задачПример 1. Составить электронную формулу атома брома и графическую схему заполнения электронами валентных орбиталей в нормальном и возбужденном состояниях. Решение. 1. Порядковый номер брома – 35, следовательно атом серы имеет 35 электронов. Бром находится в четвертом периоде периодической системы, следовательно, АО с n = 1, 2 и 3 заполнены полностью. Бром относится к p-элементам, следовательно, заполнен 4s-подуровень. В ряду 4p-элементов бром – пятый элемент, следовательно, на 4p-подуровне – 5 электронов. Таким образом, электронная формула брома 1s22s22p63s23p44s23d104p5. 2. Валентными орбиталями в этом атоме являются орбитали внешнего (четвертого) электронного слоя, т. е. 4s-, 4p- и незаполненные 4d-орбитали. Графически схема заполнения электронами этих орбиталей имеет следующий вид: 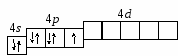 в таком состоянии бром имеет валентность 1, которой соответствуют степени окисления 1, +1. 3. При затрате некоторой энергии спаренный p-электрон перейдет на свободную d-орбиталь – первое возбужденное состояние брома: Br*:  в таком состоянии бром имеет валентность 3, которой соответствует степень окисления +3. 4. При передаче атому брома еще некоторого количества энергии следующий p-электрон также перейдет на свободную d-орбиталь – второе возбужденное состояние брома: Br**: 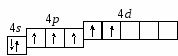 в таком состоянии бром имеет валентность 5, которой соответствует степень окисления +5. 5. При передаче атому брома еще некоторого количества энергии s-электрон также перейдет на свободную d-орбиталь – третье возбужденное состояние брома: Br**:  в таком состоянии бром имеет валентность 7, которой соответствует степень окисления +7. Пример 2. Составить электронные формулы атома селена в состояниях Se2 и Se+4 и графические схемы заполнения электронами валентных орбиталей. Решение. 1. Cоставим электронную формулу атома селена (см. пример 1) 1s22s22p63s23p64s23d104p4 и графическую схему заполнения электронами валентных орбиталей 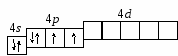 2. Для получения Se2 необходимо к атому селена добавить два электрона на 4p-орбиталь (согласно правилу Клечковского):  Электронная формула Se2: 1s22s22p63s23p64s23d104p6. 3. Для получения Se+4 необходимо от атома селена убрать четыре электрона с 4p-орбитали: 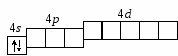 Электронная формула Se+4: 1s22s22p63s23p64s23d104p0. Пример 3. Составить полную электронную формулу элемента, валентные электроны которого имеют конфигурацию 3d6, определить, к какому периоду таблицы Д. И. Менделеева принадлежит данный элемент. Решение. Согласно правилу Клечковского 3d-элементы находятся в четвертом периоде таблицы Д.И. Менделеева. На данной орбитали находится 6 электронов, значит это шестой по счету среди 3d-элементов, т. е. железо. Полная электронная формула которого 1s22s22p63s23p64s23d6. 2.2. Задачи для решенияI. Составить электронные формулы элементов, графические схемы заполнения электронами валентных орбиталей в спокойном и возбужденном состояниях, указать, к какому типу эти элементы относятся.
II. Составить электронные формулы атомов в указанных состояниях и графические схемы заполнения электронами валентных орбиталей.
III. Исходя из состояния валентных электронов, составить электронную формулу элемента в нулевой степени окисления. Определить, к какому периоду таблицы Д. И. Менделеева принадлежит данный элемент.
|
