Г. В. Плеханова (технический университет) к афедра общей и физической химии общая химия Сборник задач
 Скачать 2.09 Mb. Скачать 2.09 Mb.
|
5.3. Водородный показательДля характеристики кислотно-основных свойств растворов используют водородный показатель рН, равный отрицательному значению десятичного логарифма концентрации ионов водорода. Аналогично рассчитывают гидроксильный показатель рОН, равный отрицательному значению десятичного логарифма концентрации ионов гидроксила.
Концентрации ионов водорода и гидроксила связаны между собой равновесием диссоциации воды: Н2О Н+ + ОН. Константу равновесия называют ионным произведением воды. При 298 К она равна 1014.
Логарифмированием уравнения (51) получаем:
В чистой воде (нейтральная среда) рН = рОН = 7. В кислой среде рН 7, в щелочной среде рН 7. 5.3.1. Расчет рН в растворах сильных кислот и основанийДля сильных кислот и щелочей, полностью диссоциированных на ионы,
где Ск и Сщ моляльные концентрации кислоты и, соответственно, щелочи, z основность кислоты или кислотность основания. Разбавление раствора сильного электролита учитывают по уравнениям:
где индекс 1 относится к исходному раствору (до разбавления), индекс 2 – к конечному раствору (после разбавления). В среде, близкой к нейтральной, необходимо принять во внимание диссоциацию воды, в результате которой образуются ионы Н+ и ОН.
При смешивании растворов сильных кислот и оснований возможны два варианта. 1. рН17 и рН27 или рН27 и рН27, то есть смешивают два кислых или два щелочных раствора:
2. рН17, а рН27, то есть смешивают кислый и щелочной растворы. В этом случае конечную концентрацию раствора рассчитывают по веществу, взятому в избытке.
|

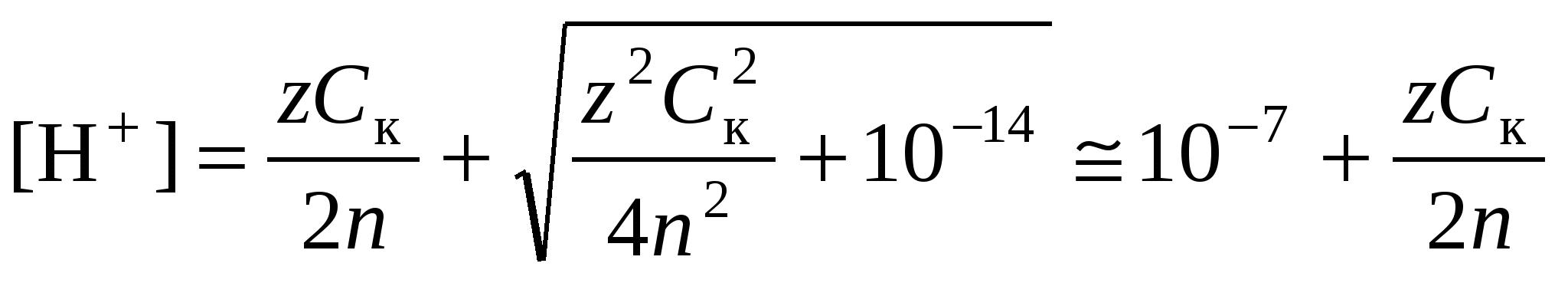 .
.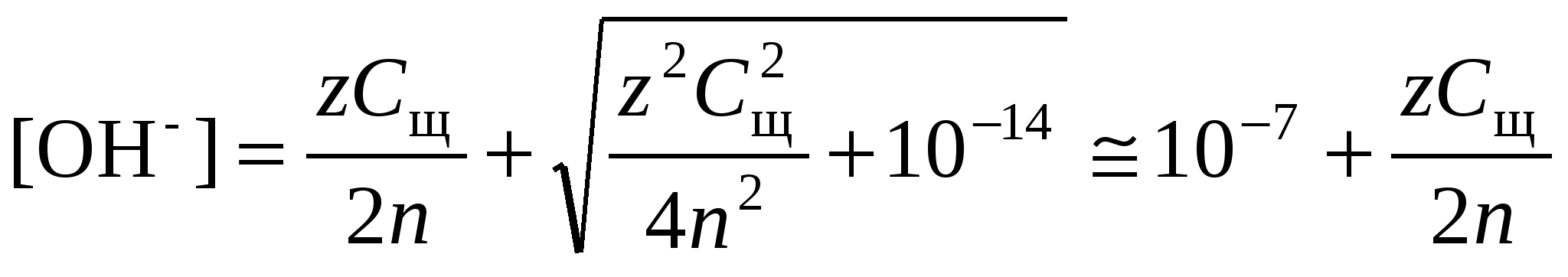 .
.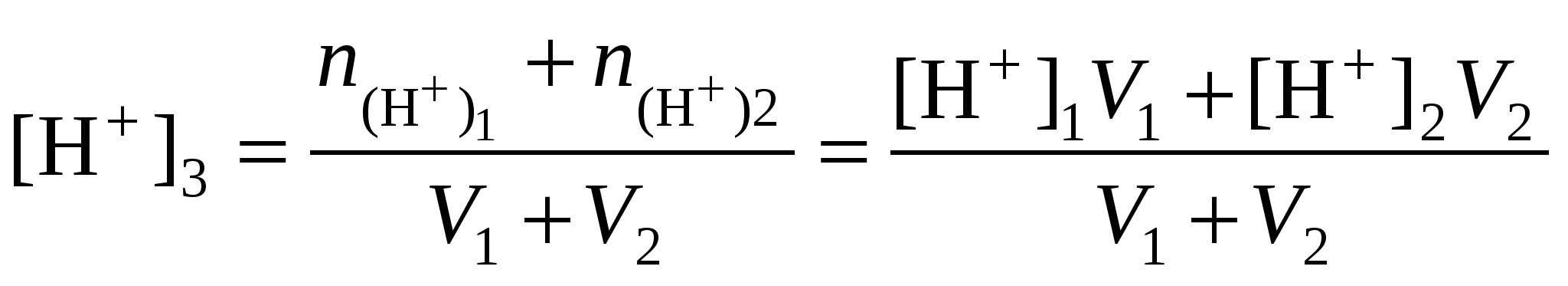 ,
,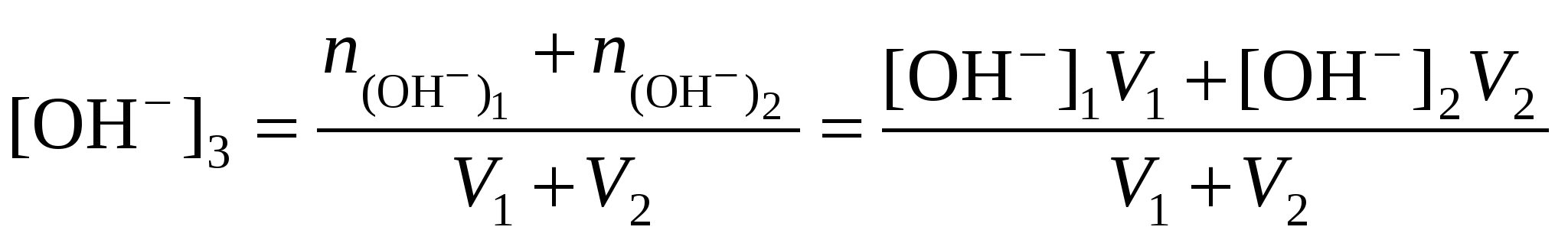 .
.