Г. В. Плеханова (технический университет) к афедра общей и физической химии общая химия Сборник задач
 Скачать 2.09 Mb. Скачать 2.09 Mb.
|
5.3.2. Расчет рН в растворах слабых кислот и основанийДиссоциация многих электролитов протекает не полностью. Отношение числа диссоциированных молей к общему числу молей электролита в растворе называют степенью диссоциации. Для его количественного описания используют константу равновесия, называемую константой диссоциации. Для одноосновной кислоты, диссоциирующей по уравнению:
Т.к. [An–] = [H+] и [An] = C то
где С – концентрация слабой кислоты, моль/л Kd – константа диссоциации (приводится в справочниках). Для растворов слабых оснований:
где С - концентрация слабого основания, моль/л. По значению константы диссоциации можно рассчитать степень диссоциации слабого электролита:
Многоосновные кислоты диссоциируют ступенчато, например: Н2S НS + Н+ (1-ая ступень); НS S + Н+ (2-ая ступень). При расчетах рН обычно учитывают только первую ступень диссоциации, пренебрегая второй и третьей ступенями. Таким образом, уравнения (62 и 64) справедливы и для многоосновных кислот при использовании первой константы диссоциации Kd1. 5.3.3. Примеры решения задачПример 1. Вычислить рН раствора серной кислоты концентрацией 0,3 % (d = 1,0 г/см3). Решение. 1. Перейдем к моляльной концентрации серной кислоты. Для этого выделим мысленно 100 г раствора, тогда масса серной кислоты составит 0,3 г, а масса воды – 99,7 г. По уравнению (37) вычислим моляльную концентрацию: 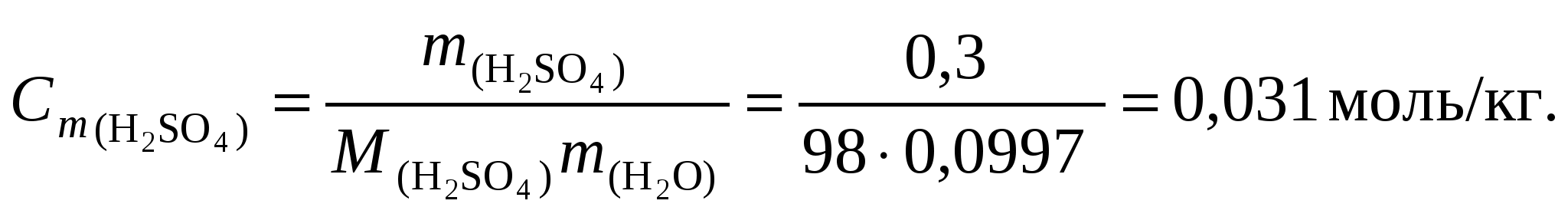 2. По уравнению диссоциации H2SO4 2H+ + SO42 из 1 моль серной кислоты образуется 2 моль H+, следовательно, 3. По уравнению (50) вычислим значение рН: рН = -lg[H+] = –lg0,062 = 1,21. Пример 2. Вычислить рН раствора гидроксида бария концентрацией 0,0068 экв/л. Решение. 1. По уравнению диссоциации Ba(OH)2 Ba2+ + 2 OH из 1 моль гидроксида бария образуется 2 моль гидроксил-ионов: 3. По уравнению (50) найдем значение рОН: рOН = -lg[OH] = -lg0,0068 = 2,17 и вычислим рН: рН = 14 рОН = 14 – 2,17 = 11,83. Пример 3. Определить значение рН при разбавлении раствора одноосновной кислоты с рН = 5,5 в 100 раз. Решение. По уравнению (56) найдем концентрацию ионов водорода в конечном растворе [H+]2: Пример 4. Определить значение рН при смешении 10 л раствора с рН = 2 и 17 л раствора с рН = 4. Решение. По уравнению (58) найдем концентрацию ионов водорода в конечном растворе [H+]3 и вычислим рН3: рН3 = -lg[H+]3 = -lg(4,6103) = 2,33. Пример 5. Смешали 250 мл раствора (V1) с рН = 3 и 300 мл раствора (V2) гидроксида калия концентрацией 0,001 моль/л. Определить рН полученной смеси. Решение. 1. Найдем число молей OH: Согласно уравнению диссоциации: KOH K+ + OH, 2. Найдем число молей H+: 3. Очевидно, что в избытке находятся гидроксил-ионы. Их остаточную концентрацию в полученном растворе найдем по уравнению: 4. Вычислим рН3 по уравнению: рН3 = 14 + lg[OH]3 = 14 + lg(9,1105) = 9,96. Пример 6. Найти рН раствора борной кислоты с мольной долей 0,0025 (dр-р = 1,0 г/см3). Решение. 1. выделим мысленно 1 кг раствора. где индекс 1 относится к растворителю (т.е. к воде), а индекс 2 – к растворенному веществу, т. е. к H3BO3. M1 = 18 г/моль, М2 = 61,8 г/моль. 2. Так как плотность раствора равна 1 г/см3, то его объем соответствует 1 л и молярная концентрация численно равна количеству вещества борной кислоты, т. е. СМ(Н3ВО3) = 0,138 моль/л. 3. Диссоциация борной кислоты по первой ступени протекает по реакции: H3BO3 H+ + H2BO3, для которой константа диссоциации Kd1 = 7,11010. Второй и третьей ступенями диссоциации борной кислоты пренебрегаем. 4. рН раствора борной кислоты вычисляем в соответствии с уравнением (63): рН = -lg[H+] = -lg(9,9106) = 5. Пример 7. Сколько граммов бутиламина содержится в 1 л его раствора, имеющего рН=11,5? Решение. 1. Гидрат бутиламина диссоциирует как основание по уравнению: C4H9NH2H2O C4H9NH3+ + OH. Константа диссоциации: Kd = 4,57104, pKd = 3,340. 2. рОН = 14 - рН = 2,5. 3. Из формулы (64) находим молярную концентрацию бутиламина lgCМ = pKd – 2pOH = 3,34 - 22,5 = -1,66; CМ = 101,66 = 0,022 моль/л и массу бутиламина, содержащуюся в 1 л раствора: Сг/л = CМM, где М – молярная масса бутиламина 73 г/моль. Получаем Сг/л =0,02273 = 1,6 г/л. |
