Г. В. Плеханова (технический университет) к афедра общей и физической химии общая химия Сборник задач
 Скачать 2.09 Mb. Скачать 2.09 Mb.
|
5.2. Коллигативные свойства растворовСвойства растворов (температура замерзания и кипения, давление насыщенного пара, осмотическое давление) находятся в зависимости от природы растворителя и концентрации раствора и называются коллигативными свойствами, т.к. не зависят от природы растворенного вещества. 5.2.1. закон РауляИз закона Рауля “относительное понижение давления насыщенного пара растворителя над раствором равно молярной доле растворенного вещества в растворе” следует, что понижение парциального равновесного давления насыщенного пара растворителя над раствором является линейной функцией мольной доли растворенного вещества в растворе:
где 5.2.2. Изменение температур фазовых переходов растворовПовышение температуры кипения кипТ:
где Изменение температуры кристаллизации крТ:
где 5.2.3. Осмотическое давлениеПроцесс самопроизвольного перехода растворителя в раствор через полупроницаемую мембрану называется осмосом. Давление , которое нужно приложить к раствору, чтобы осмос прекратился, называется осмотическим давлением.
где Для электролитов необходим поправочный множитель i, названный изотоническим коэффициентом:
Изотонический коэффициент – показатель увеличения (уменьшения) числа частиц вследствие диссоциации (ассоциации). Значение i >1 свидетельствует о наличии процесса диссоциации, а i < 1 – о процессе ассоциации. Численное значение изотонического коэффициента позволяет для случая диссоциации вычислить степень диссоциации:
где z – число частиц, получающихся из одной частицы при диссоциации; z’ – число частиц, объединяющихся в одну при ассоциации. |

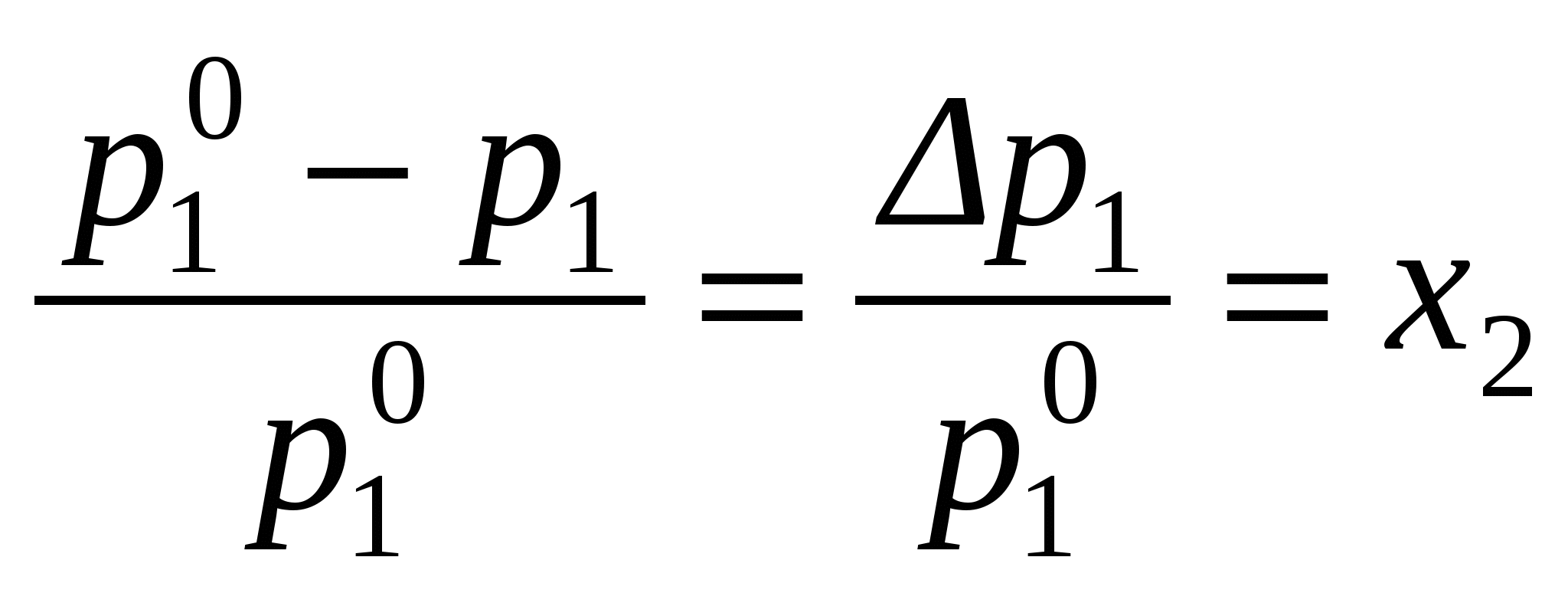 (при n2 <<n1),
(при n2 <<n1),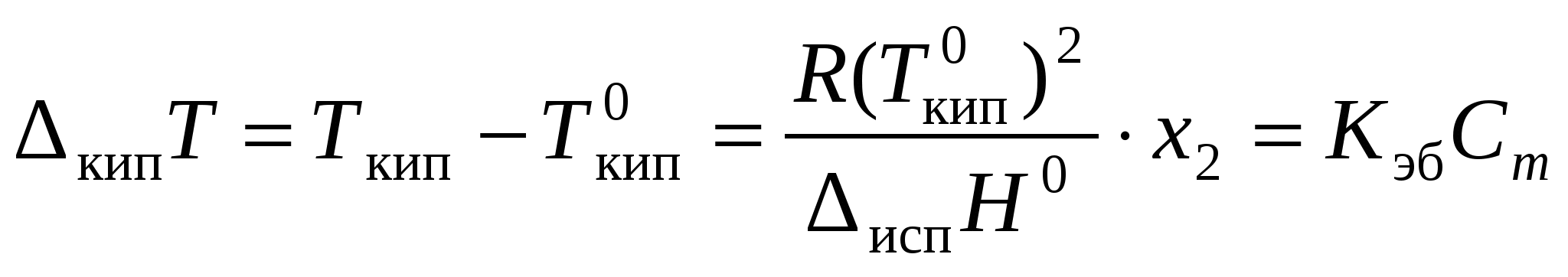 ,
,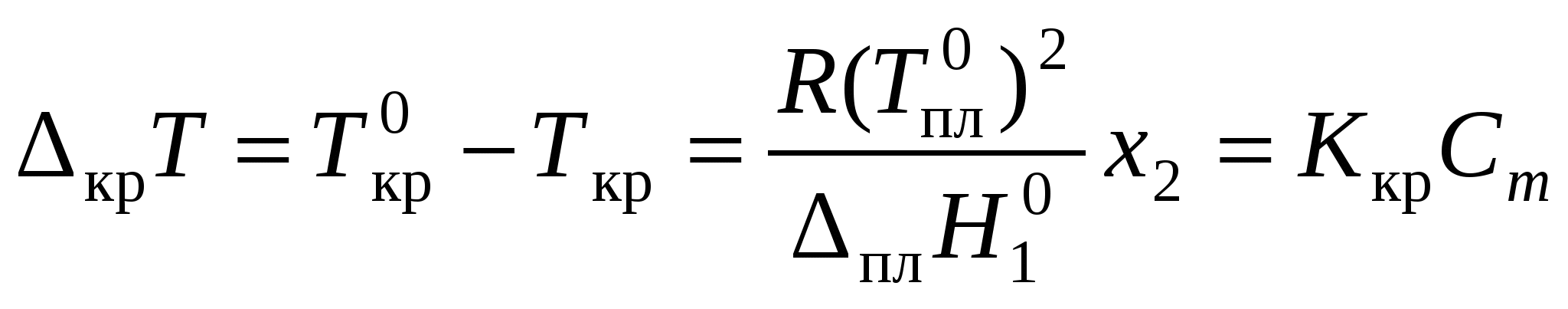 ,
,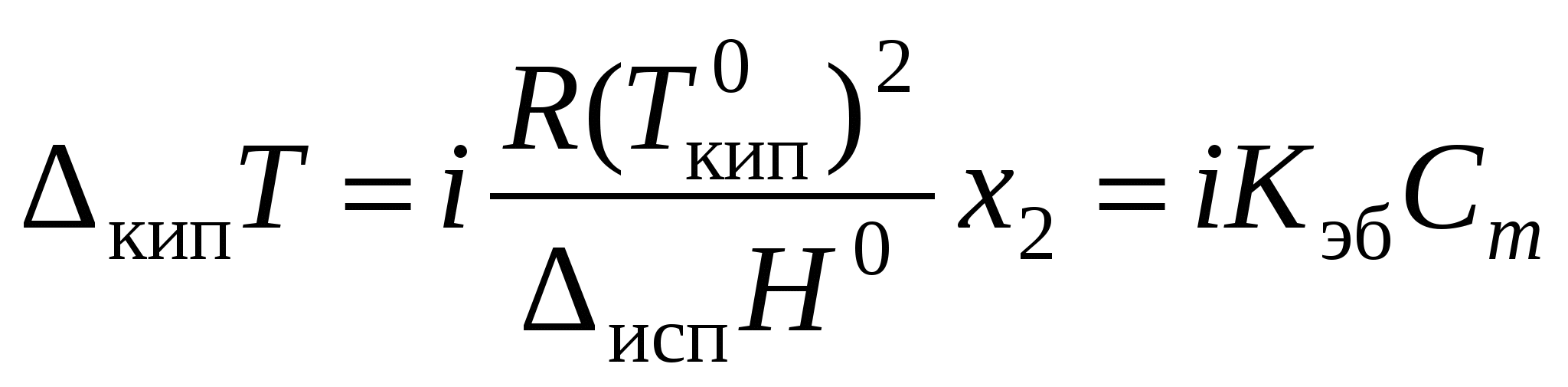 ;
;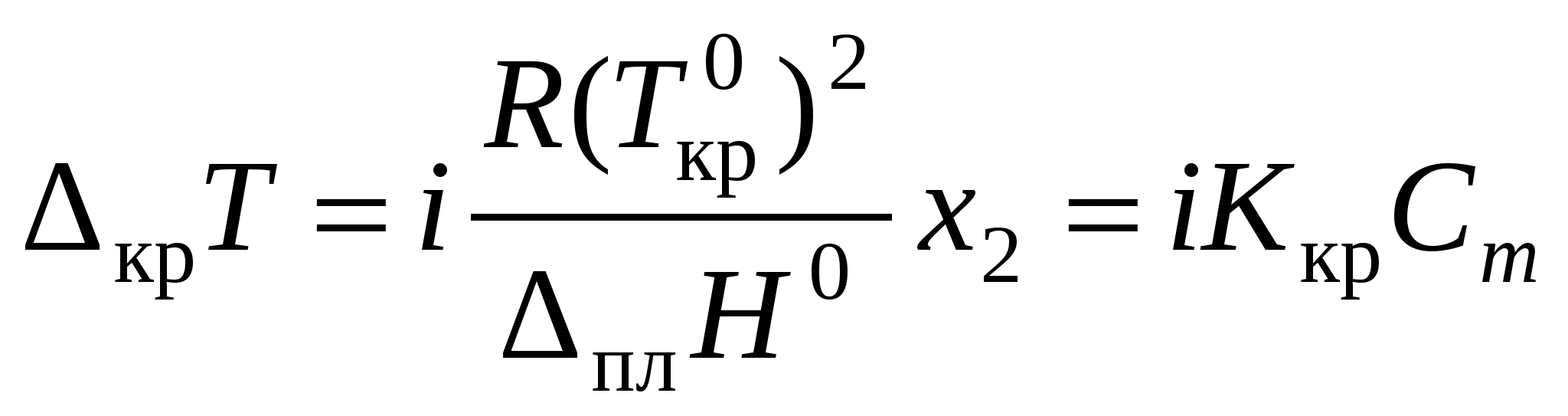 ;
;