Пример 1. Рассчитать растворимость флюорита CaF2 в воде, в 0,1 моль/л растворе NaF.
Решение. 1. Запишем уравнение диссоциации CaF2, отвечающее равновесному растворению флюорита:
CaF2(т) Сa2+(p-p) + 2F(p-p),
согласно которому Ca2+ = S; F = 2S.
2. Составим уравнение произведения растворимости CaF2: L = Ca2+F2 = S(2S)2 = 4S3, из которого вычислим растворимость флюорита в воде:
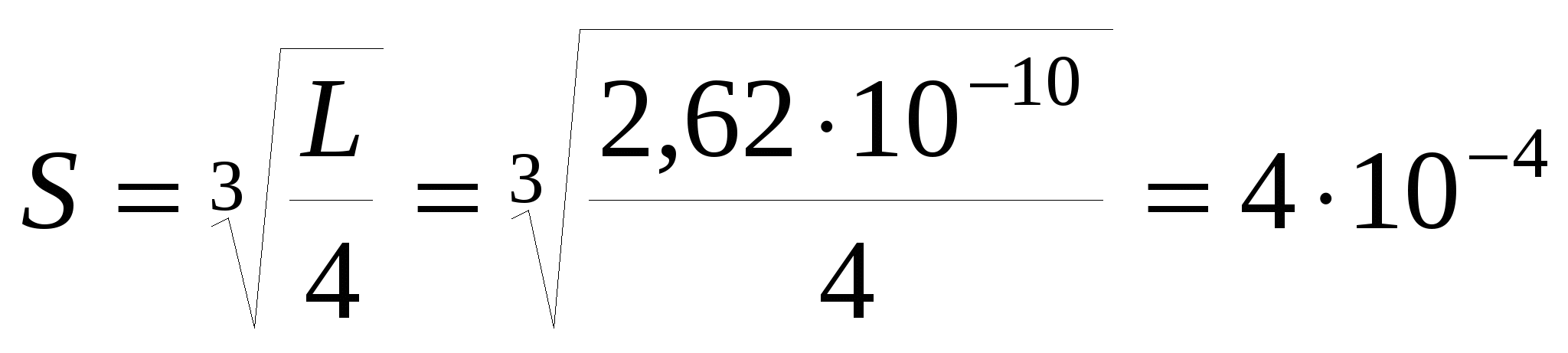 моль/л. моль/л.
3. Для расчета растворимости в 0,1 М растворе NaF, которую обозначим S1, произведем следующие подстановки в уравнение произведения растворимости: L = Ca2+F2;
Ca2+ = S1; F = 2S1 + CNaF = 0,1 моль/л, так как S1 0,1.
Получаем: L = S1(0,1)2, откуда
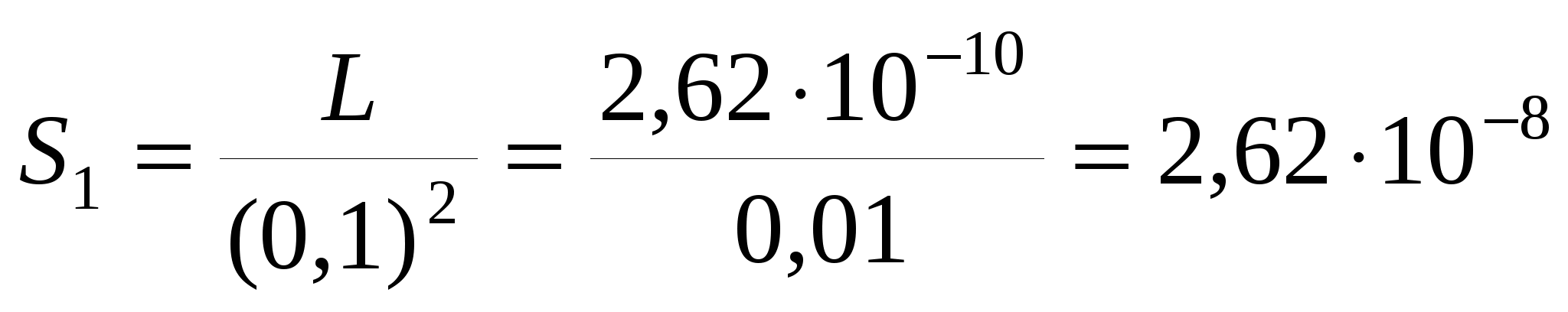 моль/л. моль/л.
Пример 2. Вычислить рН гидратообразования для раствора сульфата никеля с концентрацией 0,01 моль/л (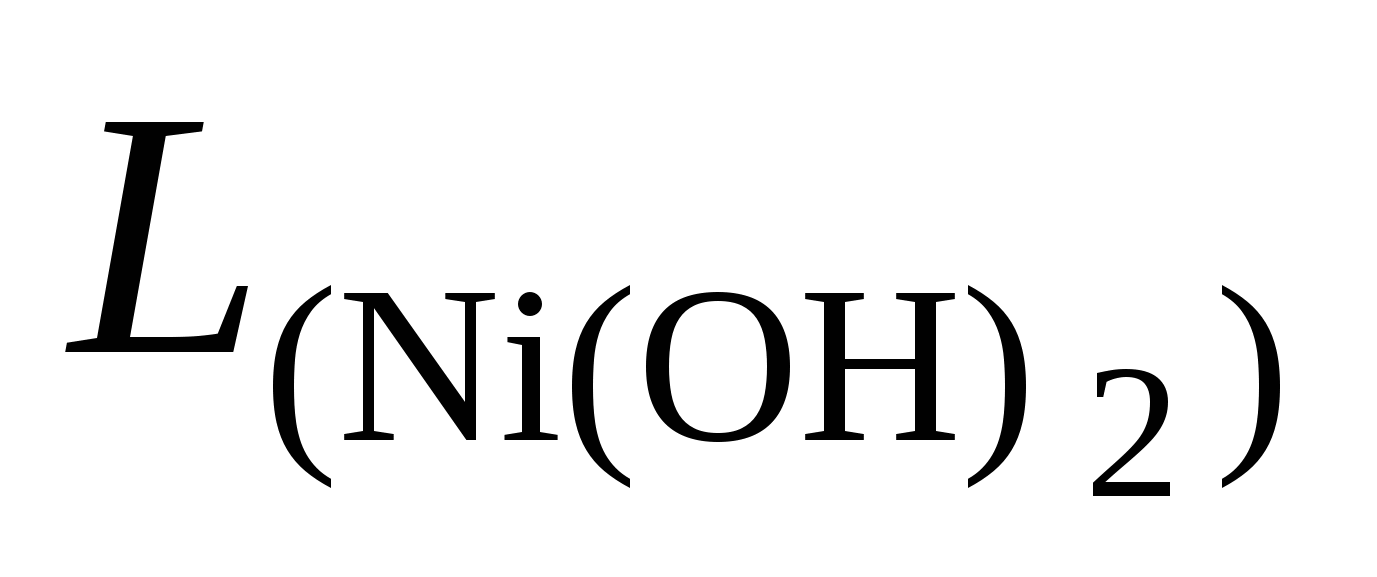 = 1,21016). = 1,21016).
Решение. 1. Осадок гидроксида образуется из раствора NiSO4 в результате установления следующего равновесия:
Ni(OH)2 Ni2+ + 2OH.
2. Гидратообразование начинается при условии:
Ni2+OH2 = L, откуда
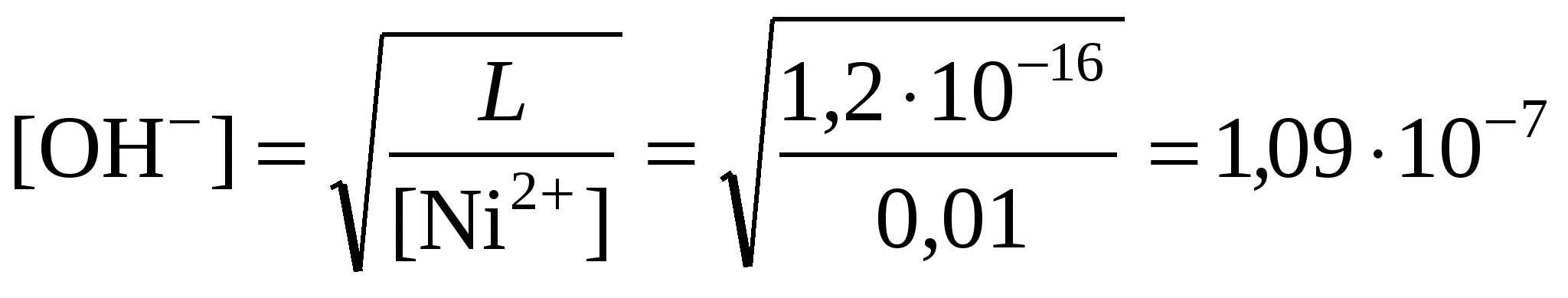
рОН = lg[OH] = lg1,09107 = 6,96; рH = 14 - рОН = 7,04.
Пример 3. Произойдет ли осаждение малорастворимого AgNO2 (L = 1,6104) по реакции AgNO3 + KNO2 AgNO2 + KNO3 при смешивании равных объемов 0,02 М растворов AgNO3 и KNO2?
Решение. 1. Для образования осадка AgNO2 должно выполняться условие [Ag+][NO2] ≥ L. Проверим, выполняется ли это условие в нашей задаче.
2. После смешивания равных объемов растворов AgNO3 и KNO2 общий объем раствора будет в два раза больше каждого из исходных, и концентрации AgNO3 и KNO2 соответственно уменьшатся в два раза, т. е. будут равны 0,01 моль/л. [Ag+][NO2] = 0,010,01 = 1104 > L, следовательно, осадок образуется.
I. Вычислить растворимость предложенного соединения при температуре 25°С в воде и в присутствии электролита с одноименным ионом
№ задачи
|
Твердая фаза
|
Электролит
|
Концентрация р-ра
|
|
AgBr
|
AgNO3
|
0,01 г/л
|
|
Ag2SO4
|
K2SO4
|
0,01 М
|
|
PbI2
|
KI
|
0,05 н.
|
|
CaCO3
|
Na2CO3
|
0,005 н.
|
|
BaCrO4
|
K2CrO4
|
0,001 М
|
|
BaSO4
|
BaCl2
|
0,001 г/л
|
|
Ag2CO3
|
Na2CO3
|
0,1 %
|
|
CaSO4
|
K2SO4
|
0,02 %
|
|
PbBr2
|
KBr
|
0,003 н.
|
|
PbSO4
|
Pb(NO3)2
|
0,005 М.
|
|
ZnS
|
ZnCl2
|
0,09 г/л
|
|
Hg2SO4
|
Na2SO4
|
0,001 г/л
|
|
PbCO3
|
K2CO3
|
0,02 г/л
|
|
BaSO3
|
Na2SO3
|
0,028 М
|
|
AgIO3
|
KIO3
|
0,009 н.
|
|
CaHPO4
|
CaCl2
|
0,01 г/л
|
|
CuI
|
KI
|
0,01 М
|
|
TlI
|
NaI
|
0,05 н.
|
|
Hg2I2
|
Hg2(NO3)2
|
0,005 н.
|
|
Ag2S
|
AgNO3
|
0,001 М
|
|
TlBr
|
NaBr
|
0,001 г/л
|
|
BaSO3
|
Na2SO3
|
0,003 н.
|
|
Ag3PO4
|
AgNO3
|
0,005 М.
|
|
PbS
|
Pb(NO3)2
|
0,09 г/л
|
|
CaF2
|
NaF
|
0,001 г/л
|
|
LaF3
|
NaF
|
0,02 г/л
|
|
Ca3(PO4)2
|
CaCl2
|
0,028 М
|
|
Na3AlF6
|
NaCl
|
0,1 %
|
|
AgBrO3
|
NaBrO3
|
0,02 %
|
|
AgCl
|
KCl
|
0,003 н.
|
|
AgI
|
KI
|
0,005 М.
|
|
Ag2CrO4
|
AgNO3
|
0,09 г/л
|
|
CdCO3
|
Cd(NO3)2
|
0,001 г/л
|
|
CuCl
|
KCl
|
0,02 г/л
|
|
Hg2Br2
|
KBr
|
0,028 М
|
|
Hg2Cl2
|
KCl
|
0,009 н.
|
№ задачи
|
Твердая фаза
|
Электролит
|
Концентрация р-ра
|
|
PbCl2
|
KCl
|
0,01 г/л
|
|
TlCl
|
KCl
|
0,01 М
|
|
Ba3(AsO4)2
|
Ba(NO3)2
|
0,05 н.
|
|
Ba3(PO4)2
|
K3PO4
|
0,005 н.
|
|
Bi2(C2O4)3
|
Bi(NO3)3
|
0,001 М
|
|
Li3PO4
|
K3PO4
|
0,001 г/л
|
|
In4[Fe(CN)6]3
|
K4[Fe(CN)6]
|
0,003 н.
|
|
NaBeF6
|
NaNO3
|
0,01 г/л
|
|
K2SiF6
|
KNO3
|
0,01 М
|
|
Hg2CrO4
|
Hg2(NO3)2
|
0,05 н.
|
|
SnS
|
Na2S
|
0,0005 н.
|
|
Pb3(PO4)2
|
K3PO4
|
0,01 М
|
|
Tl2S
|
Na2S
|
0,0005 н.
|
|
Zn3(AsO4)2
|
ZnSO4
|
0,009 н.
|
II. Определить рН гидратообразования:
№
задачи
|
Соль
|
Концентрация соли, моль/л
|
№
задачи
|
Соль
|
Концентрация соли, моль/л
|
|
AlCl3
|
0,01
|
|
MgCl2
|
0,38
|
|
Be(NO3)2
|
0,52
|
|
MnSO4
|
0,062
|
|
Bi(NO3)3
|
0,046
|
|
NiCl2
|
0,031
|
|
CaCl2
|
0,023
|
|
Pb(NO3)2
|
0,004
|
|
CdCl2
|
0,15
|
|
Sb(NO3)3
|
0,002
|
|
CoSO4
|
0,006
|
|
Sc(NO3)3
|
0,001
|
|
Cr2(SO4)3
|
0,059
|
|
SnCl2
|
0,012
|
|
Cu(NO3)2
|
0,038
|
|
SnCl4
|
0,003
|
|
FeSO4
|
0,064
|
|
Sr(NO3)2
|
0,055
|
|
FeCl3
|
0,26
|
|
Tl(NO3)3
|
0,001
|
|
LaCl3
|
0,008
|
|
Y(NO3)3
|
0,0012
|
|
ZrOCl2
|
0,056
|
|
ZnSO4
|
0,022
|
Определить концентрацию карбоната натрия, необходимую для того, чтобы снизить растворимость карбоната серебра в 100 раз по сравнению с растворимостью в воде.
Чему равно произведение растворимости и растворимость иодида серебра в воде, если концентрация иодида серебра в 0,001 н. растворе иодида калия равна 1,510-13 моль/л?
Во сколько раз меньше растворимость гидроксида кобальта (II) в растворе с рН=12, чем в растворе с рН=10.
Какое из оснований – гидроксид железа (II) или гидроксид железа (III) – и во сколько раз лучше растворимо в щелочном растворе с рН=9?
Определить растворимость и произведение растворимости гидроксида кальция, если его насыщенный раствор имеет рН=12,4.
Определить растворимость гидроксида никеля в воде и в растворе с рН=1.
При каком значении рН растворимость гидроксида кадмия снизится в 20 раз по сравнению с растворимостью в воде.
Определить произведение растворимости и растворимость в воде сульфата кальция, если концентрация соли в 0,2 н. растворе серной кислоты составляет 6105 моль/л.
Определить произведение растворимости и растворимость сульфата свинца в воде, если концентрация соли в 0,004 н. растворе серной кислоты равна 810-6 моль/л.
Во сколько раз растворимость хлорида серебра в 0,001 н. растворе хлорида натрия меньше, чем в воде?
Определить растворимость гидроксида кобальта (II) в воде и в 0,1 н. растворе сульфата кобальта.
Определить растворимость гидроксида железа (II) в воде и в 0,05 М растворе сульфата железа (II).
Смешаны равные объемы 0,02 н. растворов хлорида кальция и сульфата натрия. Образуется ли при этом осадок сульфата кальция?
Во сколько раз растворимость оксалата кальция Са2С2О4 в 0,1 М растворе оксалата аммония меньше, чем в воде?
Во сколько раз уменьшится концентрация ионов серебра в насыщенном растворе хлорида серебра, если прибавить к нему столько соляной кислоты, чтобы концентрация хлорид ионов в растворе стала равной 0,03 моль/л?
Растворимость бромида таллия (I) в воде равна 1,910-3 моль/л. определить его произведение растворимости и растворимость в 0,1 н. растворе нитрата таллия (I).
Растворимость карбоната кальция в воде составляет 4,1510-6 моль/л. Определить его произведение растворимости и растворимость в 0,001 М растворе карбоната натрия.
К 150 мл насыщенного раствора AgCl прибавили 10 мл раствора NaCl концентрацией 3 %. Сколько молей серебра останется в растворе?
К 125 мл насыщенного раствора PbSO4 прибавлено 5 мл раствора H2SO4 концентрацией 0,5 %. Сколько молей свинца останется в растворе?
К 20 мл Na2AsO4 прилили 30 мл 0,12 М раствора AgNO3. Какая масса мышьяка останется в растворе?
К 50 мл 0,02 М раствора CaCl2 прибавили 50 мл 0,03 М раствора сульфата калия. Какова остаточная концентрация сульфата кальция?
Выпадет ли осадок Mg(OH)2 при действии на 0,2 М раствор сульфата магния равным объемом 0,2 М раствора гидроксида аммония?
Насыщенный раствор CaSO4 смешали с равным объемом раствора, содержащего 0,0248 г (NH4)2C2O4 в 1 л. Произойдет ли образование осадка CaC2O4?
При какой концентрации ионов магния начнется выпадение осадка Mg(OH)2 из раствора, имеющего рН = 8,7?
При какой концентрации хромат-ионов начнется выпадение осадка PbCrO4 из 0,1 М раствора нитрата свинца (II)?
Будет ли осаждаться SrSO4 при добавлении 5 мл насыщенного раствора сульфата кальция к 20 мл раствора, содержащего 0,5 экв. кальция?
В 200 мл раствора содержится по 0,02 экв. хлорида и оксалата натрия. К раствору добавляют нитрат серебра. Какова будет остаточная концентрация хлорид-ионов и когда начнется осаждение Ag2C2O4?
Какое вещество начнет осаждаться первым при постепенном приливании нитрата серебра к раствору, в 1 л которого содержится 0,01 моль KCl и 0,1 моль K2CrO4?
В 100 мл раствора содержится 0,01 экв. ионов Ba2+ и Sr2+. Сколько молей K2CrO4 следует ввести в раствор, чтобы осадить барий?
В 100 мл раствора содержится 0,01 экв. ионов Sr2+. Сколько молей K2CrO4 следует ввести в раствор, чтобы осадить стронций?
|
 Скачать 2.09 Mb.
Скачать 2.09 Mb.